Определение массовой доли хлорида кальция в растворе.
ПЗ №19 ФГОС 2009 года – 1 –
СПЕЦИАЛЬНОСТЬ: 060301 «ФАРМАЦИЯ»
ПРЕДМЕТ: АНАЛИТИЧЕСКАЯ ХИМИЯ
РАЗДЕЛ: III КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ СТУДЕНТАМ
ДЛЯ САМОПОДГОТОВКИ К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ №19
ТЕМА: 3.5.1.: «Комплексонометрия. Определение точной концентрации раствора Трилона Б. Определение массовой доли хлорида кальция в лекарственной форме».
Цель:
1. Закрепить навык стандартизации рабочего раствора по исходному веществу.
2. Научиться определять массовую долю хлорида кальция в растворе методом комплексонометрии.
МЕСТО ПРОВЕДЕНИЯ: лаборатория химии.
ПРОДОЛЖИТЕЛЬНОСТЬ ЗАНЯТИЯ: 180 минут
ОСНАЩЕНИЕ ЗАНЯТИЯ: Таблица « Периодическая таблица химических
элементов Д.И.Менделеева»
Исследуемые вещества и реактивы: навески магния сульфата, растворы хлорида кальция различной концентрации, индикатор - кислотный хром черный, рабочий раствор трилона Б, аммиачно-буферная смесь, вода очищенная.
Посуда: мерные пипетки на 1,2,5, 10 мл,
мерные колбы на 100 мл, воронки,
химические стаканы, мерные пробирки,
колбы для титрования.
Вспомогательный материал: вощаная бумага, фильтровальная бумага.
К занятию студенты должны ЗНАТЬ:
1.Общая характеристика метода комплексонометрии.
2. Индикаторы.
3. Титрование солей металлов.
|
|
|
4. Влияние кислотности растворов (рН).
5. Буферные растворы.
6. Использование метода при анализе лекарственных веществ.
ПЗ №19 ФГОС 2009 года – 2 –
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Какой метод носит название метода комплексонометрии?
2. Что такое комплексоны?
3. Охарактеризуйте комплекс трилона Б с металлом (Na2[MeTr]).
4. Перечислите индикаторы метода комплексонометрии.
5. Почему индикаторы метода комплексонометрии применяются
в твердом виде?
6. Какие требования предъявляются к индикаторам?
7. Охарактеризуйте комплекс металла с индикатором (MeInd).
8. В какой среде ведут титрование?
9. Что используют для создания слабо-щелочной реакции среды?
10. Назовите состав аммиачно-буферной смеси.
11. Какое вещество является установочным веществом метода?
12. Чем обусловлена окраска до и после титрования?
Задания для внеаудиторной самостоятельной работы студентов:
В тетрадях для самостоятельных работ решите задачи:
Задача №1
На титрование 10 мл раствора магния сульфата MgSO4 ∙ 7H2O с молярной концентрацией эквивалента 0,1 моль/л и поправочным коэффициентом 1,01 было израсходовано 10,75 мл раствора Трилона Б.
|
|
|
Опишите технику выполнения титрования. Напишите уравнения реакций. Рассчитайте титр, молярную концентрацию эквивалента и поправочный коэффициент раствора Трилона Б.
Задача №2
 При количественном анализе кальция хлорида CaCI2 ∙ 6H2O было приготовлено разведение 5 – 100.
При количественном анализе кальция хлорида CaCI2 ∙ 6H2O было приготовлено разведение 5 – 100.
10
На 10 мл приготовленного разведения было израсходовано 6,2 мл раствора Трилона Б с молярной концентрацией эквивалента 0,1 моль/л и поправочным коэффициентом 1,02. Опишите технику выполнения титрования. Напишите уравнения реакций. Рассчитайте массовую долю хлорида кальция в растворе.
Задача №3
Рассчитайте массовую долю магния сульфата MgSO4 ∙ 7 Н2О в растворе, если было приготовлено разведение 5 – 50 и на титрование 10 мл приготовленного
раствора было израсходовано 8,2 мл Трилона Б с молярной концентрацией эквивалента 0,1 моль/л и поправочным коэффициентом 0,98.
ПЗ №19 ФГОС 2009 года – 3 –
На занятии студенты должны:
I. Ответить на вопросы входного контроля.
II. Выполнить практическую работу
ПРАКТИЧЕСКАЯ РАБОТА
1. Приготовление стандартного раствора сульфата магния и определение точной концентрации раствора трилона Б.
|
|
|
Цель: Закрепить навык стандартизации рабочего раствора по установочному (исходному) веществу.
а) Приготовление стандартного раствора сульфата магния.
Задание: Приготовить 100 мл раствора магния сульфата с молярной концентрацией эквивалента Сэ = 0,1 моль/л. Описать технику выполнения работы. Вычислить титр, молярную концентрацию эквивалента и поправочный коэффициент для раствора сульфата магния.
Выполнение работы:
Навеску сульфата магния получить у преподавателя.
В мерную колбу на 100 мл поместить (через сухую воронку) навеску магния сульфата. Растворить в небольшом количестве(30-50 мл) воды очищенной. Довести объем до метки очищенной водой. Хорошо перемешать.
Выполнить расчет по формулам:
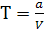 ;
; 
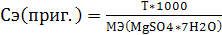 ;
; 
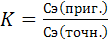
Вывод: раствор магния сульфата-раствор с приготовленным титром.
б) определение точной концентрации раствора трилона Б.
В колбу для титрования поместить 5 мл приготовленного стандартного раствора сульфата магния (отмерить мерной пипеткой, промытой водой очищенной и приготовленным стандартным раствором сульфата магния),5 мл аммиачно-буферной смеси (отмерить мерной пробиркой) и 1/2 глазной лопаточки индикатора ЭХЧ. Титровать содержимое колбы раствором трилона Б до перехода окраски из вишнево-красной в синюю. Составить условие задачи.
|
|
|
ПЗ №19 ФГОС 2009 года – 4 –
Выполнить расчет:
Сэ( T рилон Б) ∙ M э( T рилон Б)
T ( T рилон Б) = -----------------------------
1000
Сэ(М gSO 4 ∙ 7Н2 O ) ∙ V (М gSO 4 ∙ 7Н2 O ) ∙ К
Сэ(Tрилон Б) = ---------------------------------------------------
V (Tрилон Б)
Сэ(Tрилон Б)
К(Tрилон Б) = ---------------------
Сэ(М gSO 4 ∙ 7Н2 O )
Вывод: Раствор трилона Б-раствор с установленным титром.
ПРАКТИЧЕСКАЯ РАБОТА № 2
Определение массовой доли хлорида кальция в растворе.
Цель: научиться определять массовую долю хлорида кальция методом комплексонометрии.
1. В колбу для титрования поместить:
а) 1 мл раствора хлорида кальция (отмерить мерной пипеткой, промытой водой и раствором хлорида кальция).
б) 2 мл воды очищенной (отмерить мерной пробиркой).
в) 3 мл аммиачно-буферной смеси (отмерить мерной пробиркой).
г) 1/2 глазной лопаточки индикатора.
2. Провести титрование:
Пипетку для титрования объемом 5мл промыть и заполнить рабочим раствором Трилона Б с молярной концентрацией эквивалента 0,1 моль/л.
К содержимому колбы по каплям прибавлять раствор Трилона Б до перехода окраски из вишнево-красной в синюю.
3. Записать результаты. Титрование провести ещё 2 раза.
Составить условие задачи:
 CaCl2 ∙ 6Н2 O Tрилон Б
CaCl2 ∙ 6Н2 O Tрилон Б
V=1 мл Сэ = 0,1моль/л
Vср =
K =1
ПЗ №19 ФГОС 2009 года – 5 –
Написать схематические уравнения реакций данного определения:
Са2+ + Н2Ind ↔ CaInd + 2Н+
вишнево-красный
Ca2+ + Nа2H2Tr ↔ Na2[CaTr] + 2Н+
бесцветный
CaInd + Nа2H2Tr → Na2[CaTr] + Н2Ind
синий
Дата добавления: 2021-03-18; просмотров: 673; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
