Определение массовой доли пероксида водорода в растворе.
ПЗ №14 ФГОС 2009 года – 1 –
ФОРМА ОБУЧЕНИЯ: ОЧНАЯ
СПЕЦИАЛЬНОСТЬ: 060301 «ФАРМАЦИЯ»
ПРЕДМЕТ: АНАЛИТИЧЕСКАЯ ХИМИЯ
РАЗДЕЛ: III КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ СТУДЕНТАМ
ДЛЯ САМОПОДГОТОВКИ К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ №14
ТЕМА 3.3.1.: « Методы окислительно – восстановительного титрования.
Определение массовой доли пероксида водорода в растворе. Броматометрия. Определение массовой доли резорцина ».
ЦЕЛИ ЗАНЯТИЯ:
1.Закрепить знания по методам перманганатометрии и броматометрии;
2.Научиться определять и рассчитывать массовую долю пероксида водорода в растворе по результатам титрования.
3. Научиться проводить количественный анализ лекарственного средства (субстанции) резорцина методом броматометрии.
4.Научиться выполнять расчет и делать заключение (по количественному содержанию) о качестве лекарственной субстанции.
МЕСТО ПРОВЕДЕНИЯ: лаборатория химии.
ПРОДОЛЖИТЕЛЬНОСТЬ ЗАНЯТИЯ: 180 минут
ОСНАЩЕНИЕ ЗАНЯТИЯ: Таблица « Периодическая таблица химических
элементов Д.И.Менделеева»
Экспериментальные задачи: растворы пероксида водорода различной концентрации;
Реактивы: рабочий раствор KMnO4 с концентрацией Сэ(KMnO4) = 0,1 моль/л; раствор H2SO4 , Сэ(H2SO4) = 2 моль/л;
|
|
|
Оборудование: мерные пипетки на 1,2, 5 и 10 мл, колбы для титрования,
мерные колбы на 100 мл, воронки, пробирки.
ПЗ №14 ФГОС 2009 года – 2 –
К занятию студенты должны ЗНАТЬ:
1. Основные сведения о титриметрическом анализе.
2. Точка эквивалентности и способы ее фиксации. Индикаторы.
3. Требования к реакциям в титриметрическом анализе.
4. Классификация методов и способы титрования.
5. Способы выражения концентрации рабочего раствора.
Растворы с молярной концентрацией эквивалента, молярные
растворы. Титр.
6. Титрованные растворы. Растворы с титром приготовленным и
титром установленным.
7. Исходные вещества. Требования к исходным веществам.
8. Вычисления в титриметрическом анализе.
9. Понятие о поправочном коэффициенте. Способы его нахождения.
10.Теоретические основы методов окислительно-восстановительного титрования.
11. Классификация методов окислительно – восстановительного титрования.
12. Перманганатометрия:
- Окислительные свойства KMnO4 в зависимости от реакции среды;
- Вычисления эквивалента KMnO4 в зависимости от среды раствора;
|
|
|
- Приготовление раствора KMnO4;
- Исходные вещества в методе перманганатометрии. Приготовление стандартного раствора щавелевой кислоты;
- Определение точной концентрации рабочего раствора KMnO4;
- Определение w (%) Н2О2 в растворе.
13.Метод броматометрии:
− Рабочий раствор. Стандартный раствор.
− Химические реакции, лежащие в основе метода.
− Условия титрования.
− Способы фиксации точки эквивалентности.
ПЗ №14 ФГОС 2009 года – 3 –
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Какой анализ называют титриметрическим?
2. Что показывает молярная концентрация эквивалента?
3. Что показывает титр раствора?
4. Что такое точка эквивалентности?
5. Как фиксируют точку эквивалентности?
6. Какие требования предъявляют к реакциям в титриметрическом анализе?
7. Какие существуют методы титриметрического анализа?
8. Какие методы называются методами оксидиметрии или окислительно - восстановительного титрования ( ОВТ)?
9. Как классифицируются методы ОВТ?
10. Какой метод называют методом перманганатометрии?
11. Какие вещества определяют этим методом?
|
|
|
12. Какие установочные вещества применяют в методе перманганатометрии?
13. Как фиксируется точка эквивалентности?
14. В какой среде проводят титрование методом перманганатометрии?
15. Какую роль выполняет кислая среда?
16. Какие особенности имеет приготовление рабочего раствора перманганата калия?
17. При каких условиях выполняют стандартизацию раствора калия перманганата по щавелевой кислоте?
18. Что показывает титр по определяемому веществу?
19. Как прочитать выражение Т KMnO4/H2O2 = 0,0017 г/мл ?
20. Какой метод называется методом броматометрии?
21. Какой основной рабочий раствор применяют в методе броматометрии?
22. Какие варианты броматометрического метода Вы знаете?
23. Какие способы титрования применяют в методе броматометрии?
24. Как фиксируется точка эквивалентности при прямом способе титрования в методе броматометрии?
25. Как фиксируется точка эквивалентности при обратном способе титрования в методе броматометрии?
26. В какой среде ведут титрование в методе броматометрии?
ПЗ №14 ФГОС 2009 года – 4 –
Задания для внеаудиторной самостоятельной работы студентов:
В тетрадях по самоподготовке:
|
|
|
а) Напишите уравнение реакции, лежащее в основе определения массовой доли пероксида водорода в растворе методом перманганатометрии.
б) Решите задачи:
Задача № 1.
Рассчитайте навеску щавелевой кислоты (Н2С2О4*2Н2О),необходимую для приготовления 100 мл раствора с молярной концентрацией эквивалента 0,1 моль/л. Вычислите Т, Сэкв, К приготовленного раствора.
Задача № 2. Определите точную концентрацию раствора перманганата калия по стандартному раствору щавелевой кислоты, если на титрование 10 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,1 моль/л , К=1,02 израсходовано 10,33 мл рабочего раствора перманганата калия.

 Задача № 3. Определите массовую долю перекиси водорода в растворе, если было приготовлено разведение 5 100 и на титрование 5 мл
Задача № 3. Определите массовую долю перекиси водорода в растворе, если было приготовлено разведение 5 100 и на титрование 5 мл
5
приготовленного разведения было израсходовано 4.35 мл КМnО4 с молярной концентрацией эквивалента 0,1моль/л и поправочным коэффициентом 0,98.
Задача № 4. Напишите уравнение, вычислите титр рабочего раствора по
определяемому веществу и массовую долю определяемого вещества.
| Н2О2 V = 2 мл | KMnO4 Cэ = 0,1 моль/л V = 4,46 мл к = 1,0 |
| ω% = ? |
ПЗ №14 ФГОС 2009 года – 5 –
На занятии студенты должны:
I. Ответить на вопросы входного контроля.
II. Выполнить практическую работу
ПРАКТИЧЕСКАЯ РАБОТА №1
Определение массовой доли пероксида водорода в растворе.
Цель: Научиться определять массовую долю пероксида водорода методом перманганатометрии.
АЛГОРИТМ ВЫПОЛНЕНИЯ РАБОТЫ:
1. Приготовление разведения:
а) Мерную колбу на … мл промыть водой очищенной.
б) Мерную пипетку на … мл промыть водой очищенной и анализируемым раствором пероксида водорода.
в) Мерной пипеткой на … мл отмерить анализируемый раствора пероксида водорода (х) и перенести этот объем в мерную колбу заданного объема (у).
г) Довести объем до метки очищенной водой (последние капли воды добавить глазной пипеткой).
д) Хорошо перемешать (10-15 раз).
2. Проведение титрование:
а) Пипетку на …. мл промыть приготовленным разведением пероксида водорода.
б) В колбу для титрования поместить …. мл (z) приготовленного разведения пероксида водорода и такое же количество мл р-ра серной кислоты с молярной концентрацией эквивалента 2 моль/л.
в) Пипетку на … мл промыть водой очищенной, промывным раствором перманганата калия с молярной концентрацией эквивалента 0,1 моль/л
и заполнить рабочим раствором перманганата калия.
г) Титровать исследуемый раствор пероксида водорода три раза рабочим раствором перманганата калия с молярной концентрацией эквивалента 0,1 моль/л до появления слабо-розовой окраски раствора, не исчезающей при стоянии раствора в течение 30 секунд.
д) Вычислить средний объем рабочего раствора перманганата калия
V1+V2+V3
Vcр =----------
3
е) Написать уравнение реакции количественного определения, решить его,
указать процессы, окислитель и восстановитель.
ж) Составить условие для расчета.
ПЗ №14 ФГОС 2009 года – 6 –
З) Выполнить расчет:
Условие для расчета:
 Н2О2 КМ n О4
Н2О2 КМ n О4
разведение Сэ = 0,1моль/л
 х – у Vср =
х – у Vср =

 z K =1,02
z K =1,02
ω % = ?
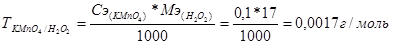
т. е. 0,0017 г/моль пероксида водорода эквивалентно или соответствует 1 мл рабочего раствора KMnO4 с концентрацией 0,1 моль/л.
-2ē
Мэ(H2O2) = М(H2O2) / 2 = 34 / 2 = 17 г/моль, т. к. H2O2 → O2 + 2H+
восстановитель
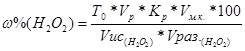 = … %
= … %
Вывод: Массовая доля пероксида водорода в растворе … %.
ПЗ №14 ФГОС 2009 года – 7 –
Практическая работа №2
«Количественное определение резорцина».
1. Точную навеску 0,1 г резорцина растворить в 20 мл воды и довести объем раствора до 100 см3.
2. В склянку с притертой пробкой поместить:
а) 20 мл приготовленного разведения резорцина;
б) 30 мл раствора бромата калия c(KBrO3) = 0,1 моль/л (V1);
в) 5 мл 10% бромида калия;
г) 5 мл 50% серной кислоты;
д) перемешать.
3. Содержимое колбы оставить на 15 минут.
4. Затем добавить 10 мл 10% KI и оставить на 10 минут в темном месте.
5. Добавить смеси 2 мл хлороформа.
6. Титровать выделившийся йод тиосульфатом натрия (V2).
7. Написать химизм определения.
8. Выполнить расчет содержания резорцина в процентах.
% С = ТKBrO3/резорцин ∙ (V1∙K1 – V2∙K2) ∙ 100% ∙ 100 (м.к.) = …
0,1 ∙ 20
III. Ответьте на вопросы выходного контроля.
ПЗ №14 ФГОС 2009 года – 8 –
ПОСЛЕ ЗАНЯТИЯ СТУДЕНТЫ ДОЛЖНЫ:
ЗНАТЬ:
- теоретические основы аналитической химии;
- методы количественного анализа;
- требования к реакциям, исходным веществам, титрованным растворам;
- вычисления в титриметрическом анализе.
УМЕТЬ:
- владеть техникой обычных аналитических операций;
- уметь по химическим свойствам веществ, в том числе лекарственных, подбирать методы качественного и количественного анализа;
- грамотно оформлять и обрабатывать полученные результаты;
- работать с мерной посудой;
- титровать пипеткой;
- точно фиксировать точку конца титрования (точку эквивалентности);
- выбирать необходимые методы анализа;
- применять методы количественного анализа при контроле различных исследуемых веществ;
- наблюдать, обобщать, сравнивать, математически обрабатывать экспериментальные данные.
ПЗ №14 ФГОС 2009 года – 9 –
Приобретаемые компетенции:
1. Общие компетенции:
ОК 1. Понимать сущность и социальную значимость своей будущей
профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и. использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в
профессиональной деятельности.
ОК 6. Работать в коллективе и в команде.
ОК 8. Самостоятельно определять задачи профессионального и
личностного развития, заниматься самообразованием, осознанно
планировать повышение своей квалификации.
Профессиональные компетенции (ПК):
ПК 1.1. Организовывать прием, хранение лекарственных средств, лекарственного растительного сырья и товаров аптечного ассортимента в соответствии с требованиями нормативно – правовой базы.
ПК 1.6. Соблюдать правила санитарно – гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
ПК 2.1. Изготовлять лекарственные формы по рецептам и требованиям учреждения здравоохранения.
ПК 2.2. Изготавливать внутриаптечную заготовку и фасовать лекарственные средства для последующей реализации.
ПК 2.3.Владеть обязательными видами внутриаптечного контроля лекарственных средств.
ЛИТЕРАТУРА:
Основная:
1.А.А.Ищенко «Аналитическая химия» М. «Академия» 2012 г. стр.184 – 187;
2.Полеес М.Э., Душечкина И.Н. «Аналитическая химия. М.: Медицина, 2010 стр.202-216.
Дополнительная
1. Барсукова З.С. «Аналитическая химия». М.: Высшая школа, 2008.
2. Харитонов Ю.Я., «Аналитическая химия». Москва «Высшая школа», 2007.
3. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. «Аналитическая химия», М., Химия, 2007.
4. Пилипенко А.Т., Пятницкий И.В. "Аналитическая химия" в 2-х книгах.
М., Химия, 2008.
Дата добавления: 2021-03-18; просмотров: 705; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
