Материальный баланс. Рабочая линия.
Способы выражения состава фаз
В ходе массообменных процессов изменяется состав фаз. Это приводит к изменению количества (массы) компонента (компонентов) в каждой из фаз, а также к изменению массы самих фаз. Взаимосвязи масс компонентов и фаз описываются при этом уравнениями материального баланса. Движущая сила массообмена, как отмечалось ранее, также описывается с применением составов фаз (через концентрацию распределяемого компонента). Поэтому рассмотрение информации о способах выражения состава фаз важно для изучения, анализа и расчетов массообменных процессов. Основными способами выражения составов фаз, актуальными при рассмотрении процессов массообмена, являются концентрации и доли компонента.
Например, при абсорбции аммиака из воздуха водой газовая фаза G состоит из аммиака (распределяемого компонента) и воздуха (смесь газов – инертный компонент), а жидкая L – из воды и аммиака. В этом случае, для определения состава фазы достаточно указать концентрацию распределяемого компонента в фазе, которая может быть выражена:
В мольных (молярных) долях, представляющих собой отношение количества данного компонента к количеству всей фазы:
 -в газовой фазе
-в газовой фазе  ,
, 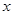 - в жидкой
- в жидкой 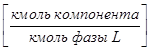 ;
;
В массовых долях представляющих собой отношение массы данного компонента к массе всей фазы:
 - в газовой фазе
- в газовой фазе 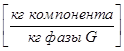 ,
, 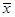 - в жидкой
- в жидкой 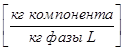
Для рассматриваемой в качестве примера системы аммиак – воздух-вода:
|
|
|

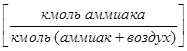 ,
, 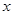
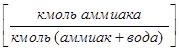 ;
;

 ,
, 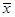
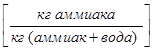
В ряде процессов (абсорбция, экстракция) фазы не участвуют в процессе массообмена, а являются только инертными носителями, их количества не меняются в процессе. Поэтому концентрацию распределяемого компонента удобно выражать в относительных единицах:
Мольных
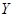 - в газовой фазе
- в газовой фазе 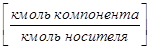 ,
, 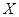 - в жидкой
- в жидкой 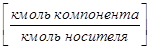
Массовых
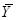 - в газовой фазе
- в газовой фазе 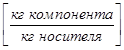 ,
, 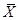 в жидкой
в жидкой 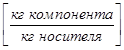
Для рассматриваемой в качестве примера системы аммиак – воздух-вода:
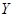
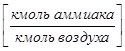 ,
, 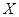
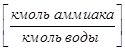 ;
;
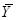
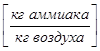 ,
, 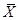

Если используются мольные доли, то расходы фаз будут иметь размерность:
- газовой (паровой) фазы - 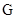
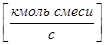 ,
, 
- жидкой фазы -L 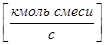 ,
, 
Для рассматриваемого примера:
- Расход газовой (паровой) фазы G 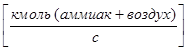 ;
; 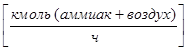
- Расход жидкой фазы -L 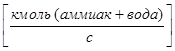 ;
; 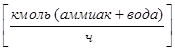
Если составы фаз задаются в массовых долях, то расходы будут массовыми.
- газовой (паровой) фазы G  ,
, 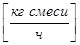
- жидкой фазы L  ,
, 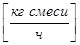
Для рассматриваемого примера:
- Расход газовой (паровой) фазы G 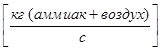 ;
; 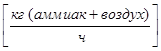
- Расход жидкой фазы -L 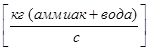 ;
; 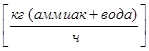
Если используются относительные мольные единицы, то расходы фаз будут иметь размерность:
-газовой (паровой) фазы 
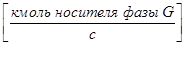 ;
; 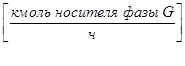
- жидкой фазы L
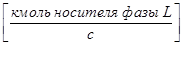 ;
; 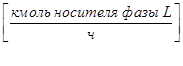
Для рассматриваемого примера:
- Расход газовой (паровой) фазы G  ;
; 
- Расход жидкой фазы -L 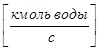 ;
; 
Если используются относительные массовые единицы, то расходы фаз будут иметь размерность:
|
|
|
-газовой (паровой) фазы 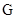
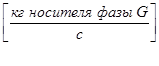 ;
; 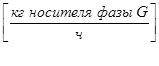
- жидкой фазы L
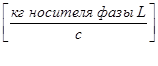 ;
; 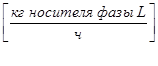
Для рассматриваемого примера:
- Расход газовой (паровой) фазы G 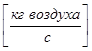 ;
; 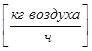
- Расход жидкой фазы -L  ;
; 
Равновесие при массопередаче
Правило фаз. Знание равновесия в процессах массопередачи позволяет установить пределы, до которых могут протекать эти процессы. В основе равновесия лежит известное правило фаз:
Ф + С = К + 2, (1)
где Ф - число фаз; С - число степеней свободы, т. е. число независимых переменных, значения которых можно произвольно изменять без нарушения числа или вида (состава) фаз в системе; К - число компонентов системы.
Правило фаз указывает число параметров, которое можно менять произвольно (в известных пределах) при расчете равновесия в процессах масообмена.
Зависимости между независимыми переменными могут быть изображены в плоских координатах в виде так называемых фазовых диаграмм. В расчетах по массопередаче используют диаграммы зависимости давления от концентрации (при t = const), температуры от концентрации (при Р = const) и диаграммы зависимости между равновесными концентрациями фаз, приведенные ниже.
|
|
|
Фазовое равновесие. Линия равновесия. Рассмотрим в качестве примера процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой, т. е. ввиду отсутствия равновесия переходит из газовой фазы Фу, где его концентрация равна у, в жидкую фазу Фх, имеющую начальную концентрацию х = 0. С началом растворения аммиака в воде начнется переход части его молекул в обратном направлении со скоростью, пропорциональной концентрации аммиака в воде и на границе раздела фаз. С течением времени скорость перехода аммиака в воду будет снижаться, а скорость обратного перехода возрастать, причем такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равны друг другу. При равенстве скоростей установится динамическое равновесие, при котором не будет происходить видимого перехода вещества из фазы в фазу.
При равновесии достигается определенная зависимость между предельными или равновесными концентрациями распределяемого вещества в фазах для данных температуры и давления, при которых осуществляется процесс массопередачи.
|
|
|
В условиях равновесия некоторому значению 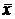 отвечает строго определенная равновесная концентрация в другой фазе, которую обозначим через
отвечает строго определенная равновесная концентрация в другой фазе, которую обозначим через 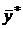 . Соответственно концентрация у отвечает равновесная концентрация
. Соответственно концентрация у отвечает равновесная концентрация 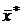 . В самом общем виде связь между концентрациями распределяемого вещества в фазах при равновесии выражается зависимостью:
. В самом общем виде связь между концентрациями распределяемого вещества в фазах при равновесии выражается зависимостью:
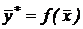 или
или  . (2)
. (2)
Любая из этих зависимостей изображается графически линией равновесия, которая либо является кривой, как показано на рис. 1, либо в частном случае - прямой линией.
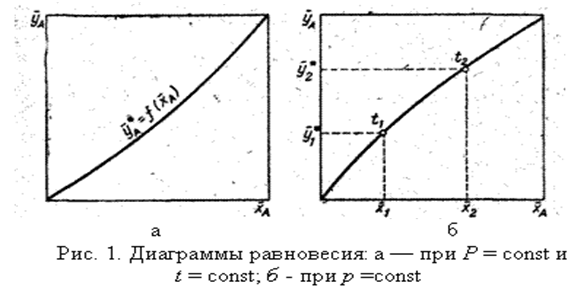
На рис. 1, а показана равновесная кривая для системы с компонентами-носителями, выражающая зависимость равновесной концентрации, например в газовой фазе, от концентрации жидкой фазы при Р = const и t = const. На рис. 1, б приведен пример равновесной кривой для процесса ректификации, построенной при Р = const. Каждая точка кривой, как показано на рисунке, соответствует разным температурам (t1, t2 и т. д.).
Отношение концентраций фаз при равновесии называется коэффициентом распределения  . Для разбавленных растворов линия равновесия близка к прямой, и т является практически величиной постоянной, равной тангенсу угла наклона линии равновесия.
. Для разбавленных растворов линия равновесия близка к прямой, и т является практически величиной постоянной, равной тангенсу угла наклона линии равновесия.

Рис.1-а Равновесная зависимость на примере абсорбции
Итак, как видно из рис.1-а имеется 3 разных варианта (3точки на графике)
1. Рабочая концентрация в газовой фазе выше равновесной 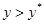 , в жидкой -меньше равновесной
, в жидкой -меньше равновесной 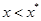 . Распределяемый компонент будет переходить из газовой фазы в жидкую, что соответствует процессу абсорбции.
. Распределяемый компонент будет переходить из газовой фазы в жидкую, что соответствует процессу абсорбции.
2. Рабочая концентрация в газовой фазе ниже равновесной 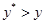 , в жидкой -выше равновесной
, в жидкой -выше равновесной  . Распределяемый компонент будет переходить из жидкой фазы в газовую, что соответствует процессу десорбции.
. Распределяемый компонент будет переходить из жидкой фазы в газовую, что соответствует процессу десорбции.
3. Рабочая точка находится на линии равновесия: 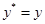 ;
; 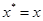 . Это говорит о том, что система находится в состоянии динамического равновесия, переноса не происходит.
. Это говорит о том, что система находится в состоянии динамического равновесия, переноса не происходит.
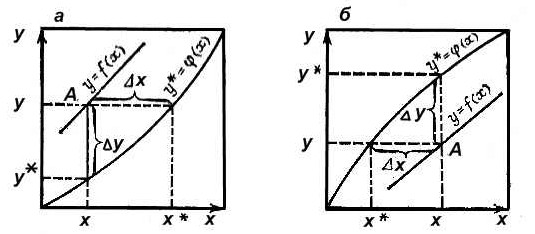
а – рабочая линия расположена выше линии равновесия; б – рабочая линия расположена ниже линии равновесия
Конкретный вид законов равновесного распределения различен для разных процессов массопередачи. Так, например, в процессе абсорбции при низких концентрациях распределяемого вещества в исходном растворе равновесие описывается законом Генри для идеальных растворов в процессах ректификации - законом Рауля и т. д.
Зная линию равновесия для конкретного процесса и рабочие, т. е. неравновесные, концентрации фаз в соответствующих точках, можно определить направление и движущую силу массопередачи в любой точке аппарата. На основе этих данных может быть рассчитана средняя движущая сила, а по ней - скорость процесса массопередачи.
Материальный баланс. Рабочая линия.
Рабочие концентрации распределяемого вещества не равны равновесным, и в действующих аппаратах никогда не достигают равновесных значений.
Зависимость между рабочими концентрациями распределяемого вещества в фазах 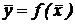 изображается линией, которая носит название рабочей линии процесса. Вид функции
изображается линией, которая носит название рабочей линии процесса. Вид функции 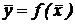 или уравнение рабочей линии в его общем виде, является одинаковым для всех массообменных процессов и получается из их материальных балансов.
или уравнение рабочей линии в его общем виде, является одинаковым для всех массообменных процессов и получается из их материальных балансов.
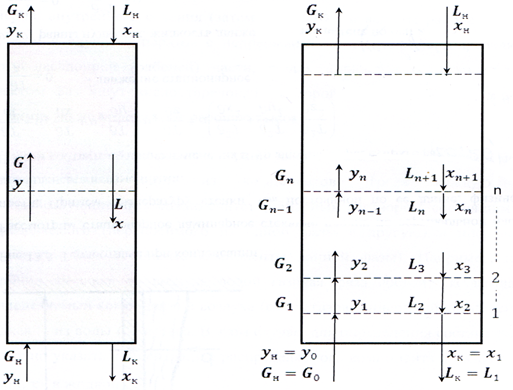
Рис.2. Принципиальные схемы противоточных колонных аппаратов
Рассмотрим схему массообменного аппарата, работающего в режиме идеального вытеснения при противотоке фаз (рис. 2). Пусть в процессе массопередачи из фазы в фазу, например из газовой фазы в жидкую, переходит только один распределяемый компонент (скажем, аммиак).
Сверху в аппарат поступает Lн кг/с одной фазы (жидкой), содержащей 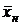 вес. долей распределяемого компонента, а снизу из аппарата удаляется Lк кг/с той же фазы, содержащей
вес. долей распределяемого компонента, а снизу из аппарата удаляется Lк кг/с той же фазы, содержащей 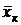 вес. долей распределяемого компонента. Снизу в аппарат поступает
вес. долей распределяемого компонента. Снизу в аппарат поступает 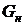 кг/с другой фазы (газовой) концентрацией
кг/с другой фазы (газовой) концентрацией 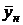 и сверху удаляется
и сверху удаляется  кг/с этой фазы, имеющей концентрацию
кг/с этой фазы, имеющей концентрацию  вес. долей распределяемого компонента.
вес. долей распределяемого компонента.
Тогда материальный баланс по всему веществу
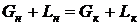 , (3)
, (3)
и материальный баланс по распределяемому компоненту
 . (4)
. (4)
Теперь напишем уравнения материального баланса для части аппарата от его нижнего конца до некоторого произвольного сечения, для которого расходы фаз составляют G и L кг/с, а их текущие концентрации равны 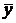 и
и 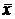 соответственно.
соответственно.
Материальный баланс по всему веществу
 , (5)
, (5)
и материальный баланс по распределяемому компоненту
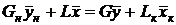 . (6)
. (6)
Материальный баланс процесса абсорбции.
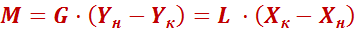 , (6)
, (6)
здесь: 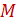 - количество распределённого компонента, поглощаемого из газовой смеси абсорбентом, кмоль/с;
- количество распределённого компонента, поглощаемого из газовой смеси абсорбентом, кмоль/с; 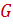 и
и 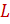 - расходы инертных носителей, соответственно газа носителя и абсорбента, кмоль/с;
- расходы инертных носителей, соответственно газа носителя и абсорбента, кмоль/с;  и
и 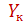 – начальная и конечная концентрации абсорбтива в газовой смеси, кмоль/кмоль инертного газа;
– начальная и конечная концентрации абсорбтива в газовой смеси, кмоль/кмоль инертного газа;  и
и 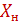 - конечная и начальная концентрация абсорбтива в поглотителе, кмоль/кмоль абсорбента.
- конечная и начальная концентрация абсорбтива в поглотителе, кмоль/кмоль абсорбента.
Решая (6) уравнение относительно 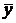 , получим
, получим
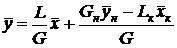 . (7)
. (7)
Уравнение (7) представляет собой уравнение рабочей линии, выражающее связь между рабочими концентрациями распределяемого компонента в фазах для произвольного сечения аппарата.
Расходы фаз постоянны по высоте аппарата, например в процессах ректификации, когда числа молей компонентов, которыми обмениваются фазы, равны. В других случаях, если концентрации фаз мало изменяются по высоте аппарата, то расходы фаз по его высоте можно с достаточной для практических целей точностью считать постоянными, т. е. принять L = const и G = const. При этом Lк = L, Gн = G и уравнение (7) приводится к виду
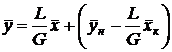 . (8)
. (8)
Вводя обозначения 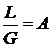 и
и 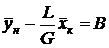 , находим
, находим
 . (9)
. (9)
Выражения (8) и (9) являются уравнениями рабочей линии, которыми обычно пользуются при расчетах массообменных процессов. Выразим уравнения рабочих линий через удельный расход поглотителя 
Где где 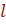 - носит название удельного расхода поглотителя- абсорбента.
- носит название удельного расхода поглотителя- абсорбента.
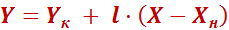
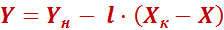 .
.
Удельный расход абсорбента 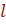 является одним из важнейших параметров процесса абсорбции, поскольку абсолютное его значение определяет не только среднюю движущую силу процесса, но и экономику процесса абсорбции в целом.
является одним из важнейших параметров процесса абсорбции, поскольку абсолютное его значение определяет не только среднюю движущую силу процесса, но и экономику процесса абсорбции в целом.
Рабочая линия представляет собой прямую, которая наклонена к горизонту под углом, тангенс которого равен А, и отсекает на оси ординат отрезок, равный В. Рабочая линия для всего аппарата ограничена точками с координатами 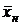 и
и  (верхний конец аппарата, рис. 3) и
(верхний конец аппарата, рис. 3) и 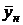 и
и 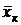 (нижний конец аппарата).
(нижний конец аппарата).
Для другого типа аппарата со ступенчатым контактом фаз тарельчатые колонны, материальный баланс будет выглядеть как и для аппаратов с непрерывным контактом, если расходы фаз меняются по высоте аппарата – т.е. зависят от номера ступени, уравнение не линейно и должно быть дополнено балансовыми соотношениями для инертных компонентов:
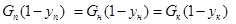 (10)
(10)
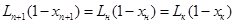 (11)
(11)
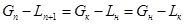 (12)
(12)
Дата добавления: 2021-03-18; просмотров: 365; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
