Посттрансляционная модификация белков.
ТРАНСКРИПЦИЯ И ТРАНСЛЯЦИЯ.
1.
 |
Общие сведения.
Определение: Ген – это совокупность структурных и регуляторных последовательностей ДНК, определяющих возможность синтеза молекул пептида или РНК при данных условиях экспрессии.
В двухцепочечной спирали, несущей нуклеотидную последовательность гена, одна из цепей носит название кодогенной (с которой происходит транскрипция); комплементарная ей вторая цепь носит название смысловой, и именно она определяет характеристики гена.
Регуляторные последовательности контролируют инициацию, скорость, окончание транскрипции и другие функции.
Регуляторные последовательности располагаются как на 5’, так и на 3’ концах ДНК гена.
На 5’-конце находятся: промотор – последовательность, с которой связывается РНК-полимераза; а так же регуляторные последовательности, с которыми связываются регуляторные белки (активаторы и репрессоры транскрипции).
На 3’-конце гена локализуется терминатор - регуляторная последовательность, служащая сигналом окончания транскрипции.
У прокариот до трети генов имеет оперонную организацию. Опероном называют группу структурных генов, транскрипция которых контролируется одним оператором – специфической последовательностью, частично перекрывающейся с общим для этих генов промотором, с которой связываются регуляторные белки-репрессоры.
|
|
|
У эукариот так же существуют дистальные регуляторные последовательности, расположенные на расстоянии до нескольких сотен тысяч пар оснований. С этими последовательностями связываются специфические факторы транскрипции. Дистальные последовательности, активирующие транскрипцию, называются энхансерами, блокирующие или тормозащие транскрипцию – сайленсерами.
Рибонуклеиновые кислоты представлены одной полинуклеотидной цепью и состоят из 4 видов рибонуклеотидов, содержащих основания: аденин (А), гуанин (Г), цитозин (Ц) и урацил (У), в отличие от ДНК, состоящей из дезоксирибонуклеотидов.
Основной функцией РНК является реализация программы синтеза белков. Этот процесс состоит из нескольких этапов, в которых участвуют разные виды РНК.
Информационная, или матричная РНК, мРНК – носитель генетической информации о первичной структуре белка. Содержится в ядре, цитоплазме и митохондриях. Все зрелые мРНК у эукариот имеют сходное строение, состоят из нескольких участков, выполняющих разные функции.
Кэп состоит из N7-метилгуанозинтрифосфата, соединенного с началом РНК 5’-5’ связью. Он защищает транскрипт от разрушения экзонуклеазами.
За кэпом располагается 5’-нетранслируемый участок (5’-UTR) , содержащий сайт связывания с малой субъединицей рибосомы (у прокариот этот сайт связывания носит название последовательности Шайна-Дельгарно).
|
|
|
За 5’-UTR участком следует инициирующий или старт-кодон AUG (кодирует метионин у эукариот).
Старт- и стоп-кодоны ограничивают кодирующий участок мРНК, содержащий первичную аминокислотную последовательность белка.
После стоп-кодона располагается 3’-нетранслируемый участок (3’-UTR), модержащий сигнал полиаденилирования, за 3’-UTR располагается поли(А)-хвост, состоящий из ~200 неклеотидов.
 Поли(А)-хвост определяет продолжительность функционирования зрелых мРНК в клетке: после каждого раунда трансляции от этого хвоста отщепляется 10-15 нуклеотидов.
Поли(А)-хвост определяет продолжительность функционирования зрелых мРНК в клетке: после каждого раунда трансляции от этого хвоста отщепляется 10-15 нуклеотидов.
Прокариотические мРНК не имеют кэпа, нетранслируемых участков и поли(А)-хвоста.
Транспортные РНК (тРНК) состоят из 70-100 нуклеотидов. На 5’-конце всех тРНК содержится гуанозинфосфат, на 3’-конце – последовательность ССА со свободной 3’-OH группой, к которой прикрепляется транспортируемая аминокислота. Три нуклеотида в составе тРНК, комплементарные кодонам в ДНК, кодирующим определенную аминокислоту, называются антикодоном.
 Все транспортные РНК приобретают третичную структуру, похожую на перевернутую букву «L». В состав нуклеотидов тРНК входят метилированные основания, которые придают устойчивость к действию нуклеаз цитоплазмы и поддерживают третичную структуру молекулы.
Все транспортные РНК приобретают третичную структуру, похожую на перевернутую букву «L». В состав нуклеотидов тРНК входят метилированные основания, которые придают устойчивость к действию нуклеаз цитоплазмы и поддерживают третичную структуру молекулы.
|
|
|
В клетке имеется 45 видов молекул тРНК, а не 61, поскольку некоторые антикодоны могут связываться с несколькими кодонами мРНК.
Функция тРНК состоит в переносе аминокислот к месту синтеза белка в рибосомах.
Рибосомная РНК (рРНК) – самая крупная из всех видов РНК. Она синтезируется в ядрышке и участвует в образовании большой и малой субъединиц рибосом.
Малые ядерные РНК (мяРНК, snRNA) – встречаются только в ядрах эукариотических клеток. Они участвуют в процессах сплайсинга и поддержании цеостности теломер.
МикроРНК ( miRNA ) и малые интерферирующие РНК ( siRNA ) – играют большую роль в процессах трансфекции и регуляции экспрессии генов.
Транскрипция.
Транскрипция – это процесс перевода генетической информации, содержащейся в ДНК, в последовательность нуклеотидов РНК. То есть это процесс синтеза РНК на матрице ДНК.
В процессе транскрипции выделяют три стадии: инициация, элонгация и терминация.
Инициация. РНК-полимераза присоединяется к промотору. У прокариот полимераза может связываться без участия посредников, у эукариот полимераза присоединяется к промотору только после того, как с промотором свяжутся белки, называющиеся транскрипционными факторами. В результате взаимодействия этих факторов и полимеразы образуется единая в функциональном отношении структура, называемая комплекс, инициирующий транскрипцию.
|
|
|
Выделяют две группы транскрипционных факторов: общие и специальные.
Общие факторы первыми присоединяются к промоторам в процессе формирования инициирующего транскрипцию комплекса, они обеспечивают инициацию транскрипции не всех, а лишь постоянно экспрессирующихся генов, продукты которых необходимы для нормального существования клетки (так называемые гены домашнего хозяйств, house-keeping genes). Для всех других генов, таких как гены адаптивного ответа или цитодифференцировки, кроме общих факторов необходимы еще и специальные.
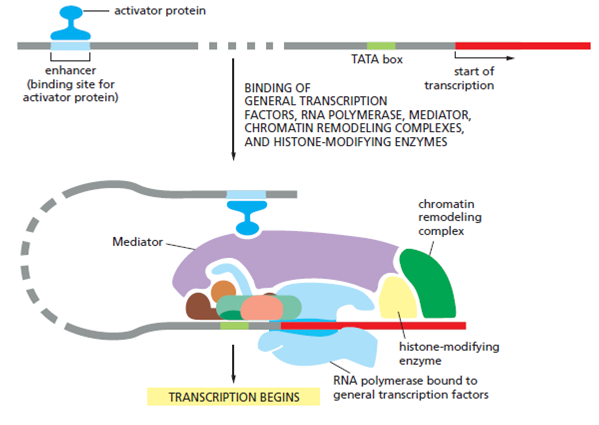
После присоединения к промотору РНК-полимераза разрывает водородные связи между цепями ДНК на участке 10-20 нуклеотидов, в результате чего цепи расходятся, и на
кодогенной цепи происходит синтез мРНК в направлении 5’-3’. 
При переходе от инициации к элонгации факторы транскрипции отделяются от РНК-полимеразы, вместо них к полимеразе присоединяются другие белки – факторы элонгации.
На стадии элонгации РНК-полимераза, продвигаясь вдоль цепи ДНК, раскручивает её, экспонируя около 18 нуклеотидов для спаривания с рибонуклеотидами, включающимися в растущую РНК. Пройденные РНК-полимеразой одноцепочечные участки ДНК вновь объединяются в двойную спираль.
На стадии терминации происходит окончание транскрипции. Сигналом к этому служит специфическая палиндромная последовательность, называемая теримнатором. У эукариот остановка транскрипции происходит после транскрибирования сигнала полиаденилирования и 10-35 нуклеотидов после неё. После этого с РНК-цепью связывается специальный белок, разрезающий транскрипт и освобождающий пре-мРНК от полимеразы и ДНК.
У эукариот мРНК сразу после её образования подвергается процессингу (созреванию). Эта стадия включает в себя кэпирование, удаление части 3’-последовательности и присоединение вместо неё поли(А) хвоста (100-200 нуклеотидов).
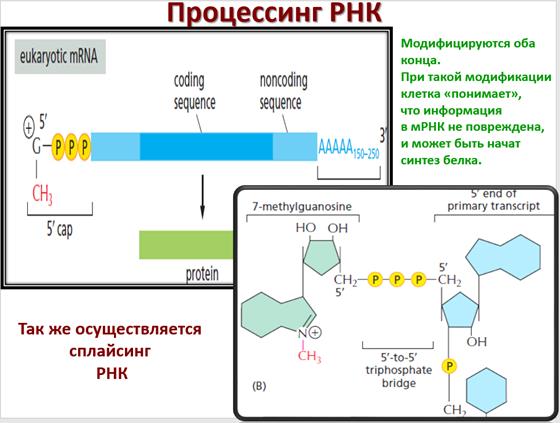 |
ПРОЦЕССИНГ РНК
В ходе процессинга осуществляется сплайсинг мРНК – процесс, сопровождающийся удалением интронов и сшиванием экзонов с образованием зрелой мРНК.
В сплайсинге участвуют малые ядерные рибонуклеопротеиновые частицы, состоящие из мяРНК и белковых молекул (см рисунок).
• Сплайсосома должна узнать 5’ и 3’ концы интрона, а так же точку ветвления образующегося лассо.
• Сайты сплайсинга хотя и имеют консенсусные последовательности, тем не менее весьма вариабельны.
• Последовательности сплайсинга узнаются специальными РНК, которые не только направляют, но и катализируют процесс вырезания интронов. Это U1, U2, U4, U5 и U6 snRNA (small nuclear RNA), которые вкупе с белками формируют соответствующие snRNP.
После образования первичного транскрипта мяРНК, входящие в состав малых ядерных рибонуклеопротеидов, распознают участки разрезания пре-РНК по сайтам сплайсинга, соединяются с ними по принципу комплементарности. Несколько мяРНП объединяются между собой и с другими белками в комплекс – сплайсосому. Посредством сплайсосом интроны вырезаются и удаляются из пре-РНК, а экзоны сшиваются.

Сплайсинг одной и той же последовательности в разных условиях может идти несколькими способами. Этот феномен называется альтернативным сплайсингом.
Биологическое значение альтернативного сплайсинга состоит в том, что он обеспечивает повышение разнообразия белков, синтезируемых на основе данного генома без изменения размеров этого генома.

Существует также транс-сплайсинг – явление, при котором объединяются два разных транскрипта. Так, например, идет образование матриц для генов цитохромов P450.
Были обнаружены химерные транскрипты с характерным первым экзоном цитохрома CYP3A43, которые присоединяются по каноническим сайтам сплайсинга к различным наборам экзонов CYP3A4. Все они синтезируются путем транс-сплайсинга.
Химерные транскрипты существуют в 3 различных комбинациях:
1. экзон 1 CYP3A43 соединен с экзонами 2-13 CYP3A4;
2. экзон 1 CYP3A43 соединен с экзонами 4-13 CYP3A4;
3. экзон 1 CYP3A43 соединен с экзонами 7-13 CYP3A4.
Наиболее длинная химерная изоформа (1) имеет 6-бета-гидроксилазную активность, а форма 2 не имеет таковой. Все химерные транскрипты синтезируются на очень низком уровне в печени (PubMed:11726664).
ОШИБКИ СПЛАЙСИНГА
• Мутация в критичном для сплайсинга сайте не обязательно предотвратит вырезание данного интрона.
• Мутации зачастую создают новый сайт для сплайсинга.
• Иногда происходит проскакивание экзона. Если и в соседнем сайте есть мутация, то происходит проскакивание и следующего экзона.
• С другой стороны, мутации, которые изменяют сплайсинг, могут быть критичными для организма.
• Аберрантный сплайсинг является причиной таких заболеваний, как β -талассемия, кистозный фиброз, лобно-височная деменция, болезнь Паркинсона, пигментозный ретинит, спинальная мышечная атрофия (синдром Верднига-Гоффманна), миотоническая дистрофия, преждевременное старение и рак.
 |
Последняя стадия процессинга – полиаденилирование 3’-конца
 |
3. 
Трансляция .
Трансляция – это процесс перевода последовательности нуклеотидов в молекуле мРНК в последовательность аминокислот в молекуле белка. То есть это процесс синтеза белка на матрице мРНК.

Ключом в этом процессе служит генетический код – принцип записи аминокислотной последовательности в виде нуклеотидной последовательности в мРНК. Генетический код триплетен и вырожден. Это означает, что для кодирования одной аминокислоты используется три нуклеотида, которые называются кодоном. Тремя нуклеотидами можно закодировать 64 комбинации, то есть намного более чем 20 аминокислот, по-этому некоторые аминокислоты кодируются не одним, а несколькими кодонами – вырожденность кода.
Основными свойствами генетического кода являются:
Триплетность – каждой аминокислоте в молекуле полипептида соответствует триплет – три расположенных рядом дезоксирибонуклеотида в молекуле ДНК.
Вырожденность – многим аминокислотам соответсвует более одного триплета.
Универсальность – генетический код универсален для всех живых организмов.
Неперекрываемость – каждый dNTP входит в состав только одного триплета.
Специфичность – каждый триплет кодирует только одну аминокислоту.
Главную роль в процессе белкового синтеза играют рибосомы.
Каждая рибосома имеет две бороздки, в одной из которых находится растущая цепь полипептида, а в другой располагается мРНК. Кроме того, в структуре рибосомы выделяют два участка, связывающие молекулы тРНК. В аминоацильном участке (А-сайт) размещается тРНК, несущая аминокислоту для присоединения её к растущей полипептидной цепи. В пептидильном участке ( P -сайт) располагается тРНК, соединенная с растущей полипептидной цепью.

Процесс трансляции состоит из 4 стадий: активации, инициации, элонгации и терминации.
На стадии активации тРНК под действием фермента аминоацил-тРНК-синтетазы (в некоторых учебниках этот фермент называется аминоацил-тРНК-лигазой) специфически связываются со «своими» аминокислотами (см рисунок). Этот процесс протекает в две стадии – 1) активация аминокислоты при помощи связывания с АТФ, 2) связывание аминоациладенилата с 3’-OH группой 3’-концевого аденозина в молекуле тРНК. Высокая специфичность реакции достигается благодаря способности 20 различных ферментов аминоацил-тРНК-синтетаз узнавать «свои» аминокислоты и ковалентно присоединять их к соответствующим тРНК. Реакция протекает в присутствии ионов Mg2+ с затратой энергии.
Каждая аминоацил-тРНК связывается с соответствующими кодонами мРНК. Из-за вырожденности генетического кода в клетках прокариот насчитывается 45 разных видов тРНК (а не 61, как можно было бы ожидать), и некоторые из них способны связываться с несколькими кодонами. Это возможно благодаря тому, что согласно «гипотезе качания» третье основание в антикодонах тРНК имеет некоторую степень свободы и как бы «качается» (см рисунок с тРНК).

Инициация трансляции. Инициация трансляции представляет собой событие, в ходе которого происходит образование комплекса, включающего Мет-тРНКiМет, мРНК и рибосому, где тРНКiМет - инициирующая метиониновая тРНК. В этом процессе участвуют не менее 10 факторов инициации, которые обозначают как eIF (от англ. eukaryotic initiation factors) с указанием номера и буквы. Первоначально 40S субъединица рибосомы соединяется с фактором инициации, который препятствует ее связыванию с 60S субъединицей, но стимулирует объединение с тройным комплексом, включающим Мет-тРНКiМет, eIF-2 и ГТФ. Затем этот теперь уже более сложный комплекс связывается с 5'-концом мРНК при участии нескольких eIF. Один из факторов инициации (eIF-4F) узнаёт и присоединяется к участку "кэп" на молекуле мРНК, поэтому он получил название кэпсвязывающего белка. Прикрепившись к мРНК, 40S субъединица начинает скользить по некодирующей части мРНК до тех пор, пока не достигнет инициирующего кодона AUG кодирующей нуклеотидной последовательности. Скольжение 40S субъединицы по мРНК сопровождается гидролизом АТФ, энергия которого затрачивается на преодоление участков спирализации в нетранслируемой части мРНК. В эукариотических клетках некодирующие участки мРНК имеют разную длину, но обычно от 40 до 80 нуклеотидов, хотя встречаются области с протяжённостью более 700 нуклеотидов.
Достигнув начала кодирующей последовательности мРНК, 40S субъединица останавливается и связывается с другими факторами инициации, ускоряющими присоединение 60S субъединицы и образование 80S рибосомы за счёт гидролиза ГТФ до ГДФ и неорганического фосфата. При этом формируются А- и Р-центры рибосомы, причём в Р-центре оказывается AUG-кодон мРНК с присоединённым к нему Мет-тРНКiМет.
В клетках есть 2 различающиеся по структуре тРНК, узнающие кодон AUG. Инициирующий кодон узнаёт тРНКiМет, а триплеты мРНК, кодирующие включение метионина во внутренние участки белка, прочитываются другой тРНКМет
Элонгация. По завершении инициации рибосома располагается на мРНК таким образом, что в Р-центре находится инициирующий кодон AUG с присоединённой к нему Мет-тРНКiМет, а в А-центре - триплет, кодирующий включение первой аминокислоты синтезируемого белка. Далее начинается самый продолжительный этап белкового синтеза - элонгация, в ходе которого рибосома с помощью аа-тРНК последовательно «читает» мРНК в виде триплетов нуклеотидов, следующих за инициирующим кодоном в направлении от 5' к 3'-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот.
Включение каждой аминокислоты в белок происходит в 3 стадии, в ходе которых:
- аа-тРНК каждой входящей в белок аминокислоты связывается с А-центром рибосомы;
- пептид от пептидил-тРНК, находящейся в Р-центре, присоединяется к α-NH2-гpyппe аминоацильного остатка аа-тРНК А-центра с образованием новой пептидной связи;
- удлинённая на один аминокислотный остаток пептидил-тРНК перемещается из А-центра в Р-центр в результате транслокации рибосомы. Освободившаяся от аминокислоты предыдущая тРНК покидает рибосому.



Связывание аминоацил-тРНК в А-центре. Кодон мРНК, располагающийся в А-центре рядом с инициирующим кодоном, определяет природу аа1тРНКaa1, которая будет включена в А-центр. аа1тРНКaa1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1, аа1тРНКaa1 и ГТФ. Комплекс эффективно взаимодействует с рибосомой лишь в том случае, если антикодон аа-тРНКaa1 комплементарен и антипараллелен кодону мРНК в А-центре. Включение аа-тРНКaa1 в рибосому происходит за счёт энергии гидролиза ГТФ до ГДФ и неорганического фосфата.
Образование пептидной связи происходит сразу же после отщепления комплекса EF-1 и ГДФ от рибосомы. Эта стадия процесса получила название реакции транспептидации.
В ходе этой реакции остаток метионина Мет-тРНКIМет связывается с α-аминогругшой первой аминокислоты, присоединённой к тРНКaa1 и расположенной в А-центре - образуется первая пептидная связь.
Транслокация - третья стадия элонгации. К рибосоме присоединяется фактор элонгации EF-2 и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу. В результате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, из А-центра перемещается в Р-центр. Свободная от метионина тРНКiМет покидает рибосому, а в область А-центра попадает следующий кодон.
По завершении третьей стадии элонгации рибосома в Р-центре имеет дипептидил-тРНК, а в А-центр попадает триплет, кодирующий включение в полипептидную цепь второй аминокислоты. Начинается следующий цикл стадии элонгации, в ходе которого на рибосоме снова проходят вышеописанные события. Повторение таких циклов по числу смысловых кодонов мРНК завершает весь этап элонгации.
Терминация. Терминация трансляции наступает в том случае, когда в А-центр рибосомы попадает один из стоп-кодонов: UAG, UAA или UGA. Для стоп-кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых высвобождающих фактора RF (releasing factor) или фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы на субъединицы.

Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК в рибосому для синтеза белка строго детерминирована мРНК, т.е. порядок расположения кодонов вдоль цепи мРНК однозначно задаёт структуру синтезируемого белка. Рибосома сканирует цепь мРНК в виде триплетов и последовательно отбирает из окружающей среды «нужные» аа-тРНК, освобождая в ходе элонгации деацилированные тРНК.
Малая и большая субъединицы рибосомы в процессе трансляции выполняют разные функции: малая субъединица присоединяет мРНК и декодирует информацию с помощью тРНК и механизма транслокации, а большая субъединица ответственна за образование пептидных связей.
Ускорение синтеза определенного белка обычно достигается путем присоединения к мРНК нескольких рибосом. Такие структуры называют полисомами. Чем длиннее цепочка синтезируемого белка – тем больше рибосом могут осуществлять его биосинтез. Благодаря этому уравниваются скорости синтеза полипептидных цепей, имеющих разные размеры.
У про- и эукариот процесс трансляции сходен, но имеются и отличия.
В прокариотических клетках процессы транскрипции и трансляции сопряжены во времени и пространстве – то есть процесс трансляции может начаться сразу же после появления транскрипта еще в ходе его синтеза. Это связано с отсутствием у прокариот ядра и быстрой деградацией мРНК под действием рестриктаз.
На стадии инициации у прокариот большую роль в образовании инициарущего трансляцию комплекса играет полипуриновая последовательность Шайна-Дальгарно, расположенная в 5’-нетранслируемой области мРНК. Именно с ней связывается рРНК малой субъединицы рибосомы, что позволяет прокариотической рибосоме распознавать AUG-кодон. У эукариот инициация трансляции осуществляется в большинстве случаев по сканирующему, кэп-зависимому механизму (см. описание выше). Однако наличие только инициирующего кодона недостаточно для инициации трансляции. Для этого необходимо, чтобы перед инициирующим кодоном, на расстоянии двух нуклеотидов от него, обязательно находился пуриновый нуклеотид, а сразу за инициирующим кодоном следовал гуаниловый нуклеотид.
Посттрансляционная модификация белков.
Синтезированные полипептиды не имеют окончательной третичной структуры. Они подвергаются различным посттрансляционным модификациям: фолдингу (укладка белка в третичноую структуру), гликозилированию, фосфорилированию, фарнезилированию, ферментативному расщеплению и пр. Кроме того, ряд синтезированных белков нуждается в доставке их к месту назначения: митохондриям, пероксисомам, плазматической мембране и тд.
Дата добавления: 2021-03-18; просмотров: 170; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
