КВАНТОВАЯ ТЕРАПИЯ В КЛИНИЧЕСКОЙ ОНКОЛОГИИ
Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики
Применение низкоинтенсивного лазерного излучения в лечении онкологических заболеваний
Реферат по Лазерам в медицине
Выполнила:
Студентка группы 4221
Семяшкина Ю.В.
Преподаватель:
Беликов А.В.
Санкт-Петербург
2014
Содержание
1. Введение
2. Онкология
3. НИЛИ
4. Заключение
Введение
Актуальность проблемы рака не вызывает сомнений, так как в наши дни рак является одной из самых распространенных причин заболеваемости и смертности. По данным ВОЗ ежегодно во всем мире регистрируется более 10 миллионов новых случаев заболевания раком и более 6 миллионов случаев смерти. Рак является причиной примерно 20% всех случаев смерти в промышленно развитых странах и 10% в развивающихся странах. За последние 100 лет по уровню заболеваемости и смертности онкология переместилась с десятого места на второе.
К сожалению, количество больных различными видами рака в мире огромно, и продолжает расти. По прогнозам ВОЗ, к 2020 году онкопатология выйдет на первое место, а в ближайшие 15-20 лет количество заболевших раком возрастет до 20 млн., и число смертей — до 12 млн. Каждый 6-ой житель Земли в какой-либо период своей жизни заболевает раком, причем 40 процентов заболевших умирают на первом году после установления диагноза. Врачи всего мира пытаются найти методы борьбы с данным заболеванием, разработать инновационные вакцины и лекарства. Но статистика такова, что, к большому огорчению, чаще всего диагноз рак, является смертным приговором для заболевшего человека. Сегодня излечимость онкологических заболеваний составляет всего 26% в мире.
|
|
|
Это обусловлено в первую очередь тем, что методы лечения онкологических заболеваний зачастую устаревши, и действуют в интересах фармакологической индустрии. Это видно из данных статистики в нижеприведенной таблице.
Выживаемость онкологических больных при традиционных методах лечения
| Вид рака | Стадия | Выживаемость | Описание | ||
| Рак кожи | I стадия | 100% | Обусловлено ранней диагностикой | ||
| II стадия (T2N0M0) | 86% | При условии, что лимфоузлы не поражены, отдаленных метастаз нет | |||
| III стадия | 62% | Доживают до 5 лет | |||
| IV стадия | 12% | Доживают до 5 лет | |||
| Меланома
| I стадия | 97% | Требуется обследование у эндокринолога при наличии подозрительных родинок, родимых пятен и других кожных образований | ||
| II стадия | 65% | Доживают до 5 лет | |||
| III стадия | 37% | Доживают до 5 лет | |||
| IV стадия | 15% | Доживают до 1 года | |||
| Рак нижней губы
| I стадия | 70% | Доживают до 5 лет | ||
| II стадия | 59% | Доживают до 5 лет | |||
| III стадия | 35% | Доживают до 5 лет | |||
| IV стадия | 21% | Доживают до 1 года | |||
| Рак слизистой оболочки полости рта
| I стадия | 94% | Прогноз рака слизистой оболочки полости рта зависит от стадии, формы роста, возраста пациента. Рак слизистой оболочки задней половины полости рта протекает более прогрессивно, чем передней. | ||
| II стадия | 60% | Доживают до 5 лет | |||
| III стадия | 24% | Доживают до 5 лет | |||
| IV стадия | 16% | Доживают до 1 года | |||
| Рак щитовидной железы
| I стадия | 93% | При недифференцированном раке щитовидной железы, большинство больных погибает в течение двух лет после лечения. | ||
| II а-b стадия | 62% | Доживают до 5 лет | |||
| III а-b стадия | 18% | Доживают до 5 лет | |||
| IV стадия | 12% | Доживают до 1 года | |||
| Рак молочной железы
| 0 стадия | 98% | В целях профилактики необходимо ежегодно проходить консультацию у маммолога | ||
| I стадия | 96% | Доживают до 5 лет | |||
| II стадия | 90% | Доживают до 5 лет | |||
| II b стадия | 80% | Доживают до 5 лет | |||
| III а стадия | 87% | Доживают до 5 лет | |||
| III b стадия | 67% | Доживают до 5 лет | |||
| IV стадия | 21% | Доживают до 1 года | |||
| Рак лёгкого
| I А-В стадия | 60-80% | До 90 % больных гибнет в первые два года жизни, с момента установления диагноза. При только хирургическом лечении до пяти лет доживают 30 % больных. При полном комплексе радикального лечения выживаемость выше. | ||
| II А-В стадия | 45% | Доживают до 5 лет | |||
| III А-В стадия | 20% | Доживают до 5 лет | |||
| IV стадия | 4% | Доживают до 1 года | |||
| Рак пищевода
| I стадия | 57% | Главным фактором является охват опухолевого процесса. | ||
| II А-В стадия | 43% | Доживают до 5 лет | |||
| III стадия | 25% | Доживают до 5 лет | |||
| IV стадии | 12% | Доживают до 1 года | |||
| Рак желудка | 0 - I А-В стадия | 90% | Главным фактором выживаемости при раке желудка является возможность проведения хирургического вмешательства. Отдельные результаты хирургического лечения зависят от стадии заболевания, структуры опухоли и своевременно начатого лечения. Однако более 50% пациентов поступают на лечение в запущенном состоянии, когда радикальная операция возможна лишь у 30-40 % всех больных. В целом при экспансивном раке желудка, после комплексно-комбинированного, без операционного лечения 35% живут до 5 лет. | ||
| II стадия | 45% | Доживают до 5 лет | |||
| III А-В стадия | 25% | Доживают до 5 лет | |||
| IV стадия | 5% | Доживают до 1 года | |||
| Рак ободочной кишки
| 0 - I стадия | 90-100% | Определяющим фактором является раннее обнаружение опухоли. При опухолях, ограниченных слизистой оболочкой, после радикального лечения до пяти лет живут почти все больные. | ||
| II стадия | 70% | Доживают до 5 лет | |||
| III стадия | 30% | Доживают до 5 лет | |||
| IV стадия | 16% | Доживают до 1 года | |||
| Рак прямой кишки
| 0 - I стадия | 80 % | Главным фактором успешного лечения является ранняя диагностика. | ||
| II стадия | 75% | Доживают до 5 лет | |||
| III А-В стадия | 40-50% | Доживают до 5 лет | |||
| IV стадия | 12% | Доживают до 1 года | |||
| Рак печени
| I стадия | 20% | Прогноз при раке печени неблагоприятный. После хирургического лечения первичного рака печени до пяти лет живут 20 % больных. Более 90 % среди всех злокачественных новообразований печени, составляют вторичные или метастатические злокачественные опухоли. По локализации метастатического рака, печень занимает первое место среди всех органов. | ||
| II стадия | 14% | Доживают до 5 лет | |||
| III стадия | 12% | Доживают до 5 лет | |||
| IV стадия | 2% | Доживают до 1 года | |||
| Рак поджелудочной железы
| I стадия | 25% | Лечение рака поджелудочной железы - один из наиболее сложных разделов онкологии. Прогноз выживаемости очень неблагоприятный. Как правило, диагноз устанавливается после появления признаков в запущенном состоянии. После радикального хирургического лечения до пяти лет живут примерно 25 % больных. | ||
| II стадия | 16% | Доживают до 5 лет | |||
| III стадия | 14% | Доживают до 1 года | |||
| IV стадия | 3% | Доживают до 1 года | |||
| Опухоли костей
| I А-В стадия | 50 - 75 % | Среди злокачественных образований человека, удельный вес опухолей костей незначителен. Метастатические злокачественные опухоли костей скелета встречаются значительно чаще. Наиболее часто это наблюдается при раке молочной железы, раке щитовидной железы, раке предстательной железы, саркоме Юнга, раке почки, раке лёгкого, раке шейки и тела матки. | ||
| II А-В стадия | 40 - 50 % | Доживают до 5 лет | |||
| III стадия | - | Не определяется в силу быстрого перехода процесса в IV стадию. | |||
| IV А-В стадия | 10-12% | Доживают до 1 года | |||
| Опухоли мягких тканей
| I А-В стадии | 40 % - 70 % | Прогноз при злокачественных опухолях мягких тканей зависит от типа опухоли и следующих факторов: стадии заболевания, чувствительности опухоли к лечению, радикальности проведенной операции и других факторов. | ||
| II А-В стадии | 30 % - 60 % | Доживают до 5 лет | |||
| III А-В стадия | 15 % - 20 % | Доживают до 1 года | |||
| IV А-В стадия | 6 % - 8 %. | Доживают до 1 года | |||
| Лимфогранулематоз
| I- II стадия | 90% | Заболевание лучше всего поддающееся современным методам лечения. Пятилетняя общая безрецидивная выживаемость больных с локальными формами лимфогранулематоза составляет при комплексной терапии около 90 %. | ||
| III А-В стадия | 60-80% | Доживают до 5 лет | |||
| IV стадия | 45% | Доживают до 5 лет | |||
| Острые лейкозы | -- | 55% | Представляют гетерогенную группу опухолевых заболеваний системы крови - гемобластозов , которые характеризуются первичным поражением костного мозга морфологически незрелыми кроветворными (бластными) клетками, с вытеснением ими нормальных элементов и инфильтрацией ими различных органов. Острый лейкоз довольно редкое заболевание и составляет лишь 3 % злокачественных опухолей человека. | ||
| -- | 27% | Доживают до 5 лет |
Анализируя данные исследования, ученые в этой статье задаются вопросом о смысле принципиального применения химиотерапии в таком виде, в каком она применяется в настоящее время.
Рак нужно лечить комплексно - девиз современной медицины.
Общая тенденция современной традиционной медицины - лечить болезнь, а не больного, приводит к печальным последствиям. Именно при раке это особенно показывает свою несостоятельность. Если при других болезнях ,например инфекционных, удается вмешаться в ход болезни, убить возбудителя и добиться выздоровления, то при раке попытки, направленные только на уничтожение раковых клеток не приводят к выздоровлению.
Традиционная медицина научилась разрушать раковую клетку, но к выздоровлению онкологического больного это не привело. Приходит понимание, что лечение рака должно быть направлено не только на лечение симптомов этой болезни, но на регулирование процессов, которые к этому заболеванию привели. По некоторым данным, комплексное лечение создает возможность увеличить эффективность других методов в целом на 12-15%.
Сложившиеся тревожная ситуация ставит перед врачами и учеными трудную задачу повысить эффективность лечения рака.
Онкология
Онкология – это отрасль медицины, которая занимается изучением причин и механизмов развития злокачественных и доброкачественных опухолей, их проявлений, методов выявления и профилактики, способов лечения.
Онкология – это молодая наука, начавшая свое развитие в 19 веке.
В начале 20 века начинается усиленное изучение причин опухолевого роста. В это же время начинают создавать институты и научные центры по изучению этого вопроса. В середине 20 века отдельно изучался вопрос опухолей у детей с их спецификой развития, течения и лечения таких болезней.
В основе развития любой опухоли лежит повреждение структуры ДНК и как следствие — появление атипичных клеток. Это происходит при воздействии на организм канцерогенов – всех тех факторов, которые могут вызвать повреждение ДНК.
Любая старая, поврежденная или атипичная клетка имеет биологические отличия от нормальной клетки. Благодаря этим отличиям здоровая иммунная система обнаруживает её, распознаёт как чужеродную и уничтожает. Если есть нарушения в иммунной системе, она не может распознать такую изменённую клетку и соответственно уничтожить её. Часть атипичных клеток выживает также в случае, если количество и скорость их образования превышает возможности даже здоровой иммунной системы.
Ещё одна причина выживания повреждённых клеток — нарушения в системе репарации, когда такая клетка не может быть восстановлена. Таким образом, часть атипичных клеток остаются живыми и начинают интенсивно делиться. После двух-трёх делений такой атипичной клетки в ней закрепляются дефектные наследственные признаки. А после четвертого деления клетка превращается в злокачественную.
Опухолевый рост может вызвать множество факторов по отдельности или действующих одновременно. Все воздействия физической, химической и биологической природы, которые повышают вероятность возникновения злокачественных новообразований, называются канцерогенами.
Доказанным является тот факт, что опухоли никогда не развиваются на здоровых тканях и хорошо снабжающихся кислородом. В 1931 году немецкий биохимик Отто Варбург получил Нобелевскую премию за исследования в области рака, в которых доказал, что раковая клетка образуется в результате недостатка кислорода в тканях и замены нормального кислородного дыхания клеток на безкислородное с закислением среды.
Однако для развития опухоли помимо воздействия канцерогена важным моментом является нарушении механизмов противоопухолевой защиты организма,
нарушение в системе иммунитета, генетическая предрасположенность.
Когда мы говорим о генетической предрасположенности, имеется в виду не передача опухоли по наследству, а особенности метаболизма, функционирования иммунной и других систем, предрасполагающие к развитию опухоли.
Таким образом, опухоль образуется при одновременном воздействии канцерогена и нарушениях в системе противоопухолевой защиты организма.
В настоящее время онкология получила огромный скачок в развитии методов диагностики и лечения, что позволило продлить жизнь неизлечимым больным от нескольких лет до десятков лет.
Развитие злокачественной опухоли традиционно разделяют на четыре последовательные стадии. При первой (или нулевой) стадии количество раковых клеток в ткани еще невелико и они не выходят за пределы базальной мембраны эпителия, на котором располагаются. В этом случае достаточно лишь локального иссечения пораженного участка с частичным захватом здоровой ткани для предотвращения рецидива(повторной пухоли) и метастазирования. Примером может служить нулевая стадия рака шейки матки, кожных покровов или слизистых оболочек полости рта.
При второй стадии раковые клетки уже проникают из эпителия через базальные мембраны в подлежащую соединительную ткань, хотя и не распространяются в лимфатические узлы (те же случаи, а также рак молочной, щитовидной и предстательной желез, бронха, желудка, различных отделов головного мозга и некоторые другие). В этих ситуациях помимо опухолеи удаляют уже и значительный объем окружающих здоровых тканей, чтобы застраховать больного от рецидива в результате попадания единичных оставшихся в ране раковых клеток за пределы зоны вмешательства.
При третьей стадии раковые клетки уже проникают в местные лимфатические узлы, что заставляет делать массивные иссечения значительной или большей части органа, а иногда и удалять его целиком (экстирпация или полное удаление желудка, почки молочной и других желез, верхней или нижней челюсти, крупного отдела кишечника, легкого и т.п.).
При четвертой тадии, когда раковые клетки распространены уже по многим лимфатическим узлам или даже органам (метастазы рака толстой кишки в печень, метастазы меланомы в легкие, костный и головной мозг), больной считается обреченным и лечение направлено на уменьшение страданий и продление жизни. В отдельных случаях (рак толстой кишки с мтастазами в печень) больного еще можно спасти, удаляя как первичную опухоль, так и метастазы (если они немногочисленны и удалены от крупных кровеносных сосудов). В других ситуациях хирург прибегает к такому вмешательству, как ионизирующее излучение и (или) химиотерапевтические средства.
Если излечение невозможно, идут на облегчение страданий больных, например, путем реканализации просветов кишечника, бронхов или трахеи, сдавливаемых опухолевыми массами. Такой подход (паллиативное лечение), нередко применяемый в сочетании с химио- и радиотерапией, не только умньшает мучения больных, но и можт продлить их жизнь.
НИЛИ
Низкоинтенсивное лазерное излучение оказывает противовоспалительное, иммунокорригирующее, обезболивающее действие, способствует заживлению ран, восстановлению равновесия между компонентами нервной системы. Источником многообразия этих эффектов являются механизмы ответа организма на лазерное излучение.
При воздействии лазера на ткани возникают фотофизические и фотохимические реакции, связанные с поглощением световой энергии тканями и нарушением слабых молекулярных связей, а также происходят восприятие и перенос эффекта лазерного излучения жидкими средами организма. Наличие в биологических тканях специфических фотоакцепторов, в частности гемоглобина, порфиринов, циклических нуклеотидов, железо- и медьсодержащих ферментов (каталаза, супероксиддисмутаза), ферментов окислительно-восстановительного цикла (цитохромы, пигменты и другие вещества), усиливает восприимчивость биологических тканей к лазерному излучению.
После взаимодействия лазерного излучения и чувствительной молекулы в клетке активизируется обмен веществ и энергии, что дает ей возможность полноценно выполнять свои функции, а на определенном этапе развития делиться с образованием здорового потомства. Важность этих процессов переоценить невозможно, так как клетки являются строительным материалом организма и его основными фукциональными единицами.
Биологическое (терапевтическое) действие низкоинтенсивного лазерного излучения (когерентного, монохроматического и поляризованного света) может быть условно подразделено на три основные категории:
- первичные эффекты: изменение энергетики электронных уровней молекул живого вещества, стереохимическая перестройка молекул, локальные термодинамические нарушения, возникновение волн повышенной концентрации ионов кальция в цитозоле;
- вторичные эффекты: распространение волн повышенной концентрации ионов кальция между клеток, фотореактивация, стимуляция или угнетение биопроцессов на клеточном уровне, изменение функционального состояния как отдельных систем биологической клетки, так и организма в целом;
- эффекты последействия: цитопатический эффект, образование токсических продуктов тканевого обмена, отклик систем иммунного, нейро-гуморального и эндокринного регулирования и т. д.
Ярким примером влияния низкоинтенсивного лазерного излучения на патологический процесс является его противовоспалительный эффект. Воспаление - универсальный механизм повреждения тканей, проявляющийся отеком, покраснением,местным повышением температуры, болью, нарушением функции страдающего органа.
Воздействие НИЛИ приводит к расширению мелких кровеносных и лимфатических сосудов, что устраняет отек. В результате уменьшается сдавление нервных окончаний и, таким образом, создаются предпосылки для уменьшения или полного исчезновения болевого синдрома. Кроме того, запускаются процессы "починки" поврежденных клеточных структур, поэтому поврежденная ткань может раньше вернуться к выполнению своих функций.
Последнее обстоятельство объясняет положительное влияние НИЛИ на заживление язвенных дефектов, травматических и ожоговых повреждений кожи и слизистых оболочек. В настоящее время описанные эффекты широко используются в медицинской практике в лечении трофических язв, язвенной болезни желудка и двенадцатиперстной кишки, ожогов, гнойных ран.
Немаловажным является тот факт, что НИЛИ препятствует размножению микроорганизмов в ране. Это позволяет сократить сроки антибактериального лечения, является одной из предпосылок скорейшего выздоровления.
НИЛИ в онкологии
Экспериментальные исследования
Нередко в литературе, посвященной низкоинтенсивной лазерной терапии различных заболеваний, в списке противопоказаний на первом месте стоит онкология. Такой подход к онкологическим заболеваниям обусловлен тем, что до сих пор остается неясным действие низкоинтенсивное лазерное излучение (НИЛИ) на злокачественные новообразования. Изучением данного вопроса ученые занимаются с конца 70-х годов.
Некоторые ученые (Эндельбер О.П. с соавт.,1994; Чернова Г.В. с соавт., 1994), исследовавшие эффективность этого воздействия, пришли к выводу, что излучение низкоинтенсивных лазеров не влияет на частоту спонтанно вызванного мутагенеза, а противопоказания к проведению лазерной терапии при наличии у больного предопухолевого процесса являются необоснованными. Было также установлено, что НИЛИ не только не оказывает видимого повреждающего действия на клетки крови и не изменяет их жизнеспособность, но предотвращает или даже уменьшает их повреждение цитостатиками (Алиханов Б.А.,Токмачев Ю.К., 1993).
Отечественные ученые (Ильина А.И., 1980; Плетнев С.Д., 1980; Москалик К.Г. с соавт., 1980) в экспериментальных исследованиях выявили, что воздействие лазерного излучения на такие злокачественные опухоли, как: меланома Гардинг-Насси, аденокарцинома 765, саркома 37 и карцинома Эрлиха, стимулировало их рост. В эксперименте использовался гелий-неоновый лазер (633 нм) и импульсный азотный лазер (340 нм). Зафиксирована даже стимуляция роста при облучении гелий-неоновым лазером доброкачественных опухолей молочных желез у экспериментальных крыс (Панина Н.И., Брилль Г.Е., 1992). Серьезные исследования в этой области проводились в Томском ОНЦ. Воздействие НИЛИ мощностью 0,1 Вт/см2 в дозе 3 Дж/см2 оказывалось на лимфосаркому Плисса, меланому В-16, асцитную карциному Эрлиха и аденокарциному легких Льюиса. Излучение осуществлялось лазером на парах меди (длина волны 510 и 578 нм) и гелий-неоновым (He-Ne) лазером.
Значительная стимуляция роста опухоли и частоты метастазирования обнаружена в группе животных, получавших облучение гелий-неоновым лазером. В первой группе (лазер на парах меди) стимуляции или торможения роста опухоли не зафиксировано, но отмечено снижение частоты метастазирования и числа метастазов (Зырянов Б.Н. с соавт., 1998). Торможение живых клеток карциномы Льюиса было получено исследователями (Захаров С.Д. с соавт.,1990) при ее облучении гелий неоновым лазером с плотностью потока излучения 40 мВт/см2. Эффект был достигнут при проведении продолжительного курса НИЛИ.
Угнетение метастазирования, а в ряде случаев и полное подавление опухолевого роста при воздействии НИЛИ, описано Димант И.Н. с соавт. (1991). Ими показано, что излучение гелий-неонового лазера с длиной волны 632 нм приводит к некрозу опухоли и разрастанию соединительной ткани с развитием выраженных дистрофических процессов в клеточных элементах опухоли. Одновременно с этим отмечены изменения ферментативной активности в опухоли и окружающих нормальных тканях, нарастание активности щелочной фосфатазы, сукцинатдегидрогеназы и кислой фосфатазы в нейтрофилах крови и снижение их активности в новообразовании. Этими же исследователями зафиксировано двукратное удлинение срока жизни животных, оперированных по поводу саркомы мягких тканей с воздействием НИЛИ на нерадикально удаленную опухоль. Отмечено угнетение опухолевого процесса, уменьшение объема опухоли за счет дистрофических и склеротических процессов.
При проведении экспериментальных исследований на крысах с перевиваемой саркомой Уокера и на мышах с раком молочной железы путем воздействия на новообразования полупроводниковым арсенид-галлиевым лазером с длиной волны 890 нм отмечено, что при суммарной дозе 0,46 Дж рост опухоли сокращался на 37,5%, а продолжительность жизни увеличилась в 1,2 раза. При суммарной дозе 1,5 Дж размеры опухоли не отличались от контрольной группы. Также не было различий в продолжительности жизни.
При облучении культивированных клеток злокачественных опухолей человека (меланома, опухоли молочной железы и толстой кишки) лазерным излучением (480 и 640 нм) обнаружены как стимуляция роста клеток в отдельных экспериментах, так и торможение в других (Dasdia T. et.al., 1988). Аналогичные результаты получены при облучении колоний различных злокачественных клеток излучением аргонового лазера или лазера на красителях с накачкой генерации аргоновым лазером с плотностью потока мощности 5,0…8,5 мВт/см2 (Fu-Shou Yang et.al.,1986).
Многолетние исследования по влиянию НИЛИ на злокачественные опухоли, проведенные в Российском онкологическом научном центре РАМН А.В. Ивановым с соавт. (1993, 1999), доказали прямое ингибирующее действие ЛИ на клетки опухоли. Они облучали асцитный вариант эмбриокарциномы в центрифужных пробирках и чашках Петри (лазер с длиной волны 1264 нм, мощностью 8,5 мВт, экспозиция 20 мин.). Облученный лазером материал вводили животным внутримышечно и внутрибрюшинно. При первом способе введения выявлено торможение роста опухоли на 80% от ее средней массы. При внутрибрюшной перевивке получены статистически достоверные данные по увеличению продолжительности жизни животных. Авторы делают вывод, что лазерное излучение с длиной волны 1264 нм оказывает прямое ингибирующее действие на рост опухолей. Наиболее эффективное торможение роста опухолей имеет место при многократном курсовом облучении и проявляется в ближайшее время после воздействия НИЛИ. При действии на суспензию опухолевых клеток (асцитный перевивочный материал) наблюдается их дозозависимая гибель. Воздействие на опухоли разных локализаций различается по эффективности, что предполагает разработку индивидуальных режимов воздействия для каждой нозологической формы.
Излучение гелий-неонового лазера с мощностью непрерывного излучения 5-8 мВт удлиняет латентный период развития карциномы Льюиса и меланомы В-16, тормозит рост опухоли и снижает активность метастазирования. В структуре облученных опухолей определялись очаги полной гибели клеток, метастазы имели меньшие размеры, на 25 % увеличивалась колониеобразующая способность клеток костного мозга, продолжительность жизни облученных животных увеличивалась на 5-13 суток (Гамалея И.Ф. с соавт., 1988).
Выраженные изменения в структуре первичной опухоли, вплоть до гибели клеточных элементов опухоли, зафиксированы при лазерном облучении крови. Метастазы у этих животных были значительно меньше сравнительно с контрольной группой (Гамалея Н.Ф. (1988).
Интересные результаты были получены исследователями, изучавшими сочетанное воздействие НИЛИ и лучевой терапии на злокачественные новообразования.
В проводимом эксперименте, лазерное облучение фибросаркомы (полупроводниковый лазер, 905 нм, частота повторения импульсов 265 Гц, мощность импульса 50 Вт, экспозиция 210 с.) не оказало влияния на рост опухоли, но потенцировало противоопухолевую активность рентгено- и радиотерапии (Larcovic N et al. ).
Экспериментальные исследования на мышах линии С57В1.6, с перевитой карциномой Льюиса под кожу бедра, проводили Южаков В.В. и соавт. (1994). Животные подвергались локальному гамма-облучению в дозе 30 грей и инфракрасному (ИК) лазерному облучению (10 кГц, 5,4 мВт/см2, экспозиция 10 мин). За 5 мин до гамма-терапии на опухоль воздействовали НИЛИ. Через 3 суток после сочетанного воздействия в сохранившихся участках паренхимы опухоли сосудистая сеть оставалась полнокровной. По данным математического прогнозирования для опухолей изоэффективных объемов, воздействие лазерным излучением до гамма-облучения приводит к фактическому увеличению митотической активности через 3 суток, почти на 30%. Между тем, темп роста и абсолютный прирост массы опухоли практически не меняются. Дополнительная репопуляция клеток возникает преимущественно в переходных и ранее потенциально гипоксических зонах и, фактически, замещает гибнущую часть опухолевых клеток. Повышение митотической активности опухолевых клеток авторы расценивают как благоприятный прогностический признак, свидетельствующий об усилении степени оксигенации опухолевой ткани, и, соответственно, о снижении доли наиболее резистентных к гипоксии клеток. Этот фактор может расцениваться как особенно важный для эффективного подавления роста опухолей с медленной пострадиационной реоксигенацией и их разрушения при фракционированном режиме лучевого воздействия.
В работе Мещериковой В.В с соавт. (РОНЦ РАМН) сравнивалась эффективность применения различных режимов лазерного воздействия при лечении лучевых реакций кожи стопы мышей. Стопу задней конечности мышей подвергали однократному рентгеновскому облучению, в дозе 36 грей или фракционированному облучению в дозе 45 грей. В день первого облучения, или спустя разные сроки после него, на зону облучения воздействовали квантовым излученикм (КИ) аппаратом полифакторной квантовой терапии РИКТА-01.
Воздействие проводили пять раз в неделю в течение двух недель, при этом варьировались частота и длительность лазерного воздействия, а также время начала лечения относительно момента рентгеновского облучения. Тяжесть лучевых реакций оценивали в относительных единицах в течение 30…50 суток после облучения. Воздействие импульсным инфракрасным лазером с длиной волны 0,89 мкм аппарата РИКТА-01 позволило существенно снизить тяжесть лучевых реакций. Например, после однократного облучения в дозе 36 грей, максимальная тяжесть реакции достигает 2,1 отн. ед., а длительность проявления 30 суток. В результате лечения максимальная тяжесть снижается до 0,6 отн. ед., а длительность проявления лучевых реакций составляет 20 суток
Примечание. Первые исследования проводились только аппаратами, оснащенными низкоинтенсивными лазерными излучателями, отсюда аббревиатура НИЛИ. Современные аппараты оснащены излучателями красного света, инфракрасного и инфракрасного лазерного света, а также источником постоянного магнитного поля (ПМП). Излучение таких аппаратов принято называть квантовым излучением (КИ).
Эффективность применения квантового воздействия повышается, если оно начинается до момента развития лучевых реакций. Лазерное воздействие уменьшает тяжесть лучевых реакций кожи мышей в пропорции, соответствующей двукратному снижению дозы рентгеновского облучения.
Эффект облучения был проверен на рост солидной карциномы Эрлиха. Опухоль прививали под кожу бедра, спустя 8 дней ее подвергали однократному рентгеновскому воздействию, в дозе 36 грей, а затем в течение двух недель проводили 10 сеансов лазерного воздействия. Стимуляции роста опухоли при этом не наблюдалось. Полученные данные подтверждают имеющиеся в литературе данные о благоприятном воздействии инфракрасного лазерного излучения при лучевых поражениях кожи.
Результаты экспериментальных исследований мы привели не случайно, а для того, чтобы стало ясно, почему нельзя воздействовать КИ непосредственно на новообразования (первичную опухоль и метастазы), поскольку последствия могут быть непредсказуемы.
КВАНТОВАЯ ТЕРАПИЯ В КЛИНИЧЕСКОЙ ОНКОЛОГИИ
Изучение эффективности квантового излучения в онкологии было начато в РОНЦ РАМН в начале 80-х гг. Была доказана высокая эффективность квантового излучения (КИ) при лечебной эндоскопии у больных предопухолевыми заболеваниями. Как известно, одним из настораживающих моментов в течение хронических воспалительных заболеваний является изменение структуры пораженной ткани, или дисплазия. КИ предотвращает прогрессирование и в большом проценте случаев способствует обратному развитию структурных изменений в тканях на фоне хронического воспаления, что с успехом применяется в лечении предраковых заболеваний женской половой сферы, желудочно-кишечного тракта и дыхательных путей.
Исследование КИ, проведенное в Онкологическом центре с целью изучения влияния лазерного излучения на показатели клеточного и гуморального иммунитета, показало его высокое потенцирующее действие на стимуляцию реактивности организма у онкологических больных (Трапезников Н.Н. с соавт. 1985).
Там же разработан метод адаптивной фотоиммунотерапии. Он заключается в лазерном облучении и последующей реинфузии выделенных из крови лимфоцитов. При раке молочной железы, в результате такого лечения, отмечено увеличение количества Т-лимфоцитов и естественных киллеров, снижение уровня Ts.
Изучение роли воздействия КИ в метаболической корреляции тканевой гипоксии у больных со злокачественными новообразованиями до операции и в раннем послеоперационном периоде выявило высокую эффективность этого метода, как по профилактике послеоперационных осложнений, так и по улучшению результатов лечения.
Интересны результаты исследования, полученные в ходе лечения генерализованной формы рака молочной железы путем воздействия КИ на циркулирующую лимфу. Воздействие КИ проводилось в течение 60 мин. ежедневно на протяжении 5 дней. Анализ лимфы на уровень содержания молекул средней массы, молочной кислоты, молонового диальдегида после воздействия КИ свидетельствовал о снижении этих показателей в 2-6 раз.
В лаборатории клеточного иммунитета проведено изучение влияния лазерного излучения на цитотоксическую активность мононуклеарных клеток (МНК) доноров. Доказана способность МНК высвобождать цитокины ИЛ-1 и ФНО.
В Онкологическом научном центре РАМН также проводилось изучение возможности коррекции тканевой гипоксии КИ как самостоятельно, так и в сочетании с комплексом биоантиоксидантов в пред- и в раннем послеоперационном периоде. Воздействие КИ осуществлялось на симметричные паравертебральные зоны грудного отдела позвоночника. Th I - Th IV при раке легкого и Th IV - Th V11 при раке пищевода и кардии. Облучение проводилось гелий- неоновым лазером с длиной волны 638,2 нм. Плотность мощности излучения 6-7 мВт/ см 2. Комплекс биоантиоксидантов состоял, из токоферола (600 мг в сутки), ретинола (100 000Ед) и аскорбиновой кислоты (2 г/сутки) дробно внутрь. Такая предоперационная терапия позволила добиться снижения интенсивности процессов перекисного окисления липидов, при этом уменьшалась внутриклеточная гипоксия, улучшалось функциональное состояние клеток, органов и систем у 90% больных раком легкого, 80% больных раком кардиального отдела желудка и у 70% больных раком пищевода. Изменилась структура осложнений в раннем послеоперационном периоде. Ни в одном случае не наблюдалось тромбоэмболии легочной артерии, снизилась частота гнойно-септических осложнений, пневмоний, трахеобронхитов, тромбофлетов. Послеоперационная летальность снизилась на 6% раке кардиального отдела желудка, на 12% при раке пищевода (Свиридова С.П. с совт.1991).
Исследования эффективности КИ в онкологии проводятся и в других крупных онкологических учреждениях страны. Положительные результаты КИ у онкологических больных получены при лечении послеоперационных осложнений у больных раком пищевода, раком желудка. Отмечены хорошие результаты при лечении гнойно-воспалительных осложнений у больных раком гортани, глотки и тканей полости рта.
В НИИ онкологии им. П.А. Герцена методики квантовой терапии применяются в пред- и послеоперационном периоде и интраоперационно при заболеваниях сердечно-сосудистой системы, при заболеваниях органов дыхания и пищеварительной системы, а также с целью обезболивания, профилактики и лечения различных осложнений комбинированной терапии. Исследователи считают принципиальным тот факт, что по результатам лечения свыше 1000 больных не отмечено ни одного случая обострения основного заболевания и каких-либо побочных реакций. (Кабисов Р.К. с соавт. 1996).
Коченов В.И. (1991) делится наблюдениями по использованию КИ в послеоперационном периоде более чем у 300 пациентов. Квантовая терапия (КТ) после операций по поводу рака голосовой связки при прямой опорной микроларингоскопии позволяла в 1,5-2 раза ускорить заживление и эпителизацию, в том числе после криодеструкции, сократить пребывание больных в стационаре, уменьшить дозы и сроки антибиотикотерапии, улучшить качество функциональной реабилитации. После криолазерной деструкции раковых опухолей Т2-Т3 стадий, с предварительной трахеостомией, авторы применяли с первого дня после операции дистанционного воздействие излучением полупроводникового лазера на арсениде галлия, на зону разреза для ларингофиссуры и зону расположения разрушенной опухоли. Глубокое проникновение излучения этого лазерного источника позволяло заведомо полно охватить всю зону поражения и хирургической травмы гортани. После уменьшения отечности тканей гортани и деканюлизации на 3-7 день в зону воздействия терапевтическим лазером включали и рану после трахеостомии. Число дней квантовой терапии ограничивали сроком полного заживления трахеостомической раны. По сравнению с больными не получавшими КТ в послеоперационном периоде после трахеостомии и ларингофиссуры. У больных получавших КТ отмечено скорейшее исчезновение отечности, дисфагии, более ранние сроки деканюлизации, более ранняя (на 1-2 недели) выписка из стационара. Исследователи использовали лазеротерапию и у больных раком гортани 3-4 стадии после ларинготомии.
Клинико-морфологические, иммуноморфологические и гистохимические исследования тканей глотки проведенные в 1ЛМИ им.И.П.Павлова показало, что КИ приводит к повышению местного тканевого иммунитета, нормализации метаболических процессов в эпителии слизистой оболочки глотки, усилению регенерационных процессов.
Стимуляция заживления тканей после лучевых ожогов, регенерация нервных волокон, уменьшение микрофлоры в инфицированных ранах, наступающих под воздействием КИ, дает основание к широкому применению низкоинтенсивных лазеров при лечении послеоперационных осложнений.
Репараторные и бактериостатические возможности, стимулируемые КИ, дают основание к его применению в послеоперационном периоде для ускорения заживления ран, профилактики келлоидных рубцов (или их лечения).
Отмечено, что при облучении ран, значительно ускоряется эпителизация, увеличивается прочность рубца линейных ран на разрыв. При лечении гранулирующих ран, зафиксирован выраженный стимулирующий эффект КИ на макрофагально-гистиоцитарную систему. Рост грануляций и эпителизация ускоряется в 2 раза по сравнению с контрольной группой. Келлоидные рубцы при этом не развиваются.
Как ранее упоминалось, используемые в нашей практике магнито-инфракрасно-лазерные терапевтические аппараты оснащены источником постоянного магнитного поля (ПМП). Стимулирующий эффект такого сочетания, в первую очередь, проявляется изменением микрососудов, заключающийся в их расширении и ускоренном новообразовании, за счет усиления пролиферативной активности эндотелиальных клеток. Количественный рост микрососудов после воздействия КИ, подтверждают и исследования В.И.Козлова (1993).
Интересные результаты были получены при лечении больных раком молочной железы IIа-IIIа ст. Воздействие квантовым излучением осуществлялось в до- и послеоперационном периоде с повторением курсов лазерной терапии (длина волны ИК-излучения 0,89 мкм) в последующие сроки наблюдения. По сравнению с контрольной группой, количество послеоперационных осложнений снизилось на 15%. 5-летнее наблюдение за больными показало, что выживаемость в группе больных, получавших лазерную терапию, составила 100% при IIа ст., и 94,4% при IIIа ст. В контрольной группе - соответственно 85,7% и 78,9%. Безрецидивное течение при заболевании IIа ст. - 91,3%, при IIIa ст.- 82,4%. В контрольной группе - соответственно 77,7 и 60%.
Эти свойства КИ дают возможность применять его в онкологии с профилактической целью при пластических операциях, в частности, в области головы и шеи и на молочных железах.
Одной из наиболее эффективных разновидностей пластических операций на молочных железах, является пластика удаленной молочной железы ректо-абдоминальным лоскутом. В Онкологическом научном центре пластические операции различного вида на молочных железах широко проводятся в хирургическом отделении восстановительного лечения.
На представленной ниже фотографии (Рис.1), больная с левосторонней мастэктомией и разметкой для предстоящей пластики ректо-абдоминальным лоскутом.
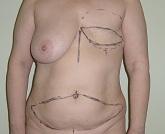
Рис. 1
Больная К., 43 лет, поступила в хирургическое отделение восстановительного лечения с диагнозом: рак левой молочной железы, состояние после радикальной мастэктомии.
Планируемое лечение – пластика левой молочной железы ректо-абдоминальным лоскутом. На термограмме живота (ректо-абдоминального лоскута) сделанной при поступлении отмечается выраженное снижение трофики (кожного кровотока) дистальной части лоскута. Такое снижение кровотока потенциально может привести к краевому некрозу после произведенной пластики молочной железы. Для восстановления нормального кожного кровотока в пересаживаемом лоскуте, больной была назначена комбинированная квантовая терапия. Чрескожное лазерное облучение крови при частоте 50 Гц двумя терминалами на область крупных сосудов (сонные артерии), по 10 мин с каждой стороны., 1 раз в день, всего 5 сеансов. Местно, на область сниженного кровотока пересаживаемого лоскута, больная получила 15 сеансов квантовой терапии. Лечение проводилось при частоте 1000 Гц, двумя терминалами по 2 минуты на каждую точку (8 точек), 2 раза в день. По окончании курса лечения была произведена повторная термография. Зафиксирована нормализация кожного кровотока во всем ректо-абдоминальном лоскуте. Нормализация трофики лоскута подтверждена методом термометрии и радионуклидным методом. Произведена пластика молочной железы ректо-абдоминальным лоскутом. Послеоперационный период протекал без каких-либо осложнений.

Рис. 2, 3.
На термографических снимках живота видно значительное снижение кожного кровотока в области ректо-абдоминального лоскута (зеленый цвет) до квантовой терапии (слева), восстановление кожного кровотока (красный цвет) после проведения соответствующего лечения (справа).

Рис. 4.
Больная после пластики левой молочной железы.
Критериями оценки эффективности воздействия квантового излучения, которое проводится с целью улучшения трофики кожи, служат данные, полученные методом радиоизотопного исследования системы микроциркуляторного кровоснабжения кожи, а также результаты термометрии. Методика термометрии разработана в РОНЦ (патент (19) SU (11) 1012886 А).
Метод радиоизотопного исследования микрогемоциркуляции кожи основан на радиометрии процесса выведения радиоактивного индикатора из кожного микродепо, образующегося после внутрикожного введения препарата (изотонический р-р радиоактивного йодида натрия NaJ131). Исследование проводится в динамике: до воздействия КИ и после 10-15 сеансов. Исходными параметрами, характеризующими состояние микроциркуляции для каждого больного, служат результаты, полученные до воздействия КИ.
Метод термометрии основан на интенсивности инфракрасного излучения, регистрируемого тепловизором с поверхности тела человека и, напрямую, зависит от состояния регионального кровообращения и активности метаболических процессов. Дистанционная инфракрасная термография является методом, позволяющим получать полное представление о термотопографии исследуемой области, с визуальной и количественной оценкой получаемых данных. Исследование проводится в динамике, до и после воздействия КИ.
Отсутствие достаточного количества научных данных о влиянии КИ на растущий организм долгое время ограничивало применение низкоинтенсивных лазеров в педиатрии и, в частности, в детской онкологии. В настоящее время накоплен большой фактический материал об отсутствии токсического и канцерогенного действия КИ, более того, о его способности защищать организм от вредных факторов, например - ионизирующей радиации.
В педиатрии квантовая терапия доказала свою высокую клиническую эффективность и безопасность не только в старшей возрастной группе, но и при лечении новорожденных и недоношенных детей с осложнениями в раннем послеродовом периоде с целью коррекции нервно-рефлекторной возбудимости, угнетения центральной нервной системы, нарушений дыхания. Квантовое излучение повышает эффективность таких лекарственных средств как антибиотики, анальгетики, успокаивающие и снотворные препараты. Накопленный опыт применения КИ в онкологической и педиатрической практике, позволил использовать квантовую терапию в детской онкологии.
В НИИ детской онкологии и гематологии широко применяется квантовая терапия в лечении стоматитов, воспалительных явлений носоглотки, флебитов, длительно незаживающих послеоперационных ран, пролежнях. Пролечено более 1000 больных. Повреждение слизистой оболочки полости рта и желудочно-кишечного тракта - серьезная проблема для детей, получающих химиотерапевтическое лечение. Слизистая оболочка полости рта при стоматите болезненна, на ней образуются дефекты разных размеров и глубины, что ограничивает или делает совсем невозможным прием пищи. В тяжелых случаях это ведет к длительному перерыву в противоопухолевой терапии. В лечении стоматитов применялись и применяются полоскания из отваров трав, растворов лекарственных препаратов, однако эти средства требуют длительных затрат времени. Как правило, эффект от такого вида лечения отмечается на 7-10 день. На этот период времени противоопухолевое лечение прекращается. В НИИ ДОГ проводилось изучение оригинального отечественного препарата – дерината (рабочее название ДНК‑Na). Местно использовался 0,25% раствор. Пролечено свыше 500 больных. Улучшение наступало на 2-3 день от начала лечения, а полная нормализация в большинстве случаев наступала на 5 сутки. Однако данный препарат довольно дорог. При использовании НИЛИ мы отмечаем эффект порой уже после первого сеанса лечения. Полный эффект наступает на 3-5 день лечения.

Рис. 5, 6.
Афтозное поражение слизистой нижней губы на фоне химиотерапии, до начала лечения (слева), на 3-й день от начала квантовой терапии (справа).
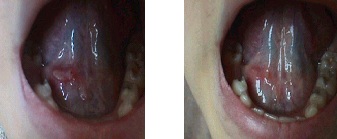
Рис. 7, 8.
Афтозное поражение слизистой нижней поверхности языка. Слева - до начала квантовой терапии, справа – после 3-х сеансов НИЛИ.
Наиболее быстро результаты квантовой терапии (КТ) появляются у детей грудничкового возраста: уменьшается отек, исчезают признаки инфекционного процесса, улучшается самочувствие ребенка. В качестве примера приведем клиническое наблюдение.
Ребенок В., 8 месяцев, поступил в отделение детской онкологии со злокачественной опухолью почки. В соответствии с планом лечения ему была начата химиотерапия. Через две недели от начала лечения ребенок стал беспокойным, отказывался от еды, нарушился сон. При осмотре полости рта на деснах, слизистой щек выявлены множественные язвочки (афты). В тот же день ребенку была начата полифакторная квантовая терапия. Уже через несколько часов ребенок стал менее беспокойным, к вечеру появился аппетит. Квантовая терапия была продолжена, и уже через 4 дня изъязвления в ротовой полости исчезли. Дальнейшую химиотерапию ребенок перенес удовлетворительно. В последующем, при проведении химиотерапии, проводилась полифакторная квантовая терапия с профилактической целью.
В тех случаях, когда лазерная терапия проводилась с профилактической целью (исследовано более 500 больных), слизистая оболочка полости рта не поражалась совсем или наблюдались минимальные изменения, не причиняющие ребенку никаких неудобств. В связи с тем, что сопротивляемость организма инфекциям резко снижается на фоне химиотерапии, важной проблемой для наших детей являются воспалительные заболевания верхних дыхательных путей и носоглотки. В этих случаях КИ способствует уменьшению отека слизистых оболочек и количества слизи, отделяемого при рините, улучшает отхождение мокроты при бронхите. Квантовая терапия применяется и в тех случаях, когда по показаниям ребенку назначены антибиотики, так как квантовое излучение усиливает их эффективность. Как и при лечении стоматитов, быстрое улучшение наблюдается в случаях использования КИ при флебитах после введения химиопрепаратов, отеке и гибели тканей при попадании лекарств под кожу. При немедленном обращении достаточно 2-3 процедур, чтобы полностью снять боль, отек, местное повышение температуры. Большое значение имеет возможность использования КИ с целью ускорения заживления послеоперационных ран. Практически, сроки полного заживления сокращаются в полтора-два раза. Лечение осложнений с помощью КИ позволяет точно соблюдать режим лекарственного и хирургического лечения, в большом числе случаев избегать симптоматического назначения противовоспалительных лекарственных препаратов и анальгетиков, улучшает самочувствие пациентов в процессе лечения.
При наружном воздействии КИ применяют контактную или дистанционную методику. Контактные (излучающая головка терминала находится в непосредственном контакте с облучаемой поверхностью) методы эффективны при небольшой облучаемой поверхности или при проведении профилактического облучения слизистой полости рта на фоне проводимой химиотерапии, когда излучатели устанавливаются на щеки. Отмечено, что при легкой компрессии тканей излучающей головкой проникновение лазерного излучения в ткани увеличивается из-за уменьшения отражающей поверхности и за счет растяжения кожи.
При обширных поражениях (пролежни, обширные флебиты и экстравазаты, лучевые дерматиты, вялотекущие раневые процессы), облучение проводится дистанционно.
При лечении постлучевых реакций кожи во всех случаях был достигнут положительный эффект. Сравнение сроков полного исчезновения местных проявлений у детей, которым проводилась магнито-инфракрасно-лазерная (квантовая) терапия, с историческим контролем показало, что при воздействии КИ сроки выздоровления сократились на 28% (рис. 7,8).

Рис. 9, 10.
Постлучевой эпидермит. Слева – до начала лечения, справа – на 5-й день после лазерной терапии.
Если патологический очаг распространяется с поверхности вглубь, рекомендуется проводить лечение в разных частотных режимах. Лучше всего начинать лечение с высокой частоты в 1000 Гц, а затем переходить на низкую - 50 Гц. Излучатель не должен находиться далее 1 см от облучаемой поверхности, т.к. иначе коэффициент полезного действия будет значительно снижен за счет отражения и рассеивания лазерных лучей. Также рекомендуется перед воздействием КИ обрабатывать кожу спиртом для ее обезжиривания. Это способствует усилению поглощения лазерного облучения. При лечении раневых поверхностей нередко приходится сталкиваться с тем, что они обрабатываются различными мазями. Это заметно увеличивает коэффициент отражения излучения от обрабатываемых тканей, но одновременно усиливает всасываемость мази. В этих случаях мы вначале проводим сеансы КТ, а потом рекомендуем накладывать мазевые повязки. Сеансы проводим утром и вечером, что способствует более быстрому достижению эффекта.
При квантовом облучении костного мозга отмечено, что уже через час возрастает число клеток эритроидного и миелоидного ряда, число митозов, а также усиливаются процессы дифференциации. Через сутки увеличивается число полиморфно-ядерных клеток миелоидного ряда и нейтрофильных лейкоцитов в периферической крови.
Квантовое облучение крови
Одними из первых исследователей, проводивших изучение эффективности лазерного облучения крови у онкологических больных, были ученые Томского НИИ онкологии. При отработке режима сеансов лазерной терапии использовалась экспозиция в 30 мин (для одной группы больных) и 60 мин (для другой группы больных), ежедневно в течение 5 дней. Существенных различий в этих группах больных не выявлено. Не зафиксировано никаких осложнений и побочных проявлений. Отмечено ускорение репарации послеоперационных ран, а анализ отдаленных результатов показал, что частота и сроки возникновения рецидивов в группе больных, которым проводилось лазерное облучение крови, достоверно ниже сравнительно с контрольной группой.
В НИИ детской онкологии и гематологии РОНЦ РАМН проводилось изучение эффективности КГ посредством исследования динамики клеточного иммунитета у детей, получавших химиотерапию по поводу различных злокачественных новообразований. Воздействие КИ осуществлялось на крупные сосуды сонных артерий, в кубитальных, подключичных и подколенных областях. Частота КИ 50 Гц, длительность сеанса для детей старшего возраста составляла 5-10 мин. (облучение крови осуществлялось двумя терминалами-излучателями одновременно). Курс терапии содержал от двух до трех-четырех сеансов. У больных, получивших свыше двух сеансов, установлено повышение числа зрелых Т-лимфоцитов, Т-супрессоров и лимфоцитов. Отмечена положительная динамика, осложнений и побочных проявлений не выявлено.
Для детей младшего возраста выбор дозы КИ должен проводиться индивидуально.
Частота в 50 Гц при квантовом облучении крови выбрана не случайно. Исследователи Земцев И.З. и Лапшин В.П. (1996), изучая механизмы очищения поверхности биомембран от токсических веществ, выявили, что деполяризация мембран (в результате лазерного облучения крови) сопровождающаяся их «промывкой», происходит при частоте импульсов КИ ниже 100 Гц.
Внутриполостное воздействие
Такое воздействие наиболее эффективно в случаях, когда необходимо доставить КИ к патологическому очагу с минимальными потерями энергии. Для этой цели, во-первых, могут применяться специальные оптические насадки – гинеколого-проктологическая № 1 и стоматологическая № 2, которыми могут комплектоваться аппараты типа РИКТА. Второй способ, это эндоскопическая лазерная терапия.
С начала 80-х годов в Онкологическом научном центре проводилось изучение эффективности низкоинтенсивного лазерного излучения у больных предопухолевыми заболеваниями и опухолями верхних отделов желудочно-кишечного тракта. В исследование включались больные с язвенной болезнью желудка, которым традиционное медикаментозное лечение не помогало, а также онкологические больные с воспалительными эрозивно-язвенными осложнениями после радикальных операций на пищеводе и желудке.
Лечение проводилось гелий-неоновыми лазерами с длиной волны 632,8 нм и выходной мощностью до 25 Мвт. Лазерное излучение подводилось непосредственно к очагу поражения при помощи моноволоконого световода диаметром 400 мкм, помещенного в специальный катетер и проводимого через биопсийный канал эндосокпа. В зависимости от размера облучаемой зоны длительность сеанса была от 2-х до 5 минут, таким образом, суммарная энергия на облучаемую поверхность составляла 2,4 – 6 Дж. Сеансы лазерной терапии осуществляли с интервалом через день. Анальгезирующий эффект отмечался практически у всех больных после 1-3 сеансов. Через 3-5 сеансов зафиксировано очищение дна язвы от некротических налетов и появление сочных розовых грануляций. Заживление язвы происходит после 5 – 10 сеансов.

Рис. 11, 12.
На представленных рентгенограммах, язва малой кривизны желудка до начала лечения (слева) и после проведения лазерной терапии (справа).

Рис. 13, 14.
На представленных эндоскопических фотографиях того же больного, язва малой кривизны желудка (слева), полная эпителизация язвы после лазерной терапии (справа).
Больные с воспалительными эрозивно-язвенными осложнениями, после радикальных операций на пищеводе и желудке, относятся к группе наиболее неблагоприятных в плане возможности традиционной терапии. В данной ситуации, использование эндоскопической лазерной терапии, приносит больным огромное облегчение. Купируется болевой синдром, снимаются выраженные воспалительные изменения в пищеводе и желудке, восстанавливается нормальный пассаж пищи через анастомоз, прекращается тошнота и рвота. На представленных эндофотографиях хорошо виден эффект лазерной терапии у таких больных. Средние сроки достижения такого результата 17 – 19 дней.

Рис. 15, 16, 17.
На представленных эндоскопических фотографиях язва пищеводно-желудочного анастомоза у больного после проксимальной резекции желудка. До начала лечения (слева), частичное ее заживление после четырех сеансов лазерной терапии (в центре) и полная эпителизация язвы после семи сеансов лазерной терапии (справа).
В НИИ ДОГ данную методику применяют при лечении лучевых вагинитов, отитов и обширных афтозных поражениях полости рта.
Любая система от клетки до биоткани в целом работает на низком энергетическом уровне, что необходимо учитывать при подборе терапевтических доз, так как большое количество доставленной энергии не повышает, а угнетает систему. Считается, что курсовая доза облучения не должна превышать 1 Дж на 1 кг массы тела. К воздействию КИ на организм применим закон Вилдера:
при повышении или понижении исходного показателя относительно нормы реакция организма на физиологическое воздействие направлена в сторону установления его среднего (нормального) значения, если же исходный показатель не отклоняется от нормы - реакция организма почти отсутствует.
Cледует отметить, что, несмотря на различное проявление зависимости биоэффекта от дозы излучения (закон Арндта-Шульца) у разных больных, при назначении дозы НИЛИ следует помнить о высказывании И.П. Павлова: «Не подлежит сомнению, что дозировка имеет гораздо большее значение при изменении вниз, чем вверх. Вся штука в варьировании дозировок вниз...».
Наиболее часто в онкологической практике КИ применяется в следующих случаях:
Лучевые ожоги, раневые поверхности, пролежни, постъиньекционные абсцессы: рекомендуемый режим, токсический гепатит, стоматиты, гингивиты, вульвовагиниты. Болевой синдром: в зависимости от локализации болей, частота и время экспозиции подбираются индивидуально. Помимо местного воздействия проводится квантовая гемотерапия. Излучатели устанавливаются на область локализации крупных сосудов (кубитальные, надключичные, паховые, подколенные, сонные). Время воздействия двумя излучателями 5-10 мин (для детей старшего возраста) при частоте 50 Гц. У детей младшего возраста время экспозиции зависит от объема крови и рассчитывается индивидуально.
Местное воздействие КИ при каждой из вышеперечисленных патологий может сопровождаться КГ (в случае отсутствия противопоказаний к данной манипуляции).
ПРОТИВОПОКАЗАНИЯ
Основными противопоказаниями для проведения квантовой гемотерапии являются:
- - заболевания крови с синдромом кровоточивости;
- - тромбоцитопения ниже 600000;
- - острые лихорадочные состояния;
- - коматозные состояния, туберкулез в активной стадии;
- - гипотония;
- - декомпенсированные состояния сердечно-сосудистой, выделительной, дыхательной и эндокринной систем.
При местном лечении таких осложнений химио-лучевой терапии, как: стоматиты, гингивиты, радиоэпителииты, а также пролежни, вялотекущие раневые процессы, - вышеперечисленные заболевания и состояния не являются абсолютным противопоказанием.
Абсолютным противопоказанием для местного применения НИЛИ являются зоны локализации злокачественного процесса.
Аппараты
1.Аппарат магнито-инфракрасный лазерный терапевтический РИКТА 04/4 (Домашний) 
- Средний срок службы, лет: 5
- Производитель: ЗАО "МИЛТА-ПКП ГИТ"
- Страна происхождения: Россия
Технические характеристики
Длина волны, нм
· лазерного инфракрасного излучения: 905
· широкополосного инфракрасного излучения: 875
· красного видимого излучения: 640
Частота повторения импульсов, Гц
Дата добавления: 2020-12-12; просмотров: 147; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
