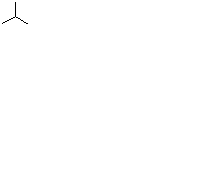
Задача 5. Геометрические изомеры
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
Государственное образовательное учреждение дополнительного профессионального образования
«Донецкий республиканский институт дополнительного педагогического образования»
ЗАДАНИЯ МУНИЦИПАЛЬНОГО ЭТАПА РЕСПУБЛИКАНСКОЙ ОЛИМПИАДЫ ПО ХИМИИ
Учебный год
Класс
Перечень учебников, на основании которых составлены задания:
1. Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 класс. – 4-е изд. – М.: Просвещение, 2016. – 207 с.
2. Рудзитис Г.Е., Фельдман Ф.Г. Химия. 9 класс. – 2-е изд. – М.: Просвещение, 2016. – 208 с.
3. Рудзитис Г.Е., Фельдман Ф.Г. Химия. 10 класс. учеб. для общеобразовательных организаций: базовый уровень. – М.: Просвещение, 2014. – 224 с.
Задача 1. Равновесие
Два стакана одинаковой массы, в одном из которых находится 100 г 18,3%-й соляной кислоты, а в другом – 100 г 16%-го раствора сульфата меди (II), поместили на две чаши весов. В стакан с соляной кислотой добавили 2,0 г карбоната кальция.
1. Вычислите объем выделившегося газа (н.у.) (5 баллов).
2. Какой стакан после окончания реакции соляной кислоты и карбоната кальция станет тяжелее? Почему (2 балла)?
3. Сколько граммов железа необходимо добавить к раствору сульфата меди (II), чтобы весы снова уравновесились (3 балла)?
4. Приведите не менее десяти областей применения карбоната кальция (5 баллов).
Всего 15 баллов
Решение.
1. 2HCl + CaCO3 = CaCl2 + CO2 + H2O
|
|
|
n(HCl) = 100·0,183/36,5 = 0,5 моль – избыток
n(CaCO3) = 0,2/100 = 0,02 моль – недостаток
n(CaCO3):n(СО2) = 1:1, n(СО2) = 0,02 моль
V(CO2) = 0,02·22,4 = 0,448 л
2. Более легким будет стакан с сульфатом меди (II), так как происходит удаление углекислого газа.
3. m(cтакана НСl+CaCO3)до р-и = 100 + 2 = 102 г
m(cтакана НСl+CaCO3)после р-и = 100 + 2 – m(CO2) = 102 – (0,02·44) = 101,12 г
С учетом того, что масса стакана с раствором сульфата меди (II) равна 100 г, для уравновешивания чашек весов в него нужно добавить 1,12 г железа.
4.
1) Используется в пищевой промышленности (антислеживатель, пигмент).
2) Используется в бумажной промышленности (отбеливатель, наполнитель, раскислитель).
3) Используется при производстве пластмасс, красок, резины, продукции бытовой химии в качестве наполнителя и пигмента.
4) Используется для побелки стен, покраски стволов деревьев.
5) Являясь основой мела, используется для письма на досках.
6) Используется для подщелачивания почвы в садоводстве.
7) Используется при производстве стекла, стекловолокна.
8) Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
9) Используется как красящий пигмент, используемый при производстве красок.
10) Используется как наполнитель шпаклёвок и герметиков.
11) Используется как составной элемент при производстве продукции бытовой химии - средств для чистки сантехники, кремов для обуви.
|
|
|
[1]. §§ 36-38, 47 + олимпиадный элемент.
Задача 2. О строении углеводородов…
Соединения А, В, С содержат в своем составе по четыре атома углерода и относятся к разным классам углеводородов. Некоторые характеристики для этих соединений приведены в таблице.
| Характеристика | А | B | C |
| Молярная масса, г/моль | 58 | ||
| DH2 | |||
| Количество электронов в молекуле | 32 | ||
| Количество σ-связей в молекуле | |||
| Количество p-связей в молекуле | 2 | ||
| Молекулярная формула |
1. Пустые ячейки в таблице заполните соответствующими характеристиками соединений А, В, С (6 баллов).
2. Для молекулярных формул соединений А, В, С, которые вы установили в первом задании, изобразите по 2 любых изомера. Назовите вещества согласно систематической номенклатуре (5 баллов).
3. В каждом изображенном изомере укажите типы гибридизации атомов углерода, значение валентных углов (4 балла).
Всего 15 баллов
Решение.
1.
| Характеристика | А | B | C |
| Молярная масса, г/моль | 58 | 56 | 54 |
| DH2 | 29 | 28 | 27 |
| Количество электронов в молекуле | 34 | 32 | 30 |
| Количество σ-связей в молекуле | 13 | 11 | 9 |
| Количество p-связей в молекуле | − | 1 | 2 |
| Молекулярная формула | С4Н10 | С4Н8 | С4Н6 |
2, 3.
|
|
|
| Соединение А | Структурная формула | |
| |||||
| Название | н-бутан | метилпропан (изобутан) | ||||||
| Тип гибридиза-ции | Гибридизация всех атомов углерода – sp3 | Гибридизация всех атомов углерода – sp3 | ||||||
| Валентные углы | Валентные углы по 109,50(109028/) | Валентные углы по 109,50(109028/) | ||||||
| Соединение В | Структурная формула | 
| 
| 
|
| 
| ||
| Название | бутен-1 (1-бутен, бут-1-ен) | бутен-2 (2-бутен, бут-2-ен) | метилбутен | циклобутан | метил-циклопропан | |||
| Тип гибридиза-ции | C1, C2 – sp2 C3, C4 – sp3 | C2, C3 – sp2 C1, C4 – sp3 | C2, C4 – sp2 C1, C3 – sp3 | Гибридизация всех атомов углерода – sp3 | ||||
| Валентные углы | C1, C2 – 1200 C3, C4 – 109,50(109028/) | C2, C3 – 1200 C1, C4 – 109,50(109028/) | C2, C4 – 1200 C1, C3 – 109,50(109028/) | Валентные углы близки к значению 109,50(109028/) | ||||
| Соединение С | Структурная формула | 
| 
|
|
| |||
| Название | бутин-1 (1-бутин, бут-1-ин) | бутин-2 (2-бутин, бут-2-ин) | бутадиен-1,3 (1,3-бутадиен, бут-1,3-диен) | бутадиен-1,2 (1,2-бутадиен, бут-1,2-диен) | ||||
| Тип гибридиза-ции | C1, C2 – sp C3, C4 – sp3 | C2, C3 – sp C1, C4 – sp3 | Гибридизация всех атомов углерода – sp2
| С1, C2, C3 – sp C4 – sp3 | ||||
| Валентные углы | C1, C2 – 1800 C3, C4 – 109,50(109028/) | C2, C3 – 1800 C1, C4 – 109,50(109028/) | Все углы по 1200 | С1, C2, C3 – 1800 C4 – 109,50(109028/) | ||||
| Структурная формула | 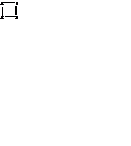
| 
|
|
| ||||
| Название | циклобутен | 2-метил-циклопропен | 3-метил-циклопропен | метилен-циклопропан | ||||
| Тип гибридиза-ции | C1, C2 – sp2 C3, C4 – sp3 | C1, C2 – sp2 C3, C4 – sp3 | C1, C2 – sp2 C3, C4 – sp3 | C3, C4 – sp2 C1, C2 – sp3 | ||||
| Валентные углы | C1, C2 – 1200 C3, C4 близки к 109,50(109028/) | C1, C2 – 1200 C3, C4 близки к 109,50(109028/) | C1, C2 – 1200 C3, C4 близки к 109,50(109028/) | C3, C4 – 1200 C1, C2 близки к 109,50(109028/) | ||||
[3] §§ 2, 4, 5, 7, 8, 10, 13, 14.
Задача 3. Органические и неорганические превращения
Дана схема превращений:
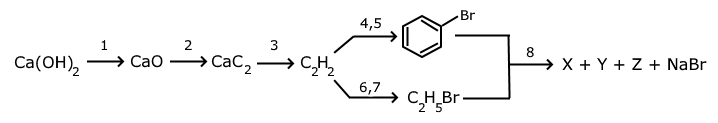
1. Напишите уравнения реакций 1-8, укажите условия их протекания. Расшифруйте углеводороды Х, Y, Z, которые образуются по реакции Вюрца с участием бромбензола и бромэтана (8 баллов).
2. Разложение гидроксида кальция является эндотермическим обратимым процессом (реакция 1). Какие из нижеперечисленных факторов будут способствовать смещению равновесия реакции в сторону образования оксида кальция: а) повышение температуры; б) понижение температуры; в) повышение давления; г) понижение давления. Обоснуйте свой ответ (4 балла).
3. Ацетиленово-кислородная смесь имеет температуру пламени более 2000°С, что позволяет ее использовать для сварки изделий из железа. Определите количество теплоты, которое выделится при сжигании 2 м3 ацетиленово-кислородной смеси, если термохимическое уравнение имеет вид: С2Н2(г) + 2,5О2(г) = 2СО2(г) + Н2О(г) + 2610 кДж, а мольное отношение ацетилена и кислорода в смеси составляет 1:3 (8 баллов).
Всего 20 баллов
Решение.
1. Сa(OH)2 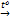 CaO + H2O
CaO + H2O
CaO + 3C 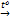 CaC2 + CO
CaC2 + CO
CaС2 + 2H2O ® C2H2 + Ca(OH)2
3C2H2 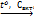 C6H6
C6H6
C6H6 + Br2 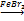 C6H5−Br + HBr
C6H5−Br + HBr
C2H2 + 2H2 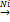 C2H6
C2H6
C2H6 + Br2  C2H5Br + HBr
C2H5Br + HBr
C6H5Br + C2H5Br + 2Na = 2NaBr + C6H5−C2H5 (+ C4H10; + C6H5−C6H5).
2. Сa(OH)2  CaO + H2O – Q.
CaO + H2O – Q.
Поскольку прямая реакция эндотермическая, для смещения равновесия в сторону оксида кальция необходимо повысить температуру (согласно принципу Ле Шателье повышение температуры смещает равновесие в сторону эндотермической реакции), и понизить давление (до реакции 0 моль газов, после реакции 1 моль газов (вода).
3. С2Н2(г) + 2,5О2(г) = 2СО2(г) + Н2О(г) + 2610 кДж
В 2м3 мольное отношение газов составляет 1:3, то есть, ацетилена 0,5 м3 (22,32 моль), кислорода 1,5 м3.
Количество выделившейся теплоты: 22,32 моль·2610 кДж = 58,255 мДж.
[1] §§ 40, 42, 47. [2] §§ 2, 5. [3] §§ 9, 14-16.
Задача 4. Газы и кристаллы
В колбе объемом 5 л находится смесь, состоящая из моноиодалкана А (ω(I) = 81,41%) и иодоводорода. При нагревании колба заполнилась парами фиолетово-сиреневого цвета. Когда смесь привели к нормальным условиям, фиолетово-сиреневая окраска исчезла, а на стенках колбы образовались блестящие кристаллы серо-черного вещества K, давление в колбе при этом снизилось в 2,23 раза.
1. Расшифруйте вещество А (8 баллов).
2. Определите массу серо-черных кристаллов вещества К (7 баллов).
Далее серо-черные кристаллы вещества К растворили в 150 г 5,33%-го горячего раствора гидроксида натрия. В результате, в растворе образовались соли В и С.
3. Определите массовые доли (в %) солей В и С в полученном растворе (5 баллов).
Всего 20 баллов
Решение.
1. СnH2n+1I
0,8141 = 127/(14n+128); n = 2. Моноиодалкан A – иодэтан C2H5I. Вещество К – иод I 2 .
2. C2H5I + HI ® C2H6 + I2
Изменение давления в 2,23 раза свидетельствует о сокращении объема в 2,23 раза. Сокращение объема произошло из-за десублимации иода. Тогда, объем оставшегося газа является объемом этана.
V(C2H6) = 5/2,23 = 2,24 л, что соответствует 0,1 моль этана.
V(I2) = 5-2,24 = 2,76 л
Тогда n(I2) = 2,76/22,4 = 0,1232 моль
3. 3I2 + 6NaOH = NaIO3 + 5NaI + 3H2O. Соли В,С – иодат и иодид калия.
n(I2) =0,1232 моль, n(NaOH) = (0,0533∙150) г/ 40 г/моль = 0,2 моль.
n(NaIO3) = 0,033 моль, m(NaIO3) = 0,033 моль ∙ 198 г/моль = 6,534 г.
n(NaI) = 0,1667 моль, m(NaI) = 0,1667 моль ∙ 150 г/моль = 25,005 г.
n(I2)ост = 0,0232 моль, m(I2)ост = 5,9 г
m(р-ра) = 150+(0,1232 ∙ 254) - 5,9 = 175, 4 г.
ω(NaIO3) = 6,534/175,4 ∙ 100% = 3,73%, ω(NaI) = 25,005/175,4 ∙ 100% = 14,26%.
[1] §§ 15, 34, 36-38, 47 + олимпиадный элемент.
Задача 5. Геометрические изомеры
При пропускании смеси цис- и транс-изомеров алкена Х через избыток нейтрального раствора перманганата калия масса выпавшего осадка оказалась в 1,036 раз больше массы алкена.
1. Определите алкен Х (8 баллов).
2. Объясните различие в строении цис- и транс-изомеров. Отличаются ли цис-транс-изомеры по физическим свойствам, какие из них более устойчивы (10 баллов)?
3. Среди ниже перечисленных веществ выберите те, которые будут реагировать с алкеном Х. Напишите уравнения реакций, укажите условия их протекания. Перечень: а) H2O2/kat; б) HCl; в) H2O; г) О2/Ag; д) ICl; е) С2Н6 (12 баллов).
Всего 30 баллов
Решение.
1. 3СnH2n + 2KMnO4 + 4H2O = 3CnH2n(OH)2 + 2MnO2¯ + 2KOH
Пусть в реакцию вступило 3 моль алкена, тогда его масса будет равна: 3·14n = 42n г.
В результате реакции образовалось 2 моль осадка MnO2. Его масса будет равна: 2·87 = 174 г.
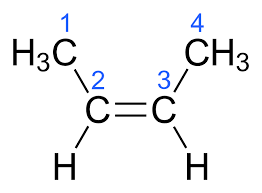
По условию задачи, масса алкена меньше массы образовавшегося осадка, значит справедливо выражение: 42n·1,036 = 174. Откуда n = 4. Следовательно, искомое вещество: Х – бутен-2.
2. Цис- и транс-изомеры отличаются пространственным расположением заместителей около двойной связи.
| 
|
В цис-изомерах одинаковые заместители находятся по одну сторону от плоскости двойной связи. В транс-изомерах одинаковые заместители находятся по разные стороны от плоскости двойной связи. Цис- и транс-изомеры отличаются по физическим свойствам, например, имеют различные температуры кипения. Транс-изомеры более устойчивы по сравнению с цис-изомерами, в которых присутствуют межатомные отталкивания между атомами или группами атомов при двойной связи.
3.

|

|

|

|

|
[3] §§ 10, 11 + олимпиадный элемент.
Задания подготовлены
Дата добавления: 2021-03-18; просмотров: 239; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!