ХИМИЗМ ПОЛУЧЕНИЯ ГРЕМУЧЕЙ РТУТИ
Глава 3
ГРЕМУЧАЯ РТУТЬ
§ 1. ОТКРЫТИЕ ГРЕМУЧЕЙ РТУТИ И ЕЕ ПРИМЕНЕНИЕ
С достаточной достоверностью установлено, что некоторые соли гремучей кислоты были известны алхимикам еще в средние века.
Так, например, в рукописи так называемого Базилиуса Валентинуса, относящейся к первой половине XVII века, упоминается гремучее золото, открытие которого принадлежит, повидимому, голландцу Корнелиусу Ван-Дроббелю. Во всяком случае в первой половине XVII века уже знали характер действия этого очень бризантного ВВ. В эфемеридах Германской академии естественных наук в Нюрнберге за 1678 г. упоминается о двух взрывах во время работы с гремучим золотом. По мнению Ромоцкого, Ван-Дроббелю была известна и гремучая ртуть (около 1628 г.). Однако первое указание о приготовлении гремучей ртути принадлежит Кункелю (1690 г.).
В конце XVII века и в XVIII веке все эти работы над солями гремучей кислоты были, видимо, основательно забыты. Вторичное открытие гремучей ртути Говардом (1799 г.), а затем гремучего серебра Бруньятелли (1802 г.) произошло в период, когда химия как наука была очень молода и постепенно выходила из тьмы схоластики. Поэтому понятны те совершенно случайные обстоятельства, при которых гремучая ртуть была приготовлена Говардом.
Согласно представлению того времени при воздействии спирта— носителя водорода — на азотную кислоту, являющуюся носителем кислорода, должна была получиться соляная кислота, которая в присутствии окиси ртути должна была соединиться со ртутью и- дать хлорную ртуть. Говард действовал азотной кислотой на красную окись ртути, растертую со спиртом, и в результате бурной реакции вместо ожидаемой хлорной ртути получил гремучую ртуть. Перекристаллизованная белая соль, которую Говард принял вначале за сулему, не показала реакции на связанную соляную кислоту, Когда же Говард облил соль концентрированной серной кислотой, то она с громадной силой взорвалась. Таковы обстоятельства получения Говардом гремучей ртути.
|
|
|
Гремучая ртуть является одним из весьма важных и распространенных ВВ, и несмотря на то, что в каждом отдельном случае в объектах она применяется в очень небольших количествах (от 0,01 до 2 г) нередко можно встретить заводы производительностью в 2000—2500 кг гремучей ртути в месяц. У Штеттбахера и Наума имеются указания о производстве даже 7000 кг в леделю одним заводом
| Годы | Количество кг |
| 1910 1912 1014 1916 1917 1918 | 104800 124 400 108 900 2S5 500 357 600 17 800 |
|
|
По данным Каста, производство гремучей ртути в Германии с 1910 по 1918 г. выражалось следующими цифрами (см. таблицу).
|
|
|
Области применения гремучей ртути обширны. В самом недалеком прошлом ею снаряжались все капсюли-детонаторы. В последнее же время она уступает свое место в капсюлях-детонаторах азиду свинца.
Ударные составы всех капсюлей-воспламенителей в качестве обязательного компонента содержат гремучую ртуть. Правда, и здесь, особенно для капсюлей ручного оружия, делаются попытки заменить ее стифнатом свинца и тетразеном.
Гремучая ртуть применяется также в некоторых фрикционных составах и в качестве одного из компонентов сердцевины детонирующих шнуров.
§ 2. ЭЛЕМЕНТАРНЫЙ СОСТАВ И СТРОЕНИЕ ГРЕМУЧЕЙ РТУТИ
Открытие Говарда вызвало большой теоретический интерес в научном мире. Исследование гремучей ртути производилось и производится с момента ее открытия до настоящего времени. Ею серьезно занимались такие великие химики, как Бертолле, Либих, Ге-Люссак, Берцеллиус, Тенард, Дюма, Е. Деви, Велер, Жерар, Кекуле и др.
Во всех их исследованиях рассматривался прежде всего элементарный состав гремучей ртути и только позже было обращено внимание на изучение строения интересной во многих отношениях гремучей кислоты.
Сам Говард на основании обширных исследований природы открытого им нового замечательного вещества считал гремучую ртуть соединением «эфирного селитренного газа» (nitrous etherized gas, ныне— этилнитрит), щавелевой кислоты, ртути и кислорода в следующих весовых отношениях:
|
|
|
щавелевой кислоты- ........ 21,28%
ртути ................ 64,72%
этилнитрата и кислорода ..... 14,00%
Интерес, проявленный но отношению к вновь открытому соединению, был, невидимому, настолько велик, что уже в 1801 г. Бертолле опубликовал свою работу о гремучей ртути. Он обрабатывал гремучую ртуть разбавленной серной кислотой, но вмести ожидавшейся нм щавелевокислой соли ртути он получил сернокислую закись ртути. При действии соляной кислоты ему также не удалось получить щавелевую кислоту. Таким образом Бертолле показал, что щавелевая кислота не входит в состав молекулы гремучей ртути. При энергичной обработке гремучей ртути едким кали Бертолле обнаружил выделение аммиака. Между прочим он так же, как раньше Говард, заметил, что гремучая ртуть не получается всегда одинакового состава, что иногда она полностью растворяется в соляной кислоте, а в других случаях остается нерастворимый остаток. Из своей работы Бертолле сделал вывод, чти гремучая ртуть состоит из сильно окисленной ртути, аммиака и неизвестного органического вещества, родственного спирту.
|
|
|
Позднейшие работы Фуркруа и Теннара не дали никаких существенных решений вопроса о составе гремучей ртути, однако, они внесли некоторую ясность в противоречивые выводы Говарда и Бертолле, доказав, что состав гремучей ртути зависит от способа ее получения. Так, если растворы исходных веществ нагревать недолго (несколько мгновений и не до кипения), то гремучей ртути образуется немного, причем она будет в смеси с азотнокислой ртутью. Если кипятить несколько минут, то получаемая гремучая ртуть достаточно чиста и не содержит щавелевои кислоты. И, наконец, если кипятить пол-часа, то образуется, главным образом, щавелевокислая ртуть с небольшим количеством гремучей ртути.
Дескостиль исследовал в 1807 г. гремучее серебро, полученное так же. как и гремучая ртуть, и пришел к выводу, что оно представляет собой соединение окиси серебра с аммиаком и “растительным веществом», т. с. является родственным гремучей ртути. Надо отметить, что Дескостнлю удалось произвести очень точное по тому времени определение содержания серебра в гремучем серебре (он нашел 71%, в то время как по теории должно было быть 72%).
Развитие точных методов органического анализа дало возможность выяснить окончательно состаб гремучей ртути и гремучего серебра. Но для этого все же понадобилось около 35 лет (с 1811 г. по 1848 г.).
Из работ этого периода прежде всего необходимо отметить работы Либиха. Правда, первая его работа содержала много недостатков и не могла способствовать разрешению вопроса. Например, из тех фактов, что выделяющийся при кипячении гремучего серебра с едким кали газ окрашивал красную лакмусовую бумажку в синий цвет и что насыщенный раствор гремучего серебра в едком кали давал с кальциевыми солями осадок, обладавший свойствами щавелевокислого кальция, Либих сделал заключение, что гремучее серебро состоит из окиси серебра, аммиака и щавелевой кислоты. Этим своим заключением Либих вновь запутал вопрос о составе. Впоследствии, при применении более точной методики, Либих убедился в отсутствии аммиака и щавелевой кислоты в составе гремучего серебра, а также в том, что осадок, получающийся при действии кислот на раствор гремучего серебра в едком кали, обладает свойствами какой-то особой кислоты, не напоминающей щавелевую и обладающей взрывчатыми свойствами.
Следует отметить, что, исследуя осадок, получающийся при нейтрализации щелочного раствора гремучего серебра, и наблюдая выделение синильной кислоты при разложении гремучекислых солей, Либих сделал вывод, что гремучие соли можно рассматривать как металлические соли кислоты, содержащей группу циана, подобно железисто-синеродистым солям.
Первые анализы Либиха гремучей ртути и гремучего серебра были очень неточны, однако, Берцеллиус на их основании вывел следующие формулы:
для гремучего серебра
Ag + 2N4С4H12O7 + 4Н2О
для гремучей ртути
Hg + N4H4C12O7 + 2Н2О
Исходя из последующих данных Либиха и Ге-Люссака, была выведена для гремучего серебра формула: Ag2O4С4N2. В современных атомных весах эта формула получает следующий вид:
Ag2O2С2N2.
В 1882 г. Велер получил циановосеребряную соль, и анализ показал, что она обладает тем же процентным составом, что и гремучее серебро. Ге-Люссак объяснял еще тогда отличие в свойствах этих соединений при одной и той же эмпирической формуле различием структуры молекул. Однако Берцеллиус и его школа вначале строго придерживались взгляда, что соединения одного и того же состава должны быть идентичными и не могут отличаться друг от друга даже по своему строению Берцеллиус даже сомневался в правильности анализа гремучего серебра, произведенного Либихом и Ге-Люссаком. Он считал, что гремучее серевро отличается и по составу от циановосеребряной соли и что оно является «циановокислой окисью серебра», занимающей промежуточное положение между серебряными солями синильной и циановой кислот.
Либих пытался выяснить строение молекулы гремучей ртути, причем особое внимание он обращал на то, как связаны между собой отдельные части молекулы. Он пришел к выводу, что углерод и азот в гремучей кислоте находятся в том же положении, как и в циане, но окончательно разрешить вопрос о строении гремучей ртути ему не удалось, несмотря на большое разнообразие опытов. Другие ученые того времени (Кюи) также не сумели объяснить изомерию гремучей и циановой кислот.
После этих неудачных попыток Берцеллиус в 1844 г. отверг даже возможность существования изомерии и возвратился к старому положению Либиха, что гремучее серебро является серебряной солью кислоты, содержащей металл, т. е- соединением комплексного порядка.
Либих к этому времени считал мнение Берцеллиуса неверным и остановился на формуле гремучей кислоты 2HgC4N2O2; он считал ее двухосновной и полимерной циановой кислоте.
Когда же в 1848 г. Гладстон получил мочевину и сульфоциановую кислоту взаимодействием сернистого водорода и медноаммонийного фульмината, чем была доказана тесная связь между циановой и гремучей кислотами, Берцеллиус высказался за существование изомерии и вскоре стал настолько серьезным защитником этой теории, что и ныне за Берцеллиусом считается первенство введения в химию понятия об изомерии.
Однако выяснение состава гремучей ртути и введение в химию понятия об изомерии все же долгое время не привели к решению вопроса о строении гремучей кислоты.
В 40-х годах прошлого столетия в связи с открытием нитросоединений многоатомных спиртов и углеводородов, с получением глицеринтринитрата, азотных эфиров маннита и клетчатки и других взрывчатых соединений выработался новый взгляд на состав солей гремучей кислоты. Носителем взрывчатых свойств стали считать нитрогруппу, а потому и в гремучей кислоте пытались обнаружить наличие этой группы. Жерар в своем учебнике органической химии рассматривал гремучую ртуть как нитросоединение. В новом издании своего учебника (1854 г.) он отказался от своего мнения и высказал предположение о том, что гремучая кислота является эфиром азотной кислоты.
Против этих утверждений и предположений Жерара возражали Либих, Поггендорф и Велер, вполне справедливо указывавшие, что существуют ВВ и без кислорода и что азот в гремучей кислоте не может быть связан с кислородом, так как при действии сероводорода на медноаммонийный фульминат последний разлагается с образованием мочевины и роданистого водорода.
Однако Кекуле, идя по стопам Жерара, пытался приписать гремучей кислоте формулу нитроацетонитрила: CH2NO2CN.
Интересно привести опыты, которыми Кекуле доказывал правоту своей формулы. Растворяя гремучую ртуть в соляной кислоте и сравнивая ее элементарный состав с гремучим серебром, Кекуле показал, что гремучая ртуть представляет собой соль закиси, а не окиси ртути. Он повторил опыты Либиха по изучению действия хлора па гремучую ртуть. Продуктом реакции кроме хлорциана и сулемы оказались и другие хлорзамещенные, среди которых был обнаружен хлорпикрин. Оба эти продукта (хлорциан и хлорпикрин), казалось, доказывали существование в гремучей кислоте нитригруппы наряду с группой циана. Все же Кекуле не считал, что сообщенные им факты окончательно подтверждают данную им формулу.
За два года до опубликования работы Кекуле Шишков открыл одноосновную фульминуровую кислоту состава C3H3N3O3, названную им изоциануровой кислотой. Почти одновременно это открытие сделал и Либих. Фульминуровая кислота была получена действием щелочных растворов галоидов на гремучую ртуть. Свободный переход гремучей кислоты в фульминуровую Шишков объяснял аналогичной группировкой атомов в обеих кислотах. Он пришел к заключению, что гремучая кислота не может содержать в себе нитрогруппы, так как полученная им новая кислота оказалась стойкой по отношению к восстановителям, например, к сернистому аммонию. Он также считал, что гремучая кислота — сложное соединение, в солях которого металл непосредственно связан с азотом. Неправильное предположение о неизменяемости гремучей ртути при обыкновенной температуре под влиянием растворов йодистого калия и едкого кали навело его на мысль о том, что гремучая кислота стоит ближе к амидам, чем к кислотам. В дальнейшем Шишков отказался от этой гипотезы в пользу предположения, что гремучая кислота содержит нитрогруппу. В то же время он утверждал, что гремучая кислота не может быть простейшим нитроацетонитрилом, а должна иметь формулу:
(CONH)2CH2NO2CN
Впоследствии Шишковым была предложена еще одна формула гремучей кислоты:
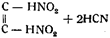
на том основании, что фульминаты способны при разложении выделять синильную кислоту и образовать муравьиную кислоту при действии кислот на фульминаты или бромистого циана при действии брома.
Теории Шишкова, частично опиравшиеся на блестящие экспериментальные работы, нс снесли изменения в формулу Жерара—Кекуле и до 80-х годов не могли поколебать взгляда на гремучую кислоту, как на нитроацетонитрил.
Соли гремучей кислоты по своей взрывчатости имеют сходство и с диазосоединениями. Основываясь на этом, Грис в 1860 г. пытался присвоить гремучей кислоте строение диазоуксусной кислоты:
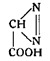
Однако диазоуксусная кислота была получена в 1888г. Курниусом, и таким образом была доказана неправильность предположения Гриса.
Попытка Вюрстера дать экспериментально не обоснованную опытом формулу гремучей кислоты:

также не увенчалась успехом.
Следует привести еще формулу Армстронга, появившуюся в 1975 г.

Правда, серьезного обоснования этой формулы Армстронг не дал.
В 80-х годах Карстаньен и Эренберг установили, что при действии крепкой соляной кислоты на гремучую ртуть выделяется гидроксиламин. К этому же выводу пришел и Штейнер.
В это же время Ф. Мейер и его ученики доказали, что при действии на гидроксиламин альдегидов и кетонов получаются изонитрозосоединения (оксимы), содержащие группу С=NOH, и что при действии на них концентрированной соляной кислоты гидроксиламин выделяется вновь. На основании сходства фульминатов с металлическими производными оксимов Штейнер предложил приписать гремучей кислоте формулу диизонитрозоэтилена:
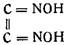
Штейнер установил, что весь азот гремучей кислоты выделяется в виде гидроксиламина. Эренберг подробно исследовал реакцию между фульминатами и соляной кислотой и пришел к тому же выводу. Этими количественными опытами они установили необоснованность нитроацетонитрильной формулы Жерара — Кекуле.
Диверс, основываясь на ошибочном наблюдении Либиха, что азотистый ангидрид со спиртовым раствором солей серебра или ртути дает фульминаты, предложил формулу оксифуразана:
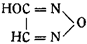
Образование гремучей кислоты, по Диверсу, происходило по уравнению:
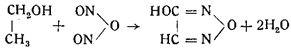
В то же время Армстронг, отказываясь от своей прежней формулы, данной им в 1845 г., и возражая Диверсу, предложил формулы:
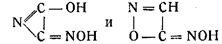
Точно так же в результате ошибочных наблюдений появились формулы:
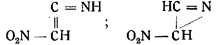
Большинством этих формул авторы представляли гремучую кислоту как производную этана — системы из двух углеродных атомов,— базируясь на том, что исходным веществом для нее служит этиловый спирт и что гремучая кислота является двухосновной.
Только Шолль и Голлеман в начале 90-х годов прошлого века направили химию гремучей кислоты на новые рельсы и на основании новых реакций доказали легкий переход гремучей кислоты в производные циановой кислоты.
Голлеман в 1890 г. для объяснения своих наблюдений над фульминатами высказал предположение, что гремучая кислота реагирует как таутомерное вещество в трех видах:
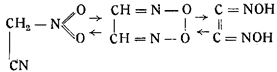
т. е. как нитроацетонитрил, перекись глиоксима и диизонитрозоэтилен. В том же году Шолль предложил формулу гремучей кислоты как производную формоксима.
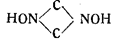
Впоследствии Шолль сам доказал на основании ряда обстоятельных исследований, что гремучую кислоту нельзя рассматривать ни как нитроацетонитрил, ни как перекись глиоксима, что производные нитроацето нитрила дают совершенно иные продукты превращения, чем производные гремучей кислоты, и что, следовательно, последняя не идентична с нитроацетонитрилом.
Окончательное подтверждение неправильности нитроацетонитрильной формулы строения гремучей кислоты экспериментально было доказано только после получения самого нитроацетонитрила Штейнконфом в 1908 г. действием хлорангидрида сернистой кислоты на метазоновуго кислоту:

Рядом исследований (реакции на CN и NO2, определение молекулярного веса, реакции восстановления и т. п.) было установлено, что это вещество и есть нитроацетонитрил.
Далее Шолль, получив монофенилглиоксимпероксид

пытался заменить в нем водород металлом. Это ему не удалось, так же как не удалось получить фульминаты окислением глиоксима и его солей. Этим была доказана невозможность существования гремучей кислоты в форме перекиси глиоксима.
Исследуя процесс получения формоксима Н2С=NOH и его свойства Шолль пытался получить формоксим и из гремучей кислоты путем восстановления, что могло бы иметь место, если принять строение последней как производной формоксима. Однако попытка не привела к успешным результатам. Далее Шолль остановился на изучении перехода производных гремучей кислоты в производные циановой кислоты. Он получил из гремучей кислоты ацетилизоциановую кислоту действием хлористого ацетила на гремучую ртуть и пришел. к заключению, что основным ядром в гремучей кислоте должно быть изонитрозосоединение, т. е, карбилоксим CNOH, изомерный циановой кислоте. Шолль показал параллельность явления Бекмановского превращения в отношении гремучей и изоциановой кислот.
По Бекману, оксимы переходят в изомерные амиды:
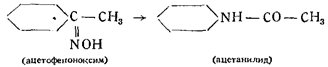
По Шоллю, то же самое происходит и в случае гремучей и изоциановой кислот:
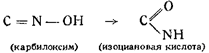
Таким образом Шолль первым разрешил в принципе вопрос о строении гремучей кислоты, но он не мог довести до конца своих рассуждений, а тем более заявить категорически о гремучей кислоте, как о простейшем карбилоксиме, ибо по тем временам мысль о двухвалентном углероде была бы слишком смелой. Наконец, работы и выводы американского химика Нефа (1894 г.) внесли ясность в последний вопрос; он окончательно установилдля гремучей кислоты формулу простейшего карбилоксима: CNOH. В пользу этого строения говорят следующие факты:
1. Гремучая ртуть образуется из aci-нитрометаннатрия действием хлорной ртути. Этим синтезом Неф объяснил казавшееся непонятным образование гремучей кислоты из этилового спирта и азотной кислоты;

Нитрометаннатрий и хлорная ртуть в водном растворе дают хлористый натрий и желтую aci-нитрометанртуть, которая при нагревании частично переходит в гремучую ртуть с отщеплением Воды/
2. Еще легче образуется гремучее серебро из серебряной соли ме-тилнитроловой кислоты с отщеплением азотистой кислоты:
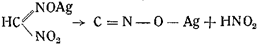
3. Так же легко образуется гремучее серебро из амидометилнитрозоловой кислоты в присутствии азотнокислого серебра в азотнокислом растворе:
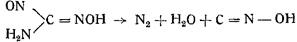
Виланд наблюдал изомеризацию формой итрилоксида в гремучую кислоту:

Собственно этим явлением правильнее было бы ооъяснить реакцию, показанную в п. 2. Метилнитроловая кислота расщепляется на азотистую кислоту и на некоторое весьма реакционноспособное соединение (HONC)x, занимающее по своим свойствам промежуточное положение между гремучей кислотой и изоциановой:
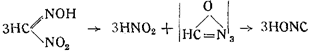
Это соединение принадлежит к полимерному ряду, но показывает все реакции простого формонитрилоксида, так же как триоксиметилен и формальдегид. Виланд назвал его трифульмином и дал ему формулу:
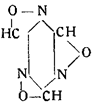
Трифульмин, отличающийся сильными взрывчатыми свойствами, под действием минеральных кислот переходит в гремучую кислоту.
4. Образование формилхлоридоксима из свободной гремучей кислоты и хлористого водорода. Неф показал, что при действии на фульминаты разбавленной соляной кислотой свободная гремучая кислота не выделяется, но что, будучи вытеснена из ее солей, она присоединяет к себе молекулу хлористого водорода и переходит в кристаллический хлорид:

То же самое получил и Шолль независимо от Нефа. Ему также удалось выделить формилхлоридоксим, но он рассматривал это соединение, как солеобраэное производное гремучей кислоты и не придал ему никакого значения. В чистом виде формилхлоридоксим был получен из раствора фульмината натрия при приливании соляной кислоты уд. веса 1,183 при 15°. Смесь сильно охлаждали, выделившийся хлористый натрий быстро отфильтровывали, а растворобрабатывали эфиром. По испарении высушенного хлористым кальцием эфира выделялись длинные иглы формилхлоридоксима.
Формилхлоридоксим, или гидроксаловая кислота, легко гидролизует с образованием муравьиной кислоты и хлористоводо родного гидроксиламина:
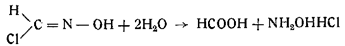
Одновременно Неф открыл обратное превращение формилхлоридоксима в гремучее серебро и хлористое серебро при действии азотнокислого серебра:
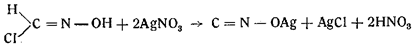
Шолль получил в таких же условиях гремучую ртуть.
5. Целый ряд реакций присоединения аналогичен реакциям присоединения изонитрилов, например:
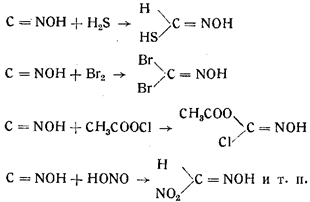
Попытки поколебать уверенность в формуле строения гремучей кислоты, данной Нефом, производились неоднократно.
Так, в 1899 г. Лей и Киссель, определяя электропроводность растворов различных ртутных соединений, в том числе и гремучей ртути, по способу Кольрауша, измененному Оствальдом, установили, что молярная электропроводность раствора гремучей ртути оказалась µ = 0,7 • 10-7, т. е. что она мало отличается от электропроводности чистой поды, равной 1,3•10-10, и, следовательно, подобна электропроводности цианистой ртути Hg(CN)2. Отсюда Лей и Киссель сделали вывод, что в гремучей ртути ртуть соединена не с кислородом, а с углеродом или азотом, и что поэтому формулу Нефа следует заменить одной из следующих формул:

Основываясь на этих исследованиях, Солонина также считал формулу Нефа мало вероятной.
Следует отметить, что так как растворимость гремучей ртути при обыкновенной температуре очень мала, то Лей и Киссель работали при незначительных концентрациях.
В то же время Лей и Киссель установили, что приведенные ими формулы не могут быть приписаны натриевой соли гремучей кислоты. Строение фульмината натрия, по их мнению, иное. Так как эта соль а воде растворима и дмссоциирована в растворе, то образование из нее формилхлоридоксима еще не может служить предпосылкой для решения вопроса о строении гремучей кислоты.
Григорович для исследования вопроса о применимости формулы строения Нефа действовал на гремучую ртуть меркурдиэтилом, а так как последний к гремучей ртути не присоединяется, то он решил, что гремучей кислоте нельзя приписать формулу строения Нефа, и счел возможным рекомендовать следующие формулы:
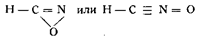
Jowitschitsch на основании опытных данных пытался доказать правильность формулы Голлемана. Он действовал на гипероксидэфир диизонитрозоянтарной кислоты сначала крепкой серной кислотой, а затем раствором едкого натра (1 : 10) и получил гипероксидкарбоновую кислоту:
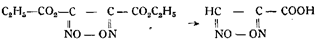
При действии более крепкого раствора едкого натра (1 : 5) он получил после нейтрализации азотной кислотой, извлечения эфиром и вторичной нейтрализации щелочью продукт, который после взаимодействия с азотнокислым серебром давал светложелтый взрывчатый осадок, чувствительный к пламени и трению и дающий при нагревании с азотной кислотой гидроксиламин. Jowitschitsch принял его вначале за глиоксимгипероксид серебра
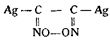
и счел аналогичным гремучему серебру.
Солонина, критикуя предложенные в разное время формулы строения гремучей кислоты, делает вывод, что едва ли можно выразить строение гремучей кислоты одной формулой для объяснения всех свойств грсмучекислых солей и что оно должно быть выражено несколькими формулами, вероятнее всего, следующими тремя:

Вес эти попытки опровергнуть формулу Нефа базируются на недостаточно точных опытах или только па экспериментально недоказанных предположениях.
Хотя Нефом и его последователями и был решен вопрос о гремучей кислоте как карбилоксиме, однако, следует заметить, что на основании только химических реакций еще нельзя утверждать, мономерный или димерный карбилоксим является гремучей кислотой. Окончательно решил этот вопрос Велер, который определил молекулярный вес полученного им безводного фульмината натрия и установилдля него формулу: CNONa (мономсрный карбилоксим),
Таким образом гремучей ртути должна быть приписана структурная формула по Нефу

Свободная гремучая кислота была получена только в водных растворах при низкой температуре. Раствор свободной гремучей кислоты был получен Шольвиндом, обработкой фульмината натрия разбавленной серной кислотой. Изолировать свободную гремучую кислоту нс удалось, так как она оказалась неустойчивой. Даже в эфирном растворе она сохраняется не более 10 мин., а затем превращается (полимеризуясь) в т-фульминуровую кислоту (оксимизонитрозоизоксазолон):

Раствор гремучей кислоты обладает резким запахом. Пары ее весьма ядовиты.
ХИМИЗМ ПОЛУЧЕНИЯ ГРЕМУЧЕЙ РТУТИ
Гремучая ртуть получается действием азотнокислого раствора ртути на этиловый алкоголь. Реакция образования гремучей ртути настолько своеобразна и протекает столь бурно и быстро, что исследователи долгое время (более 100 лет) не могли познать ее истинного хода,так как не удавалось установить ни одной промежуточной стадии этого процесса. Шишков первым попытался показать механизм образования гремучей ртути. Однако ни эта попытка, ни последовавшие затем попытки Голлемана, Шолля и Штейнера не привели к положительным результатам. Лишь после того, когда был обнаружен распад метилнитриловой кислоты на гремучую и азотистую кислоты, а также после обнаружения, что для реакции пригоден именно этиловый спирт, а не метиловый, и что ацетальдегид даст при реакции гремучую ртуть легче, чем этиловый спирт, — были найдены основные звенья и появилась возможность объяснить ход процесса образования гремучей ртути. В 1909 г. Виланд на основании своих многочисленных работ объяснил весь сложный процесс реакции но отдельным стадиям. Ход реакций представляется ныне в следующем виде:
1. Вначале происходит окисление этилового алкоголя в ацетальдегид (его запах всегда чувствуется при получении гремучей ртути):
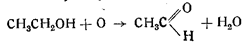
2. Далее идет реакция нитрозирования ацетальдегида в изони-трозоацетальдегид:

Кстати, существование этих двух фаз реакции предполагал несколько ранее и Велер.
3. Затем происходит окисление изонитрозоацетальдегида в изони-трозоуксусную кислоту:
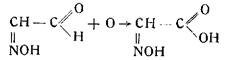
4. Изонитрозоуксусная кислота нитруется азотной кислотой в нитроизонитрозоуксусную кислоту:
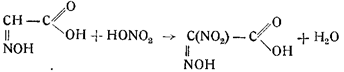
5. Нитроизонитрозоуксусная кислота — соединение весьма нестойкое и переходит с выделением углекислоты в метилнитроловую кислоту;
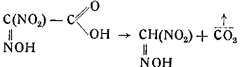
6. Метилнитроловая кислота диссоциирует на гремучую кислоту и азотистую кислоту:
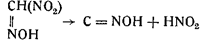
Если последнюю фазу вести в присутствии ртутной или серебряной азотнокислых солей, то вместо легко разлагающейся гремучей кислоты образуется стойкая гремучая ртуть или гремучее серебро:

По этой схеме азотистая кислота оказывается весьма активным агентом в процессе образования фульмината. Образуется же она во время реакции (фазы I и III) непрерывно из имеющейся в избытке азотной кислоты. Необходимость присутствия азотистой кислоты (теоретически даже в незначительных количествах), для того чтобы вызвать реакцию, подтверждается тем, что прокипяченная азотная кислота, свободная от окислов азота, ни со спиртом, ни с уксусным альдегидом гремучей кислоты не образует. Это положение в свое время высказывали еще Зельми, Собреро и Жерар, а опыты Велера иТеодоровича его окончательно подтвердилиРеакция образования гремучей ртути протекает весьма бурно с выделением тепла, вполне достаточного для разогрева и кипения спирта и азотной кислоты. Выделение кристаллов гремучей ртути сопровождается выбрасыванием густых, белых взрывчатых паров, состоящих, главным образом, из этилнитрита и этилнитрата с примесью большого количества ацетальдегида и угольной кислоты. Кроме того, выделяются глиоксаль, глиоксалевая кислота, щавелевая кислота и другие продукты окисления спирта.
Главнейшие побочные реакции следующие:
1) образование этилнитрита:
CH3CH2OH + HONO = CH3CH2ONO + H2O
2) образование этилнитрата:
СН3СН2ОН + HONO2 = СНзСН2ОNO2+Н2О
3) образование щавелевой кислоты:
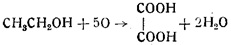
4) образование муравьиной кислоты:
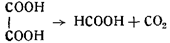
5) образование этилового эфира муравьиной кислоты:
НСООН+С2Н5ОН = НСООС2H5+Н2О
6) образование окиси углерода:
HCOOH = CO + H2O
и др.
Для получения гремучей ртути пользуются в лабораториях и в технике старым способом, установленным еще Либихом и лишь несколько измененным другими исследователями.
По Либиху, 1 в. ч. металлической ртути растворяют в 12 в. ч. азотной кислоты уд. веса 1,36—1,40. Затем в два приема к раствору приливают 11—12 в. ч. обыкновенного спирта. Вторую половину спирта приливают постепенно только после начала кипения раствора.
В 1886 г. Бекман несколько изменил способ Либиха. Он предложил растворять 50 г (1 в. ч.) металлической ртути в 600 г (12 в. ч.) азотной кислоты уд. веса 1,40 и приливать 550 г (11 в. ч.) спирта крепостью 98,5% также в два приема. Спирт и раствор ртути в азотной кислоте он рекомендовал подогревать до температуры 25—30°. Вторую половину спирта Бекман постепенно вводил после перехода
цвета раствора из светложелтого в красноватый, Лобри де-Брюен не без основания находит способы Либиха и Бекмана довольно опасными, так как после приливания первой половины спирта происходит очень бурная реакция с выделением бурых паров (окислы азота). Вследствие этого смесь может разбрызгиваться, а температура поднимается настолько высоко, что если во-время не подливать второй половины спирта, может получиться взрыв.
Лобри де-Брюен рекомендует приливать раствор ртути к спирту, а не наоборот. В этом случае реакция идет спокойнее, и можно вести ее с 300—400 г металлической ртути сразу. Он также расходовал на 1 в. ч. металлической ртути 12 в. ч. азотной кислоты (уд. веса 1,34). Раствор ртути он нагревал до 70° и приливал его к 10 в. ч. 90%-ного спирта.
Шанделон предлагает следующий режим: 1 в. ч. металлической ртути растворить в 10 в. ч. азотной кислоты (уд- вес 1,4). Раствор нагреть до 54° и выливать тонкой струёй в 8,3 в. ч. 91%-ного -спирта.
Кроме этих способов получения металлических производных гремучей кислоты из спирта и азотной кислоты следует отметить уже описанные нами выше синтезы Нефа (из нитрометаннатрия) и Шолля из формилхлоридоксима под действием азотнокислой ртути). Следуя методу Нефа, Джонс получил количественно гремучую ртуть, действуя разбавленной соляной кислотой на основную ртутную соль нитрометана, а Биддль показал, что хлорид ацетилформилоксима при длительном стоянии в водном растворе азотнокислого серебра превращается в гремучее серебро, хлористое серебро и уксусную кислоту:

В 1901 г. Ф. Анжелико доказал, что можно очень легко получить гремучую ртуть из малоновой кислоты, если к раствору ртути в разбавленной азотной кислоте приливать концентрированный водный раствор малоновой кислоты и несколько капель азотистонатриевой соли. Осаждается гремучая ртуть при бурном выделении двуокиси углерода и повышении температуры. Анжелико объясняет эту реакцию тем, что из малоновой кислоты СН2(СООН)2 получается вначале изонитрозомалоновая кислота С(NОН)(СООН)2, которая переходит в изонитромалоновую C(NOOH)(COOH)2, а последняя, отщепляя угольный ангидрид, дает изонитроуксусную кислоту CH(NOOH)(COOH), которая, выделяя вторую молекулу угольного ангидрида, образует изонитрометан CH2=NООН и далее гремучую кислоту.
Однако Г. Понцио указывает, что этот процесс протекает иначе, а именно, через изонитрозомалоновую кислоту, изонитроуксусную кислоту и метилнитроловую кислоту:

Следует привести также предложенный Г. Виландом способ, основанный на разложении амидометилнитрозоловой кислоты. Схема получения самой кислоты следующая:

Метиловый спирт с азотной кислотой не образует гремучей кислоты. Это было замечено еще Дюма и Пелиготом, а затем Шталь-шмидтом, получившим, кстати сказать, гремучую ртуть из лигнона. Все попытки многих исследователей получить гремучую ртуть из монокарбоновых соединений не привели к цели.
Велер и Теодорович показали, что можно получить гремучую ртуть окислением азотной кислотой целого ряда органических веществ, содержащих метильную группу — СНц в соединении с одной из следующих четырех групп:

в присутствии окислов азота и азотнокислой ртути. Им удалось получить гремучую ртуть из диметилацеталя, из лигнона, содержащего кроме диметилацеталя метиловый спирт, метилацетат и ацетон, а также из диэтилацеталя, ацетальдегида, паральдегида и метальдегида.
Следует, конечно, отметить, что все новые синтетические методы, предлагавшиеся Нефом, Велером, Виландом и др., очень дороги или дают малый выход продукта.
ПРИМЕСИ ГРЕМУЧЕЙ РТУТИ
Гремучая ртуть может образоваться в двух модификациях: белой и серой. Вопрос о разнице в цвете долгое время оставался и остается еще до сих пор спорным. По этому вопросу существуют различные точки зрения.
Каст пишет на основании не из отдельных кристаллов, а из сросшихся в продольном своих исследований: «Так называемая «серая» гремучая ртуть, приготовленная без добавления соляной кислоты, имеет слабокоричневую окраску и состоит из правильно образовавшихся прозрачных и светлых кристаллов. Углы, образуемые двумя смежными ребрами кристалла, были измерены Риттером в 126° и 53,5°. Поэтому кристаллы относятся К моноклинической системе. Продукт считается весьма чистым, если он содержит 99,7—99,9% растворимой в соляной кислоте ртутной соли и растворяется в водном аммиаке со слабым помутнением. Нерастворимый в соляной кислоте остаток на фильтре окрашивается аммиаком в весьма слабый серый цвет и состоит, вероятно, из хлористой ртути от некондиционных сырых материалов».
«Так называемый белый продукт имеет почти чисто белый цвет с весьма слабым серым оттенком и состоит направлении кристаллических систем. Вследствие своего сращивания кристаллы непрозрачны и очень сильно отражают свет, почему они и кажутся белыми. Продукт менее чист, чем серый, содержит 99,3—99,4% растворимых в соляной кислоте солей ртути и растворяется в водном аммиаке с образованием темного осадка. Нерастворимый в соляной кислоте остаток (0,6—0,7%) на фильтре с аммиаком окрашивается в немного более темный цвет, чем осадок серой гремучей ртути».
Таким образом Каст считает, что различная окраска гремучей ртути зависит, главным образом, от физических причин, т. е. объясняется более или менее сильным преломлением света, с одной стороны, и величиной кристаллов, с другой.
Такое объяснение цветности гремучей ртути не выдерживает критики, тем более, что разница в величине кристаллов белой и серой гремучей ртути невелика и что даже путем перекристаллизации из аммиака можно получить еще большие кристаллы совершенно белого цвета. Лучепреломление кристаллов белого и серого цвета, как установил Вертман, одинаково.
Другие исследователи объясняют причину серого цвета примесями, но и здесь отсутствует единое мнение, так как даже вопрос о количестве примесей еще является спорным. О том, что белая гремучая ртуть загрязнена более, чем серая, наряду с Кастом указывает в своих исследованиях и Филипп. Однако микроскопические исследования кристаллов гремучей ртути показывают, что такое утверждение неверно: чистота того и другого продукта примерно одинакова.
Часть исследователей (И. Чельцов, Бертло и Вьель, Велер и др.) видят причину образования серой гремучей ртути в наличии примеси металлической ртути, которая в коллоидальном состоянии пронизывает кристаллы и легко распознается под микроскопом, особенно если гремучую ртуть ввести в бензол или в канадский бальзам, так как тогда кристаллы становятся прозрачными с высоким показателем преломления. Точно так же при растворении гремучей ртути в тиосульфате натрия остаются нерастворимыми шарики металлической ртути.
Это показывает следующая таблица, составленная по опытам Солонина, Велера и Теодоровича.
|
| Примеси
| Цвет гремучей ртути
| |
| к спирту | к азотнокислому раствору ртути | ||
| 1. | CuCl2 – 0.8 г | -- | Белый |
| 2. | Cu2Cl2 – 1 г | -- | Белый с незначительным сероватым оттенком |
| 3. | Cu2Cl2 – 1.5 г | -- | Белый |
| 4. | Cu2Cl2 – 2 г | -- | Белый |
| 5. | -- | Cu2Cl2 – 0.8 г | Белый |
| 6. | -- | Cu2Cl2 – 1.3 г | Светлее, чем в опыте 15 (без примесей) |
| 7. | Cu(NO3)2 – 3.8 г | -- | Цвет как без добавки в опыте 15 |
| 8. | CuSO4 × 5H2O – 5 г | -- | Темнее, чем в опыте 15 |
| 9. | -- | 0.5 г HCl (15°Be) + 0.5 г Cu | Белый |
| 10. | -- | HCl (15°Be) – 1 мл | Чисто белый |
| 11. | HCl (15°Be) – 1 мл | -- | Чисто белый |
| 12. | HCl (15°Be) – 1 мл | -- | Чисто белый |
| 13. | -- | NaCl – 1 г | Серый, светлее, чем в 15 опыте |
| 14. | -- | BaCl2 × H2O – 1 г | Белый, как в опыте 2 |
| 15. | Без примесей | Серый | |
Примечание. Опыты производились со следующей рецептурой: металлической ртути .......... 50 г
азотной кислоты (d=1,38) ...... 450 »
спирта (96%-ного) ........... 500 »
Если тщательно присмотреться к условиям реакции, то можно заметить, что серая гремучая ртуть с содержанием металлической ртути получается в том случае, если процесс ее изготовления был ненормален. Если реакция образования протекает слишком медленно вследствие большой теплоотдачи или применения холодных исходных материалов, то получается серая гремучая ртуть с содержанием металлической ртути. Объяснять цветность, базируясь на испытаниях такой гремучей ртути, конечно, нельзя. Если же процесс образования гремучей ртути протекает достаточно бурно, то образующийся серый продукт всегда свободен от металлической ртути.
Пробой на амальгамирование золотой пластинки можно установить даже в так называемой чистой гремучей ртути независимо от ее цветности наличие следов ртути. Однако это, как увидим ниже, не металлическая ртуть, а ртутные соединения, отличные от гремучей ртути.
Опыт показывает, что можно получить как серую, так и белую гремучую ртуть с одним и тем же содержанием металлической ртути.
Больше того, можно получить серую гремучую ртуть и с меньшим содержанием металлической ртути. Следовательно, наличие металлической ртути не является причиной окраски гремучей ртути.
Другая часть исследователей утверждает, что в процессе получения гремучей ртути образуется много распыленных органических примесей, которые, попадая в кристаллы гремучей ртути, придают ей серый цвет. При введении же даже ничтожного количества связанного хлора (на 400 г металлической ртути 5 мл НС1 и 5 г меди или соответствующее количество полухлористой меди) гремучая ртуть получается белой. Его действие сводится, видимо, к отбеливанию этих органических примесей.
Даней показал, что белая гремучая ртуть может быть получена в присутствии малых количеств других медных солей и при полном отсутствии галоидов. Так, при прибавлении при 50° к смеси, состоящей из 25 ч. 95°-ного спирта и раствора 2,5 ч. ртути в 25 ч. HNO3 (уд. вес 1,4) и 0,05 ч. меди (в виде нитрата) получается белая гремучая ртуть. Выходы изменяются в зависимости от количества нитрата меди. Приведенная ниже таблица показывает, что вначале выходы остаются постоянными, затем при прибавлении цитрата меди более 0,7 г они уменьшаются; дальнейшее прибавление нитрата, например до 3,5 г, приводит к повышению выхода гремучей ртути, но последняя становится загрязненной оксалатом меди.
| Количество меди в виде нитрата | Выход фульмината, г | Цвет | Содержание фульмината, % |
| 0,00 0,05 0,50 0,65 0,70 0,75 0,80 2,00 3,50 | 3,05 3,00 3,03 3,06 2,98 2,60 2,55 2,70 3,40 | Серый Белый Белый Белый Белый Белый Белый Белый Белый, загрязненный оксалатом меди | 98 – 98,8 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 |
При замене нитрата меди нитратами никеля, цинка или кобальта получается не чисто белый продукт, а более или менее темный.
Предполагают, что медь не образует промежуточного соединения в виде фульмината меди, а только участвует в предшествующей стадии образования гремучей кислоты, В самом деле, если подействовать 0,4 г фульмината меди на 1 г ртути, растворенной в минимальном количестве азотной кислоты, то получается 0,074 г серой нечистой (93%-ной) гремучей ртути.
Повидимому, наиболее верным является широко распространенный взгляд, что серая окраска получается вследствие частичного образования смолистых полимеризованных продуктов бурого цвета, похожих на азульмовую кислоту. В пользу этого говорит и то, что условия реакции вполне подходящи для осмоления-Например, раствор 5 г азотнокислой ртути в 25 мл азотной кислоты (уд. веса 1,4) окрашивается в бурый цвет при нагревании до 70—80° с 20 мл ацетальдегида, а через некоторое время на стенках сосуда оседает бурое смолистое вещество.
Продукты осмоления также образуются в процессе получения гремучей ртути из ацетальдегида или изонитрозоацетальдегида, являющихся, как известно, промежуточными продуктами.
Кроме этих продуктов полимеризации и металлической ртути в технической гремучей ртути находятся и другие примеси. Если на гремучую ртуть подействовать цианистым калием, аммиаком или пиридином, то главная масса перейдет в раствор и при этом всегда останется темный остаток, содержащий ртуть. Нельзя, однако, утверждать, что этот остаток состоит только из металлической ртути. Качественные исследования, произведенные А. А. Солонина, показали, что в нем содержится и азот и углерод. Отсюда следует, что, повидимому, это какое-то непрочное органическое соединение, легко разлагающееся при нагревании с выделением металлической ртути.
Известно также, что аммиак и цианистый калий действуют на закисные соединения ртути с образованием металлической ртути. Хлористая закисная ртуть дает с аммиаком хлористый меркураммоний с выделением металлической ртути:
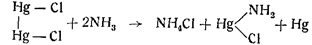
Аммиак при действии на азотнокислую закисную ртуть дает черный осадок меркураммониевой соли и металлической ртути:
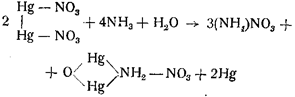
Цианистый калий при действии на закисную азотнокислую ртуть осаждает металлическую ртуть с образованием растворимой цианистой ртути:
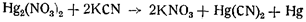
Повидимому, остаток от гремучей ртути после растворения ее в пиридине, аммиаке и цианистом калии является следствием разложения каких-то закисных соединений ртути, являющихся спутниками гремучей ртути.
Если получать гремучую ртуть, пользуясь вместо спирта паральдегидом, то, прежде чем начинают образовываться кристаллы гремучей ртути, возникает осадок бесцветных листочков. Анализ этих листочков, отфильтрованных тотчас после их образования, показал наличие основного нитрата ртути:
Hg4(N03)3OH
Вполне вероятно, что незначительное количество этой основной соли получается и при изготовлении гремучей ртути обычным путем, так как гремучая ртуть всегда содержит следы ионов N0'3.
Если растворить 5 г ртути в 36 мл очищенной от окислов азотной кислоты (уд. веса 1,4) и затем короткое время нагревать при 70° в 50 мл спирта, то образуется соль Купера:

представляющая собой продукт [реакции основного нитрата ртути с ацетальдегидом.
Не исключена возможность наличия и этого соединения в числе примесей гремучей ртути, тем более, что концентрация отдельных компонентов, при которых происходит образование соли Купера, примерно соответствует (за исключением окислов азота) концентрации тех же компонентов при получении гремучей ртути.
Применение для получения белого продукта полухлористой меди или меди и соляной кислоты влечет за собой, конечно, образование, хотя и в незначительном количестве, хлорида окисной ртути.
Дальнейшим источником загрязнений является маточный раствор, остающийся в кристаллах гремучей ртути. Исследования кристаллов под микроскопом в бромбензоле или канадском бальзаме показывают, что внутри кристаллов параллельно краям расположены ряды маленьких пузырьков, в которых находится жидкость. Ратсбург определил потерю в весе гремучей ртути при продолжительном вылеживании. Он в течение полугода нагревал серую и перекристаллизованную из аммиака гремучую ртуть при 50—60° и нашел, что убыль в весе серой гремучей ртути составила 3,7%, а перекристаллизованного продукта — только 0,2%.
Бергман наблюдал процесс растворения гремучей ртути в аммиаке и тиосульфате натрия под микроскопом. В результате он установил, что те места кристаллов, в которых находятся пузырьки раствора, растворяются быстрее.
Наконец, примесью гремучей ртути является также оксалат ртути. Правда, если процесс образования гремучей ртути протекает вполне нормально, то примеси оксалата не будет (об этом см. ниже). Оксалат ртути образуется при неправильно ведомом процессе и в результате долгого стояния готового продукта в маточном растворе.
Побочные и промежуточные. Продукты процесса образования гремучей ртути остаются только в незначительных количествах. Основными примесями являются, невидимому, маточные включения и продукты их взаимодействия с гремучей ртутью в период хранения.
Содержание чистой гремучей ртути, получаемой как в заводских, так и в лабораторных условиях, колеблется в пределах 98—99%.
Наиболее нежелательными примесями гремучей ртути являются следующие:

Рисунок 44 – Белая гремучая ртуть
1) металлическая ртуть и закисные ее соединения, которые, находясь в соприкосновении с медью в снаряженных капсюлях, взаимодействуют с металлом, образуют амальгаму меди и делают металл хрупким;
2) маточные включения (кислотность), которые могут разлагать составы, изготовленные с гремучей ртутью, и разъедать оболочку;
3) случайно попавшие нерастворимые посторонние примеси (песок и т. п.), повышающие чувствительность к внешним воздействиям и вызывающие опасность в обращении с сухой гремучей ртутью при снаряжении.
Дата добавления: 2021-03-18; просмотров: 122; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
