ПРАКТИЧЕСКАЯ РАБОТА: СОСТАВИТЬ КОНСПЕКТ ЛЕКЦИИ И МЕТОДИКИ КАРБОНАТНОЙ ЖЕСТКОСТИ ВОДЫ
ТЕМА ЗАНЯТИЯ
«ОПРЕДЕЛЕНИЕ ГИДРОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПРОБ ВОДЫ»
Значение воды на нашей планете огромно. Воды рек, ручьев, пропитывая всю поверхность суши, размывают и переносят громадные объёмы горных пород, изменяя облик Земли. Вода - непременное условие проявления жизни; в ней развились первые живые организмы; она входит в состав всех живых существ на Земле, поэтому без воды не может существовать ни один из их видов. Велико значение воды и в повседневной практической деятельности человека. Важная роль воды всецело связана с её способностью растворять различные вещества, встречающиеся в природе, и образовывать сложные растворы солей, газов и органических веществ с разными свойствами. Перенос растворенных водой веществ ведет к образованию отложений в морях и бессточных бассейнах, способствует перераспределению солей на поверхности Земли. Всё многообразие почв, их плодородие обязано процессам взаимодействия почв с водными растворами. От состава воды зависят и многие её физические свойства: температура замерзания, величина испарения, цвет, прозрачность и характер протекающих в ней химических процессов. Жизнь настоятельно требует от нас бережного отношения к уникальному веществу природы – воде.
В России начало изучения Гидрохимия связано с работами М. В. Ломоносова и т. н. академическими экспедициями 18 в. В настоящее время изучение химического состава воды ведётся в различных научных и высших учебных заведениях, в лабораториях предприятий промышленности и транспорта, в санитарных и гигиенических учреждениях и инспекциях, в лабораториях системы водоснабжения. Особенно важны стационарные гидрохимические работы, проводимые на станциях (морских, речных, озёрных) гидрометеорологической сети Гидрометслужбы. В СССР издано большое число научных работ по Гидрохимии существует постоянный печатный орган "Гидрохимические материалы" (с 1915); в 1921 создан единственный в мире Научно-исследовательский институт гидрохимии, в соответствующих вузах читается курс Гидрохимии. На современном этапе развития Гидрохимию можно различать следующие её разделы: Формирование химического состава природных вод. Этот раздел включает изучение воды как растворителя сложного комплекса минералов земной коры и исследование химических процессов, происходящих в воде при взаимодействии с породами, почвами, организмами и атмосферой. Рассматривается растворимость веществ, встречающихся в природе, их состояние в растворе и стабильность, а также сорбционные, обменные, окислительно-восстановительные процессы и многие др. К этому разделу, весьма близкому геохимии, следует отнести общие вопросы круговорота веществ и вопросы миграции элементов в гидросфере.
|
|
|
Химический состав и гидрохимический режим определённых видов природных вод, зависимость их изменений от физико-географических условий окружающей среды.
|
|
|
Этот обширный раздел близко примыкает к гидрологии, и его частями являются химия рек и озёр, химия моря, химия подземных и атмосферных вод.
Химия поверхностных вод изучает химический состав воды в реках, озёрах, искусств водоёмах, его изменения по территории или акватории и по глубинам, сезонные суточные колебания, а также условия формирования состава в зависимости от окружающей среды. Большое значение приобретает прогнозирование химического состава водохранилищ, создаваемых в засушливых областях и борьба с загрязнениями, вносимыми в водоёмы.
Исследования соляных озёр, богатых минеральным сырьём, очень важны для химической промышленности.
Химия моря, тесно примыкающая к океанологии, наряду с изучением солёности, биогенных веществ и растворённых газов в зависимости от гидродинамических, гидрометеорологических и гидробиологических факторов, изучает формы и содержание микроэлементов, генезис и процессы метаморфизации органических веществ, процессы взаимодействия морской воды с речной и морскими донными осадками и пр.
|
|
|
Химия подземных вод включает изучение химического состава грунтовых, пластовых, артезианских, минеральных вод и вод нефтяных месторождений
. Важнейшие направления здесь - формирование состава вод, процессы взаимодействия воды с окружающими породами, происходящие под высокими давлениями и часто повышенными температурами при замедленном водообмене и своеобразных микробиологических условиях. Большое значение издавна имеет изучение минеральных вод, весьма разнообразных по составу и происхождению.
В число основных гидрохимических показателей качества воды входят: водородный показатель (рН), растворенный кислород, минерализация (анионы – карбонаты, гидрокарбонаты, сульфаты, хлориды; и катионы – кальций, магний, натрий и калий), сухой остаток, общая жесткость, биогенные элементы (нитраты, фосфаты, аммоний, нитриты), фториды, железо общее. Количественные данные по этим показателям занимают значительное место в совокупности данных о состоянии водного объекта и могут быть определены без серьезных трудностей полевыми и лабораторными методами, при соблюдении правил отбора и хранения проб.
|
|
|
Определение карбонатной жесткости воды
Карбонатная жесткость обусловлена присутствием в растворе растворимых гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Определенный объем водопроводной воды титруют стандартизированным раствором хлороводородной кислоты в присутствии метилового оранжевого.
Определение основано на реакции: HCO3- + H+ = H2CO3
Реактивы: хлороводородная кислота, стандартизированный раствор; раствор индикатора метилового оранжевого.
Методика. С помощью цилиндра отбирают 100 мл водопроводной воды в колбу для титрования вместимостью 250 мл. Добавляют 2 капли метилового оранжевого и титруют раствором хлороводородной кислоты из бюретки до изменения окраски раствора из желтой в золотисто-оранжевую.
Результаты титрования:
Ориентировочное титрование с точностью до 1 мл:
| V(HCl), мл | ||||||||
| Цвет раствора | желт. |
Вывод по результатам ориентировочного титрования: точка эквивалентности между ____ и ____ мл
Результаты точного титрования: V1 = ________ мл
V2 = ________ мл
V3 = ________ мл
Средний объем 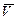 (HCl) =
(HCl) = 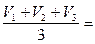 = _________ мл
= _________ мл
Расчет. Жесткость воды измеряется в ммоль/л и рассчитывается по формуле:
Ж = 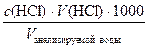 1000 = = _________ммоль/л
1000 = = _________ммоль/л
Вывод: Ж(H2О) = __________ммоль/л
ПРАКТИЧЕСКАЯ РАБОТА: СОСТАВИТЬ КОНСПЕКТ ЛЕКЦИИ И МЕТОДИКИ КАРБОНАТНОЙ ЖЕСТКОСТИ ВОДЫ
Дата добавления: 2021-02-10; просмотров: 109; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
