Применение альгиновой кислоты и альгинатов
В настоящее время известно значительное число альгинатов, но наиболее широко используются альгинаты натрия, кальция, калия, аммония, а в специальных целях–альгинаты цинка, меди, натрий–кальциевые и аммонийно–кальциевые. Также применяются и другие производные альгиновых кислот.
Общий объем мирового производства альгинатов составляет около 40 тыс. тонн в год. Главные производители – США, Китай, Норвегия, Франция. В пищевой промышленности используется 30 % ежегодно выпускаемых альгинатов, 50 %–в текстильной, остальные в медицине, косметике, фармации. Основные применения альгиновой кислоты и альгинатов представлены в таблице 1.
Таблица 1
Основные применения альгиновой кислоты и альгинатов
| Отрасль | Применение |
| Текстильная промышленность | В качестве замены крахмала, увеличивающего вязкость красок при печатании на тканях |
| Целлюлозно–бумажная промышленность | Для отделки бумаги |
| Пищевая промышленность | Загустители, стабилизаторы, эмульгаторы–добавка при приготовлении мороженого, соусов, приправ, кетчупов, майонезов, маргарина, молочных коктейлей, фруктовых соков |
| Повышение устойчивости и однородности кремовых смесей и сыров | |
| Добавление в тесто. Хлеб, выпеченный из такого теста, отличается высоким удельным объемом, хорошей пористостью, медленнее черствеет | |
| При изготовлении мармеладов и джемов сокращение расхода студнеобразователя и улучшение структурно–пластических свойств продукта | |
| Биотехнология | Кальций–альгинатные гели применяют при создании иммобилизованных биокатализаторов путем инкапсулирования живых клеток, клеточных органоидов, ферментов и для получения некоторых моноклональных антител |
| Медицина | На основе альгинатов разработаны медицинские повязки и сухие присыпки–кровоостанавливатели для ускорения заживления ран, ожогов и язв, и препятствия их инфицированию, лекарства для лечения гастрита, язвы желудка и двенадцатиперстной кишки. Из смеси альгината и плазмы крови изготавливают хирургические нити, причем реологические свойства материала этих нитей зависят от содержания в альгинате α, L–гулуроновой кислоты |
| Микробиология | Альгинатами заменяют традиционный агар, что позволяет избежать повышения температуры в ходе разжижения сред при выделении клеток по завершении инкубации. Использование альгинатов в этом случае обусловлено способностью их водных растворов к образованию стабильного геля при добавлении раствора соли кальция. Гель затем разрушают введением хелатирующего агента, вступающего в реакцию комплексообразования с кальцием. |
Альгиновая кислота и ее соли способны избирательно адсорбировать радиоактивные изотопы и тяжелые металлы, поэтому на их основе производят активные и безвредные для организма энтеросорбенты, применяемые в качестве компонентов лечебного и профилактического питания людей, работающих или проживающих в зонах радиоактивного загрязнения или трудящихся на предприятиях горнодобывающей промышленности и цветной металлургии.
Инкапсулированные в альгинат живые клетки могут быть имплантированы в организм человека для лечения некоторых болезней, например, диабета. Они не вызывают иммунных реакций отторжения, поэтому их применение очень эффективно.
В целом направления использования альгинатов в различных отраслях промышленности и медицине определяются физико–химическими свойствами этих соединений, которые зависят от их молекулярной массы и строения – типа катиона и содержания и распределения в цепи полимера звеньев β, D–маннуроновой и α, L–гулуроновой кислот [1].
Характеристика продуцента альгиновой кислоты
Систематика:
Домен: Bacteria
Тип: Proteobacteria
Класс: Gammaproteobacteria
Порядок: Pseudomonadales
Семейство: Pseudomonadaceae
Род: Azotobacter
Вид: Azotobacter vinelandii
Культура представляет собой подвижные, грамотрицательные крупные (2–3 х 0,8–1,0 мм) овальной формы клетки, расположенные в мазках парами или неправильными группами. Культура полиморфна. Большей частью палочковидные клетки с тупыми концами, в стационарной фазе роста–овалообразные, редко–кокковидной формы, с хорошо выраженной капсулой. Эндоспор не образует. Клетки заключены в мощную слизистую капсулу, выявляемую негативным окрашиванием нигрозином. Начиная с первых суток роста, на твердых питательных средах в культуре наблюдаются крупные (до 8–10 мм) инцистированные клетки с плотной оболочкой, к седьмым суткам роста их количество достигает 10–15 % в поле зрения. В старых культурах (5–7 суток) встречаются клетки с почковидными выростами. Цитоплазма однородна, с небольшим количеством зернистых включений. Не погибает при нагревании при 50 °С в течение 15 мин. Цисты неустойчивы к нагреванию свыше 80–100 °C. При выращивании в бульоне Хоттингера (до 3 суток) рост слабый.
Штамм растет на многих натуральных и синтетических средах: агаризованном сусле, средах Эшби, Виноградского, Федорова. Отношение к источникам углерода: очень хорошо усваивает глюкозу, сахарозу, мелассу; хорошо усваивает маннит, мальтозу, ксилозу, галактозу, маннозу, глицерин, фруктозу, этанол; слабо усваивает рамнозу, декстрин, мезоинозитол, лактозу; не усваивает: сорбит, арабинозу. Azotobacter проявляет высокую потребность в органических веществах, поэтому в больших количествах встречается в хорошо удобренных почвах. Слабо растет на МПА.
На агаризованной питательной среде (С–40), культура образует круглые колонии диаметром 3–4 мм, с гладкой блестящей поверхностью, выпуклые, прозрачные, с гладкими краями, мягкой слизистой консистенции. На 24 ч роста клетки – мелкие палочки 0,5–0,7 мкм, слабо подвижные; на 48–72 час – есть цисты.
При росте на среде Эшби колонии на вторые сутки очень маленькие 0,1–0,4 мм в диаметре, позже (4–6 суток) 0,5–3,0 мм, приподнятые, округлые, края ровные, гладкие, маслянисто–блестящие, беловатые, полупрозрачные, сильно ослизненные.
На жидкой питательной среде Федорова с мелассой культура образует круглые колонии диаметром 4 мм, выпуклые, с ровными краями, кремового цвета, слизистой консистенции.
Штамм хранится в лиофильно–высушенном состоянии.
| Рис.3 Azotobacter vinelandii под микроскопом |
| В) – структура капсул клеток A. vinelandii (негативный контраст) |
| А) – вегетативные клетки (2 мкм в диаметре) |
| Б) – цисты (диаметром 3 мкм) |
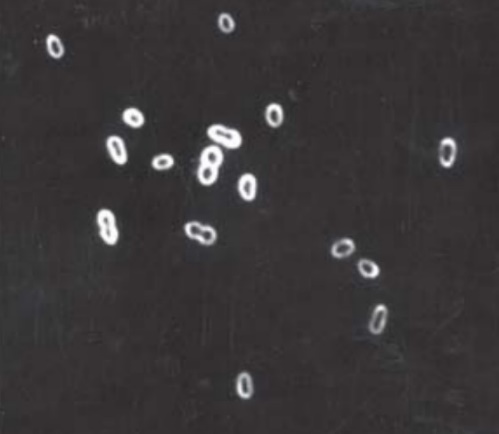
По отношению к температуре, Azotobacter относятся к мезофильным микроорганизмам: оптимальный температурный интервал для роста культуры 28–30 °C. Оптимальное значение рН для роста культуры Azotobacter vinelandii: 6,8–7,0; для синтеза полисахарида: 6,8–7,2 (нейтрофилы) [3].
Все виды Azotobacter строгие аэробы. Чувствительны к содержанию в среде фосфора и развиваются лишь при высоком его содержании в питательной среде. Также необходимым элементом является кальций. Потребность азотобактера в данных элементах столь значительна, что его используют как биологический индикатор на наличие фосфора и кальция в почве. Для энергичной азотфиксации микроорганизмам требуются микроэлементы, из них наиболее важен молибден, который входит в состав ферментов, катализуюших процесс усвоения азота.
Источником азота для них могут служить соли аммония, нитриты, нитраты и аминокислоты. В отсутствие связанных форм азота они фиксируют молекулярный азот и относятся к аминоавтотрофам. Небольшие дозы азотсодержащих соединений не приводят к депрессии фиксации азота, а иногда даже стимулируют ее. Увеличение количества связанного азота в среде полностью подавляет усвоение молекулярного азота. Энергия усвоения азота у отдельных культур азотобактера колеблется в широком диапазоне. Активные культуры связывают 15–20 мг азота на 1 г потребленного органического вещества.
Azotobacter обитает в высокоплодородных, достаточно влажных почвах с нейтральной или близкой к ней реакцией среды. При низкой влажности большинство клеток отмирает. В черноземных, каштановых и сероземных почвах, благоприятных для рассматриваемого микроорганизма, его обнаруживают в значительных количествах только весной. При летнем иссушении почвы остаются единичные клетки. В зоне подзолистых и дерново–подзолистых почв азотобактер можно найти в огородных и пойменных почвах, богатых органическими соединениями, с оптимальным pH 6,8–7,2 [4].
Тип метаболита.
Экзополисахариды бактерий относятся к вторичным метаболитам, они являются продуктами метаболизма, которые образуются впоследствии действия первичных метаболитов-ферментов. Следовательно, условия для выращивания бактерий-продуцентов этих веществ оказывает прямое влияние на количество выделяемого полимера и его свойства.
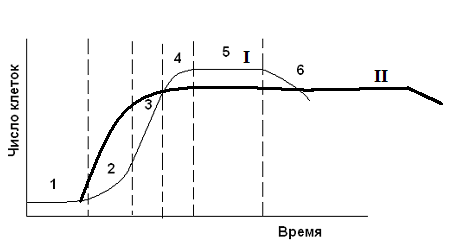
Динамика накопления биомассы A. vinelandii при культивировании в жидкой питательной среде подчиняется известным закономерностям для простых периодических культур: до 24 ч рост идет экспоненциально, затем наблюдается замедление скорости роста, характерное при переходе к стационарной фазе, и к концу ферментации–начало автолиза культуры. Синтез и накопление альгиновой кислоты начинался в фазе стационарного роста и увеличивался по мере лизирования культуры до 60 г/л по сахарозе.
| Рис.4 Сравнительная характеристика кривых роста микроорганизмов. 1-индукционный период; 2- фаза экспоненциального роста; 3- фаза линейного роста; 4- фаза замедления роста; 5- стационарная фаза; 6-фаза отмирания культуры. I – кривая роста микроорганизмов при получении первичных метаболитов, II – кривая роста микроорганизмов при получении вторичных метаболитов. |
Состав питательной среды
Для подготовки посевного материала, поддержания культуры и культивирования используют питательную среду Федорова со следующим составом (г/л): К2НPO4–0.3, СаНPO4–0.2, MgSO4–0.3, K2SO4–0.2, NaCl–0.5, FeCl3–0.01, CaCO3–5.0, меласса–60.0 (источник углерода).
Основные условия культивирования A. vinelandii.
Для синтеза альгинатного полисахарида с максимальной вязкостью при культивировании A. vinelandii на среде с мелассой необходимы следующие условия: содержание мелассы (содержащей не менее 50 % сахарозы) 60 г/л среды, принудительная аэрация и перемешивание, температура – 25 °С. Выход ЭПС в этих условиях к углеродному субстрату при периодическом культивировании доходит до 60 %, в условиях объемно – доливного метода культивирования–до 70%. Культуральная жидкость при данных условиях получается достаточно вязкой [5].
6. Активаторы и ингибиторы процесса [5]
6.1. Влияние источника углерода
Биосинтетическое получение ЭПС обычно осуществляют культивированием микроорганизмов на жидких минеральных средах, используя в качестве источника углерода глюкозу, сахарозу, мальтозу, крахмал. В последнее время для удешевления процесса производства используют непищевые субстраты: этанол, метанол или отход производства сахарной промышленности–мелассу.
В таблице 2 представлена показано влияние источника углеродного питания на вязкость культуральной жидкости. Исходя из данных можно сделать заключение, что культуральной жидкости A . Vinelandii придаетповышенную вязкость использование в качестве источника углерода мелассы.
Таблица 2
Зависимость вязкости культуральной жидкости A . Vinelandii ИБ 1 от природы источника углерода
| Источник углерода | Вязкость культуральной жидкости, сСт |
| Меласса | 630 |
| Сахароза | 55 |
| Крахмал | 45 |
| Мальтоза | 43 |
| Глюкоза | 40 |
| Этанол | 28 |
6.2.Влияние pH и температуры
Таблица 3
Влияние pH и температуры на конечную концентрацию ЭПС
| Параметры культивирования | Конечная концентрация ЭПС г/л | |
| pH | 5,5 | 8,0 |
| 6,0 | 9,5 | |
| 6,5 | 13,1 | |
| 6,8 | 16,1 | |
| 7,2 | 16,0 | |
| 7,5 | 12,5 | |
| Т,оС | 25 | 10,35 |
| 28 | 16,2 | |
| 30 | 16,0 | |
| 35 | 10,7 | |
Исходя из таблицы 3 можно сделать заключение, что для продуцирования альгиновой кислоты с большей конечной концентрацией оптимальный диапазон pН 6,8–7,2, а температуры 28–30 оС.
6.3.Влияние принудительной аэрации и перемешивания
Поскольку бактерии Azotobacter vinelandii являются аэробными азотфиксаторами, то для их роста необходимы условия хорошей аэрации. Электронная микроскопия неокрашенных клеток Azotobacter vinelandii показала, что клетки, культивированные в условиях с повышенным и пониженным содержанием кислорода, образуют капсулы с существенными различиями в толщине и компактности полисахарида.
Данные результаты свидетельствуют о том, что в условиях азотфиксации бактерия формирует альгинатные капсулы с различным составом в зависимости от содержания кислорода. Это объясняет необходимость контроля за содержанием растворенного кислорода в процессе производства альгината. Влияние принудительной аэрации и перемешивания на вязкость культуральной жидкости представлено в таблице 4.
Таблица 4
Влияние принудительной аэрации и перемешивания на вязкость культуральной жидкости A . Vinelandii ИБ 1 (в %–ном соотношении)
| Аэрация объемов воздуха на 1 объем среды в 1 мин | Перемешивание, мин–1 | |||
| 100 | 200 | 300 | 400 | |
| 0,25 | 6 | 12 | 15 | 10 |
| 0,50 | 25 | 60 | 100 | 22 |
| 0,75 | 4 | 6 | 4 | ≤1 |
| 1,00 | 2 | 4 | ≤1 | ≤1 |
Проведенные исследования выявили негативное воздействие на вязкость получаемой культуральной жидкости как низких значений скоростей аэрации и перемешивания (недостаток кислорода), так и их высоких значений (ингибирование роста культуры токсическим действием избытка кислорода). В соответствии с таблицей 4 оптимальными являются следующие показатели: перемешивание–300 мин–1, аэрация–0,5 объема воздуха в 1 мин на 1 объем среды.
6.4.Влияние азота на синтез экзополисахаридов
Было исследовано влияние на синтез экзополисахаридов азота, входящего в состав минеральных (NH4Cl, (NH4)2SO4, NaNO3) и органических соединений. Установлено, что на средах, содержащих азот в форме аммония продуцент проявляет большую биосинтетическую активность, чем на средах с азотом в нитро форме. Внутриклеточная концентрация ионов аммония определяет принцип усвоения связанного неорганического азота у разных бактерий. Это может быть обусловлено различным влиянием восстановленной и окисленной форм азота на углеродный метаболизм. Для большинства продуцентов органические соединения азота наиболее благоприятны для синтеза экзополисахаридов, в связи с тем, что культура сразу включает готовые аминокислоты в углеродный метаболизм, не затрачивая энергию на их синтез из минерального азота. Наибольший выход экзополисахаридов обеспечивала среда, содержащая аминный азот в количестве 2,1 %, а наибольший выход биомассы–4,1 %.
Большое значение имеет состав среды и соотношение углерода к азоту, в частности, соотношение 10:1 считается наиболее благоприятными для максимального производства ЭПС.
Дата добавления: 2021-02-10; просмотров: 434; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
