Взаимопревращения аллотропных модификаций серы
Материалы урока
Строение и свойства атомов.
Атомы серы, как и атомы кислорода и всех остальных элементов главной подгруппы VI группы, содержат на внешнем энергетическом уровне 6 электронов, из которых 2 электрона неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6. По отношению к менее электроотрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.
Размещение электронов по уровням и подуровням
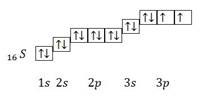
| Основное состояние 1s22s22p63s23p4 | |
| Размещение электронов по орбиталям | Степень окисления | Валентность |

| +2, -2 | В основном состоянии II |
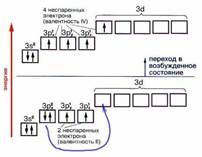
| +4 | Первое возбуждённое состояние IV |
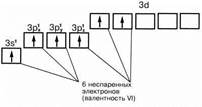
| +6 | Второе возбуждённое состояние VI |
Сера — простое вещество.
Для серы, как и для кислорода, характерна аллотропия. Известно много модификаций серы с циклическим или линейным строением молекул различного состава.
Наиболее устойчива модификация, известная под названием ромбической серы, состоящая из молекул S8. Ее кристаллы имеют вид октаэдров со срезанными углами. Они окрашены в лимонно-желтый цвет и полупрозрачны, температура плавления 112,8 °С. В эту модификацию при комнатной температуре превращаются все другие модификации. Известно, например, что при кристаллизации из расплава сначала получается моноклинная сера (игольчатые кристаллы, температура плавления 119,3 °С), которая затем переходит в ромбическую. При нагревании кусочков серы в пробирке она плавится, превращаясь в жидкость желтого цвета. При температуре около 160 °С жидкая сера начинает темнеть и становится настолько густой и вязкой, что даже не выливается из пробирки, однако при дальнейшем нагревании превращается в легкоподвижную жидкость, но сохраняет прежний темно-коричневый цвет. Если ее вылить в холодную воду, она застывает в виде прозрачной резинообразной массы. Это пластическая сера. Ее можно получить и в виде нитей. Однако через несколько дней она также превращается в ромбическую серу.
|
|
|
Ромбическая (a - сера) - S8
t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.

| Моноклинная (b - сера) - S8
темно-желтые иглы, t°пл. = 119°C;
ρ = 1,96г/см3.
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.

| Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую. |
| ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ |
Взаимопревращения аллотропных модификаций серы
|
|
|
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
Сера не растворяется в воде. Кристаллы серы в воде тонут, а вот порошок плавает на поверхности воды, так как мелкие кристаллики серы водой не смачиваются и поддерживаются на плаву мелкими пузырьками воздуха. Это процесс флотации. Сера малорастворима в этиловом спирте и диэтиловом эфире, хорошо растворяется в сероуглероде.
Cера в природе
Самородная сера

основные месторождения (Украина, Поволжье, Центральная Азия )
Сульфиды
PbS - свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
H2S – сероводород (в минеральных источниках и природном газе)
Белки
Волосы, кожные покровы, ногти…
Сульфаты
CaSO4 x 2H2O - гипс
MgSO4 x 7H2O – горькая соль (английская)
Na2SO4 x 10H2O – глауберова соль (мирабилит)
Получение серы
1. Промышленный метод - выплавление из руды с помощью водяного пара.
|
|
|
2. Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 = 2S + 2H2O
Химические свойства серы
| Сера - окислитель S 0 + 2ē → S -2 | Сера - восстановитель S - 2ē → S +2 ; S - 4ē → S +4 ; S - 6ē → S +6 |
| 1) Сера реагирует со щелочными металлами без нагревания: 2Na + S → Na2S ОПЫТ c остальными металлами (кроме Au, Pt) - при повышенной t°: 2Al + 3S –t°→Al2S3 Zn + S –t°→ZnS ОПЫТ Cu + S –t°→CuS ОПЫТ 2) С некоторыми неметаллами сера образует бинарные соединения: H2 + S → H2S 2P + 3S → P2S3 C + 2S → CS2 | 1) c кислородом : S + O2 –t°→ S +4 O2 2S + 3O2 –t°;pt→ 2S +6 O3 2) c галогенами (кроме йода): S + Cl2 → S +2 Cl2 3) c кислотами - окислителями: S + 2H2SO4( конц ) → 3S +4 O2 + 2H2O S + 6HNO3( конц ) → H2S +6 O4 + 6NO2 + 2H2O Реакции диспропорционирования: 3S 0 + 6KOH → K2S +4 O3 + 2K2S -2 + 3H2O |
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т. д.
Задание №1.
Закончите уравнения реакций:
S + O2→
S + Na→
S + H2→
|
|
|
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
Задание №2.
Осуществите превращения по схеме:
H2S → S → Al2S3 → Al(OH)3
Задание №3.
Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + H2 → (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + H2SO4( к ) =
S + KOH =
S + HNO3 =
Это интересно...
Содержание серы в организме человека массой 70 кг - 140 г.
В сутки человеку необходимо 1 г серы.
Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Следите за своим здоровьем!
Соединения серы могут служить лекарственными препаратами;
Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4× 7H2O и CuSO4× 5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
Железный купорос FeSO4×7H2O используют при анемии.
BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
Алюмокалиевые квасцы KAI(SO4)2×12H2O - кровоостанавливающее средство при порезах.
Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчатобумажных тканей. Соль также находит применение в производстве стекла.
Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Дата добавления: 2021-02-10; просмотров: 377; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
