Простая эвтектическая система.
Теоретическая часть.
 РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ.
РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ.
Правило фаз Гиббса.
Рассмотрим равновесие в гетерогенных системах. Гетерогенные системы содержат по меньшей мере 2 фазы. Только конденсированные системы бывают гетерогенными. Газовые системы, 
 состоящие из смеси различных газов, не расслаиваются. Конденсированная система состоит по крайней мере из одной конденсированной фазы и из насыщенного пара над ней. Конечно, можно налить жидкость в сосуд так, чтобы весь объем сосуда был заполнен ею, тогда система будет однофазной. Но в общем случае над жидкостью будет насыщенный пар, и система будет по меньшей мере двухфазной. Система может содержать и твердые фазы, и жидкие, так что предела числу фаз в системах в общем нет. Во всякой гетерогенной системе, находящейся в состоянии равновесия, все фазы должны находиться в равновесии друг с другом. Например, жидкая фаза должна находиться в равновесии с насыщенным паром, твердое вещество, растворяющееся в жидкости, должно находиться в равновесии с жидкой фазой и с паром.
состоящие из смеси различных газов, не расслаиваются. Конденсированная система состоит по крайней мере из одной конденсированной фазы и из насыщенного пара над ней. Конечно, можно налить жидкость в сосуд так, чтобы весь объем сосуда был заполнен ею, тогда система будет однофазной. Но в общем случае над жидкостью будет насыщенный пар, и система будет по меньшей мере двухфазной. Система может содержать и твердые фазы, и жидкие, так что предела числу фаз в системах в общем нет. Во всякой гетерогенной системе, находящейся в состоянии равновесия, все фазы должны находиться в равновесии друг с другом. Например, жидкая фаза должна находиться в равновесии с насыщенным паром, твердое вещество, растворяющееся в жидкости, должно находиться в равновесии с жидкой фазой и с паром.
Равновесие, которое устанавливается между фазами при физических процессах перехода веществ из одной фазы в другую, называется фазовым равновесием.
Наша задача состоит в том, чтобы найти колличественный закон, управляющий равновесием между фазами при изменении параметров системы.
Процессы, при которых устанавливаются новые фазовые равновесия в системах — это фазовые переходы (полиморфные превращения) твердых веществ, плавление или затвердевание, кипение или конденсация, переход в закритическое состояние, наконец, растворение и осаждение.
|
|
|
Введем несколько определений.
Фазой называется часть системы, отграниченная физическими поверхностями раздела, причем все интенсивные параметры фазы такие же, как и для всей системы при отсутствии внешнего воздействия.
Вещества, из которых состоит химическая система, называются компонентами системы.
Числом независимых компонентов называется число веществ в системе, достаточное для образования всех фаз данной системы. Чтобы вычислить число независимых компонентов в системе, нужно из числа всех компонентов системы вычесть число уравнений, их связывающих.
В системе
NH4C1^NH3 + HC1
помимо уравнения реакции существует равенство в соотношении компонентов: [NH3] = [НС1]. Поэтому число компонентов в этой системе равно 1. В дальнейших рассуждениях под названием «компонент» будет подразумеваться только независимый компонент. Рассмотрим для примера уравнение
z = f ( x , y ).
Если параметры х и у заданы, то z , независимо от нашего желания, определен, но если один из параметров, например у, не задан, то у нас появляется возможность произвольно варьировать его. В этом случае у нас появляется степень свободы в избрании одного из аргументов.
|
|
|
Число степеней свободы f системы — это число независимых термодинамических параметров, которые можно произвольно менять в некоторых пределах без изменения числа фаз в системе.
По числу степеней свободы системы подразделяют на нонвариантные (0 степеней свободы), моновариантные (1 степень свободы), бивариантные (2 степени свободы) и т. д.
Известно, что, если для полного описания системы требуется задать п параметров, то число степеней свободы
f = n - N ,
где N — число уравнений, связывающих параметры. Таким образом, чтобы узнать число степеней свободы, нужно определить п и N в уравнении .
Пусть задана система, состоящая из Ф фаз и К независимых компонентов. Состав каждой фазы определяется концентрацией. Очевидно, что достаточно знать (К-1) число концентраций, так как концентрация одного из компонентов может быть определена как разность. Общее число концентраций для Ф фаз равно Ф(К - 1). Кроме концентраций система определяется еще некоторым числом интенсивных параметров т, к числу которых относится температура, давление, электрические поля, поверхностное натяжение и др. Для всех фаз эти параметры в состоянии равновесия системы одинаковы, согласно определению фазы. Следовательно, общее число параметров, которое нужно для описания системы, будет равно: п = (К- 1)Ф + т, поскольку концентрации также являются параметрами системы. При равновесии химические потенциалы каждого независимого компонента во всех фазах одинаковы:
|
|
|
Общее число таких уравнений будет равно N = К(Ф —1). Подставим значения п и N в уравнение f= (К—1)Ф+m—(Ф—1)К, т. е.
f= К-Ф + m.
Уравнение называют правилом фаз Гиббса.
Число степеней свободы системы равно числу независи мых компонентов минус число фаз плюс число параметров системы.
В большинстве случаев система определяется лишь двумя интенсивными параметрами: температурой и давлением. Поэтому, как правило, т = 2 и
f= К-Ф + 2.
Правило фаз Гиббса имеет такое же значение для фазового равновесия, как закон действующих масс для химического равновесия в системах.
РАВНОВЕСИЕ В МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ. ХИМИЧЕСКИЕ ПРОЦЕССЫ РАЗДЕЛЕНИЯ.
ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ.
Изучение фазовых диаграмм многокомпонентных систем является важной проблемой при поиске новых сплавов и в технологии синтеза, разделения, очистки веществ.
|
|
|
Учение о фазовых равновесиях в многокомпонент ных системах, изучаемых с помощью диаграмм «состав — свойство», называется физико-химическим анализом.
Можно изучать различные свойства систем в зависимости от состава, например, плотность, вязкость и др. Результаты исследований наносятся на диаграмму «состав — свойство», на которой фазовые равновесия в системе отражаются в виде геометрических образов. Таким образом, физико-химический анализ использует геометрические преобразования вместо аналитических, которые используются при изучении химического равновесия в системах.
В основе физико-химического анализа лежат два геометрических принципа: принцип непрерывности и принцип соответствия
При непрерывном изменении состава системы непрерывно изменяются и ее свойства.
Каждому из фазовых превращений в системе соответ
ствует собственный геометрический образ на диаграмме
«состав — свойство».
РАВНОВЕСИЕ В ДВУХКОМПОНЕНТНЫХ
СИСТЕМАХ.
В двухкомпонентных системах параметрами, определяющими фазовое равновесие, являются температура, объем, давление p, концентрация одного из компонентов. В большинстве случаев системы изучаются при постоянном давлении (атмосферном). Если давления пара компонентов пренебрежимо малы, то и изменения объема в конденсированной системе пренебрежимо малы, поэтому диаграммы двухкомпонентных систем на плоскости можно представить в координатах «состав — давление» или «состав — температура».
Простая эвтектическая система.
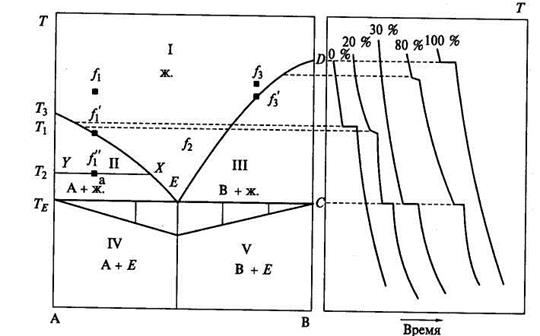
Рассмотрим температуры плавления в двухкомпонентных системах в зависимости от состава. Так как температуры плавления изучаются обычно при постоянном атмосферном давлении, то правило фаз для этого случая содержит всего один неконцентрационный параметр: f= К - Ф + 1. Пусть компоненты в двухкомпонентной системе в жидком состоянии полностью смешиваются. Приготовим составы, содержащие возрастающие концентрации компонента В в смеси с компонентом А: например, О, 20, 40, 60, 80, и 100% компонента В.
Диаграмма состоит из четырех бивариантных полей: по-ле I — расплав, поле II — расплав + твердый компонент А; поле III — расплав + твердый компонент В; поле IV — твердый компонент А + эвтектика: поле V — твердый компонент В + эвтектика. Поля отграничены моновариантными кривыми.
Мелкокристаллическая смесь компонентов, затвердевающая при постоянной температуре, называется эвтектиче ской смесью или эвтектикой.
Линии на диаграмме, отвечающие появлению твердой фазы при охлаждении расплава или исчезновению твердой фазы при его нагревании, называются кривыми ликвидуса.
Линии на диаграмме, соответствующие исчезновению жидкой фазы при охлаждении расплава или появлению жидкой фазы при его нагревании, называются кривыми со-лидуса .
Нанесем на диаграмму три фигуративные точки: f1, f2, f3 и рассмотрим фазовые превращения состава, который отвечает точке f1 при понижении температуры. Точка f1 располагается на поле I, которое занято расплавом, т.е. одной жидкой фазой. Если компоненты системы имеют ничтожное давление пара, то его можно принять постоянным. В таком случае будет меняться лишь один неконцентрационный параметр — температура. Для такого случая правило фаз Гиббса будет отвечать уравнению , f = К - Ф + 1. Поэтому число степеней свободы на однофазном поле будет равно f = 2-1 + 1 = 2. Следовательно, состояние системы, обозначенное полем, бивариантно. При изменении до некоторого предела и состава и температуры число фаз в фигу
ративных точках, расположенных на поле I диаграммы, не будет;
меняться. Поэтому при понижении температуры фигуративная
точка fi будет опускаться, а число фаз при этом будет' оста
ваться равным единице до тех пор, пока фигуративная точка f1
не достигнет кривой ТАЕ при температуре Т1. Здесь начина
ет кристаллизоваться компонент А в точке f1. Система стано
вится двухфазной, число степеней свободы становится равным
f = 2-2 + 1 = 1. Следовательно, кривым на диаграмме плавко
сти отвечает моновариантное состояние системы. Поэтому далее
молено менять лишь один параметр системы: либо температуру,
либо концентрацию. При дальнейшем понижении температуры
должен продолжать выделяться из расплава компонент А, и со-'
став расплава будет изменяться в соответствии с кривой АЕ,
которую называют кривой ликвидуса. Поле II, таким образом,
является двухфазным полем, в котором система моновариантна.
Количество кристаллов, выделившихся из расплава при охла
ждении системы до температуры Т1, можно рассчитать по пра
вилу рычага. Для этого проведем через точку f1' на поле II пря
мую, параллельную оси составов. Получим отрезок, ограничен
ный осью температур и кривой АЕ. Точка f " делит этот отрезок
на две части. Вся длина отрезка отвечает общей массе расплава
и кристаллов mо, причем
mо = т1 + m 2,
где m 1 — масса расплава; т2 — масса кристаллов компонента А. Величина т1 обратно пропорциональна отрезку f ^ x , а величина т2 обратно пропорциональна отрезку fl у. Поэтому >
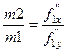
Уравнение представляет правило рычага.
Прямая, проведенная через точку на двухфазном поле
параллельно оси составов, разделяется данной точкой так, I
что количества той и другой фазы обратно пропорциональ
ны отрезкам на прямой.
Уравнения представляют систему линейных ! уравнений, решая которую можно определить массу кристаллов ■ и массу расплава при температуре Т\. При дальнейшем охлаждении фигуративная точка f 1 будет опускаться далее до тех пор, пока не достигнет прямой CD , проходящей через точку Е.
При температуре Те исчезает жидкая фаза. Весь расплав закристаллизовывается, превращаясь в мелкокристаллическую смесь компонентов А и В.
Реакция, при которой расплав нонвариантно кристалли зуется, образуя эвтектическую смесь компонентов, называ ется эвтектической реакцией: расплав -эвтектика (А + В).
Нонвариантная точка на диаграмме плавкости, в которой происходит затвердевание смеси с исчезновением жид-
кой фазы при кристаллизации смеси или появление жид-
кой фазы при плавлении смеси, называется эвтектической
точкой. |
Рассмотрим процесс охлаждения расплава, имеющего состав-фигуративной точки fз- Эта фигуративная точка находится также на однофазном поле, где система бивариантна. Можно менять и состав, и температуру, не изменяя числа фаз. При охлаждении точка будет опускаться до кривой ЕВ. При температуре Тз из расплава начнет кристаллизоваться компонент В. Далее все будет происходить также, как и для фигуративной точки fj.
|
|
Системы, подобные рассмотренной системе А — В, являются
простыми эвтектическими системами. Координаты эвтектиче
ской точки нам не пришлось выяснять, поскольку они опреде
лились тем, что одна из кривых охлаждения,
случайно прошла через эвтектическую точку. Однако
на практике редко бывает так, чтобы один из заданных составов
точно совпал с эвтектическим составом. Как же определяют ко-
ординаты эвтектической точки? Если приглядеться к рисунку,
то можно заметить, что длина площадок, отвечающих затвердев
ванию эвтектических смесей на кривых охлаждения, изменяется;
таким образом, что их протяженность растет при приближении
к эвтектической точке. Если длины этих площадок нанести вер-
тикально под эвтектической прямой и соединить их концы ли
ниями, то получим треугольник, который изображен на рисунке
под эвтектической прямой.
Треугольник, построенный на диаграмме плавкости под нонвариантной кривой путем соединения конечных точек вертикально отложенных площадок эвтектического затвердевания или полиморфного превращения на кривых «температура— время», называется треугольником Таммана.
Вершина треугольника Таммана находится на одной прямой с эвтектической точкой. Следовательно, построив треугольник Таммана, легко найти координаты эвтектической точки.
Экспериментальная часть.
Лабораторная работа № 4
«Построение диаграммы плавкости двухкомпонентной системы».
Цель работы: Изучение фазовых равновесий в двухкомпонентной системе фенол – нафталин методом термического анализа и построение диаграммы плавкости этой системы по экспериментально полученным кривым охлаждения чистых компонентов и их смесей.
Приборы и реактивы :
1. Семь пробирок со смесью фенола и нафталина, взятых в соотношении
| № пробы | фенол | нафталин | ||
| 1 | 20 | 1,6 | 80 | 6,4 |
| 2 | 35 | 2,8 | 65 | 5,2 |
| 3 | 45 | 3,6 | 55 | 4,4 |
| 4 | 55 | 4,4 | 45 | 3,6 |
| 5 | 65 | 5,2 | 35 | 2,8 |
| 6 | 85 | 6,8 | 15 | 1,2 |
| 7 | 100 | 8,0 | 0 | 0 |
2. Стакан с водой для нагревания смесей.
3. Стакан с водой для охлаждения смесей.
4. Нагревательный прибор (электрическая плитка).
Ход работы.
1. Пробы нагревают до расплавления смеси.
2. Медленно охлаждают, отмечая температуру через каждые 15 секунд.
3. Отмечают температуру начала кристаллизации смеси.
4. По полученным данным строят диаграмму плавкости двухкомпонентной системы.
Форма отчета :
1. Таблица результатов:
| Время, сек. | Тепловые смеси, T | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| № смеси | Состав смеси | Температура начала кристаллизации | Отвердевание эвтектики | ||
| весовой | молярный | температура | Продолжительность температурной остановки | ||
2. Диаграмма охлаждения в координатах “время охлаждения-температура”.
3. Диаграмма плавкости в координатах ;”состав-температура”.
ХТ – 252, 253
Федеральное агентство по образованию РФ
Тверской государственный технический университет
Кафедра «Биотехнология и химия»
Методические указания к лабораторным работам.
Лабораторная работа № 4
«Построение диаграммы плавкости двухкомпонентной системы».
Тверь. 2006 г.
Дата добавления: 2021-02-10; просмотров: 157; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!