Определите молекулярную формулу каждого из веществ.
Решение задач на вывод химических формул
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ. Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
| Вывод химической формулы вещества: | Вычисление молярной массы вещества | Задачи для самостоятельного решения |
| - на основании массовых долей (%) атомов элементов | M 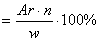 , где n - число атомов , где n - число атомов
| Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
| - на основании массовых долей (%) атомов элементов и относительной плотности соединения | М (CхНу) = D(Н2) ·М (Н2) | Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
| - по относительной плотности вещества и общей формуле класса | М (CхНу) = D(Н2) ·М (Н2) | Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
| - на основании массовых долей (%) атомов элементов и плотности в газообразном состоянии | М находится по М (в-ва)=Vm·ρ | Углеводород содержит 81,82 % углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. Ответ: C3Н8 |
| - по массе или объёму исходного вещества и продуктам горения |  М (CхНу) = D(Н2) ·М (Н2) М (CхНу) = D(Н2) ·М (Н2)
| Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества. Ответ: C6H14О |
1) Определите молекулярную формулу предельного углеводорода, если
|
|
|
а) относительная плотность по водороду равна 43;
 б) относительная плотность по кислороду равна 4,44
б) относительная плотность по кислороду равна 4,44
|
|
|
Дано: Решение:
D (CxHу) Н2 = 43 1. Найдём молекулярную массу
СnH2n+2 М CxHу = D(CxHу)Н2 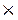 Мr(Н2)
Мr(Н2)

X -: У- ? (n)
2. Найдём количество атомов, составив уравнение
СnH2n+2 =86 (Вместо С и Н подставим числовые значения их относительных атомных масс и придём к математическому уравнению)
12n + 2n + 2 = 86; 14n = 86 – 2; 14n = 84; n = 6 => C6H14
2) Вывести химическую формулу алкена, если его плотность равна 3,125 г/л.
3) Вывести химическую формулу алкина, если 1 литр его весит 3,04г.
4) Вывести химическую формулу альдегида, если его относительная плотность по воздуху равна 2.
5) Вывести химическую формулу карбоновой одноосновной кислоты, если плотность паров равна 3,93 г/л.
6) Вывести химическую формулу однозамещённого хлорпроизводного предельного углеводорода, если его относительная плотность по воздуху равна 2,224.
· Какой газообразный алкан имеет при нормальных условиях плотность 1,339 г/л?
· Алкан имеет плотность паров по воздуху 4,414. Определить формулу алкана.
· Молекула алкана содержит 26 электронов. Установите его формулу.
· При бромировании углеводорода было получено бромпроизводное, имеющее относительную плотность по кислороду, равную 5,094. Определите возможное строение углеводорода, предложите способ его получения из неорганических реагентов.
|
|
|
· Приведите структурные формулы циклоалканов, в молекулах которых находится по 40 электронов.
· Алкен имеет молекулярную массу – 84. Определите его молекулярную формулу.
· В молекуле циклоалкена число атомов углерода и водорода различается на 4. Приведите структурные формулы этого соединения и его изомера, не относящегося к циклическим углеводородам.
· Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название одного изомера исходного алкена.
· Относительная плотность паров хлоралкана по алкену, из которого он получен, равна 1,87. Установите строение алкена.
· Молекулярная масса алкина – 96. Что это за алкин?
· Определить формулу ароматического углеводорода с относительной молекулярной массой 92.
· Приведите структурную формулу ароматического углеводорода, имеющего в молекуле 50 электронов.
· Относительная плотность паров алкана по водороду равна 57. Выведите молекулярную формулу алкана.
|
|
|
· Относительная плотность паров алкана по азоту равна 5,07. Выведите молекулярную формулу алкана.
· Относительная плотность паров циклоалкана по кислороду равна 3,5. Выведите молекулярную формулу циклоалкана.
· Плотность циклоалкана при нормальных условиях равна 1,875 г/л. Выведите молекулярную формулу циклоалкана.
· Углеводород имеет относительную плотность по азоту 2,5. Он не обесцвечивает бромную воду. Предположите возможную структуру углеводорода. Дайте название.
· Углеводород имеет относительную плотность по углекислому газу 1,9. Он не обесцвечивает холодный раствор перманганата калия. Предположите возможную структуру углеводорода. Дайте название.
· Относительная плотность паров алкена по водороду равна 42. Выведите молекулярную формулу алкена.
· Плотность алкена при н. у. равна 2,5 г/л. Выведите молекулярную формулу алкена.
· 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
· Относительная плотность паров алкадиена по кислороду равна 3. Выведите молекулярную формулу алкадиена.
· Относительная плотность углеводорода по воздуху равна 2,345. Массовая доля углерода в нем равна 88,24%. Выведите молекулярную формулу углеводорода.
· 1 г алкина при н. у. занимает объем 0,86 л. Выведите молекулярную формулу алкина.
· Относительная плотность паров алкина по воздуху равна 2,83. Выведите молекулярную формулу алкина.
· Относительная плотность по гелию паров углеводорода ряда бензола равна 23. Выведите его молекулярную формулу.
· Пары арена имеют относительную плотность по воздуху 4,14. Выведите его молекулярную формулу.
· Относительная плотность паров предельного одноатомного спирта по водороду равна 37. Выведите молекулярную формулу спирта.
· Относительная плотность паров предельного простого эфира по гелию равна 15. Выведите молекулярную формулу эфира.
· Относительная плотность паров предельного двухатомного спирта по кислороду равна 3,25. Выведите молекулярную формулу спирта.
· Относительная плотность паров предельного трехатомного спирта по метану равна 5,75. Выведите молекулярную формулу спирта.
· Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида.
· Относительная плотность паров предельного альдегида по неону равна 5. Выведите молекулярную формулу альдегида.
· Относительная плотность паров органического соединения по водороду равна 36. Массовая доля углерода в этом веществе равна 66,67%, массовая доля водорода равна 11,11%, а остальное приходится на кислород. Выведите молекулярную формулу органического соединения и предложите структуру, если известно, что это вещество: а) не дает реакции «серебряного зеркала»; б) дает реакцию «серебряного зеркала».
· Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
· Относительная плотность паров предельного амина по кислороду равна 1,844. Выведите молекулярную формулу амина.
· Относительная плотность паров ароматического амина по метану равна 6,75. Выведите его молекулярную формулу.
 7) Углеводород (относительная плотность по водороду равна 39) содержит 92,31 % углерода и 7,69% водорода. Найдите его молекулярную формулу.
7) Углеводород (относительная плотность по водороду равна 39) содержит 92,31 % углерода и 7,69% водорода. Найдите его молекулярную формулу.
Дано: Решение:
W% (С) = 92, 31 1.Найдём молекулярную массу
W% (Н) = 7, 69 Мr (CxHу) = 39 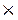 2 = 78
2 = 78
D (CxHу)Н2 = 39 2. Найдём количество атомов, т.е. отношение

х : у = ? γ = т/А r; х : у =  ; => СН
; => СН
3. Убедимся, истинная это формула или простейшая. Для этого найдём молекулярную массу (СН); Мr(СН) = 12 + 1 = 13, а у нас 78 => нашли простейшую формулу. Чтобы вывести истинную формулу вещества нужно узнать, сколько раз 13 уложится в 78. Именно на столько нужно будет увеличить количество атомов в простейшей формуле.
78: 13 = 6 => С6Н6
Mr (С6Н6) = 12 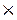 6 + 6 = 78
6 + 6 = 78
Или: m(С)=  ; m(Н)=78-72=6; х:у=
; m(Н)=78-72=6; х:у= 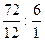 =6:6=>С6Н6
=6:6=>С6Н6
8) Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
| Дано: w (О) = 42,67% Вывести формулу соединения CnН2n (N Н2) CОOH | Решение:
Рассчитать молярную массу кислоты CnН2n (N Н2) CОOH w (О) =  M кислоты
M кислоты 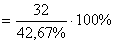 = 75 (г/моль)
Найти число атомов углерода в молекуле кислоты и установить её формулу М = 12 n + 2 n + 16 + 45 =75
14 n = 14, n = 1
Ответ: формула кислоты NН2CН2CОOH
М (NН2CН2 CОOH) = 75 г/моль = 75 (г/моль)
Найти число атомов углерода в молекуле кислоты и установить её формулу М = 12 n + 2 n + 16 + 45 =75
14 n = 14, n = 1
Ответ: формула кислоты NН2CН2CОOH
М (NН2CН2 CОOH) = 75 г/моль
|
Задача № 9. Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
| Дано: w (С) = 85,7 % w (Н) = 14,3 % D Н2 (CхНу) = 21 | Решение:
m (Н) = 42г. /100% · 14,3 %= 6 г. Находим количество вещества атомов углерода и водорода n (С) = 36г :12 г/моль = 3 моль n (Н) = 6г.: 1 г/моль = 6 моль Ответ: истинная формула вещества C3Н6. |
| Вывести формулу соединения CхНу- ? |
Задача № 10 Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
| Дано: Пары алкана в 2,5 раза тяжелее аргона | Решение: Откуда n = 7. Ответ: формула алкана C7Н14 |
| Вывести формулу алкана C n Н2 n + 2 |
Задача № 11 Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
| Дано: w (С) = 39,97 % w (Н) = 6,73 % w (0) = 53,30 % Vн.у. (CхHуОz) = 300 мл. m (CхHуОz) = 2,41 г. | Решение: 1. Определяем количество вещества: n (С) = 39,97 г :12 г/моль = 3,33 моль n (Н) = 6,73г.: 1,008 г/моль = 6,66 моль n (О) = 53,3г: 16 г/моль = 3,33 моль Определяем наименьшее общее кратное – 3,33. n (С) : n (Н) : n (О) = 1 : 2 : 1 Простейшая формула соединения – CH2О М (CH2О) = 30 г/моль Определяем молярную массу соединения по соотношению: 0,3 л. – 2,41 г. 22,4 л. – х г. х = (22,4 · 2,41)/0,3 = 180 Или по формуле М= Vm · m/ V К = 180 : 30 = 6 Определяем молекулярную формулу соединения, умножая стехиометрические коэффициенты в простейшей формуле на 6. |
| Вывести формулу соединения CхНуОz- ? |
· Определите формулу углеводорода, массовая доля углерода в котором 82,2 %, а плотность этого вещества составляет 2,59 г/л.
· Определите формулу красителя-анилина. По данным анилина массовая доля углерода в нем 77,4%, водорода — 7,5 %, азота — 15,1 %. Относительная плотность паров этого вещества по воздуху равна 3,21.
· Относительная молекулярная масса исследуемого вещества равна 237, массовая доля углерода в нем составляет 10,1 %, а хлора — 89,9. Установите формулу этого хлорзамещенного углеводорода.
· Определите молекулярную формулу предельного углеводорода, плотность которого равна 1,97 г/л, а массовая доля углерода составляет — 0,82.
· Какова формула вещества, при анализе состава которого установлено: массовая доля углерода в нем равна 0,52; кислорода — 0,35, а водорода — 0,13? Относительная плотность вещества по водороду составляет 23.
· Определите молекулярную формулу кислородсодержащего органического вещества по данным анализа: массовая доля углерода — 54,55 %; массовая доля водорода — 9,09 %.
· Углеводород содержит в массовых долях 0,8889 или 88,89 % углерод. Его плотность по воздуху равна 1,852. Найдите молекулярную формулу этого углеводорода.
· Определите формулу вещества, если массовая доля азота в нем 30,43%, а кислорода — 69,57 %.
· Химический анализ показал, что в 17 г соединения алюминия с кислородом содержится 9 г алюминия. Найдите простейшую формулу этого соединения.
· Найдите простейшую формулу оксида хрома, содержащего 68,4 % хрома.
· Найдите простейшую формулу вещества, содержащего 43,6 % натрия, 11,3 % углерода и 45,3 % кислорода.
· При анализе навески 3,16 мг органического вещества обнаружено, что в его составе 0,96 мг углерода, 0,12 мг водорода и 0,8 мг кальция, а остальное приходится на кислород. Найдите простейшую формулу этого соединения.
· Известно, что оксид некоторого металла содержит 11,11 % кислорода и в его молекуле на один атом кислорода приходится два атом, а металла. Определите, что это за металл, и о каком соединении идет речь.
· Найдите формулу соединения, если известно, что в его состав входит 1,59 % водорода, 22,22 % азота, 76,19 % кислорода.
· Дано: углерода —92,3 %, водорода — 7,7 %, масса 1 л газа при н.у. 1,16 г. Определить молекулярную формулу.
· Определите формулы двух оксидов одного и того же элемента, если его массовая доля в этих оксидах равна 88,11 и 84,75%. Этот элемент образует также фторид, содержащий 32,47 % фтора по массе.
· Элемент ниобий образует более двадцати галогенводородов. Установите две формулы соединений ниобия с одним из галогенов, если содержание металла в них составляет 15,47 и 21,54 % по массе.
· Относительная плотность по водороду неизвестного газообразного вещества равна 22. Найдите молекулярную формулу этого вещества, если массовая доля (С) в нем 54,55 %, (Н) — 9,09 %, (О) — 36,36 %.31. Найдите простейшую формулу соединения, имеющего следующий состав: Nа —42,1 %, Р — 18,9 %, О — 39,0 %.
· Определите молекулярную формулу органического соединения с составом 80% углерода и 20% водорода, если плотность его по воздуху равна 1,034.
· Определите молекулярную формулу углеводорода, который содержит 85,7% углерода и имеет плотность по водороду 21.
· Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества по воздуху 3,93. Определить формулу вещества.
· Углеводород содержит 82,76% углерода и 17,24% водорода (по массе). При монохлорировании этот углеводород образует два изомерных алкилхлорида – первичный и третичный. Определить строение исходного углеводорода.
· Органическое вещество содержит 91, 3% углерода и 8,7% водорода. Относительная плотность паров по кислороду равна 2,875. Вывести молекулярную формулу вещества.
· Установите молекулярную формулу углеводорода, молекула которого содержит 40 электронов, а молекулярная масса которого 70.
· Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
· Установите молекулярную формулу дибромалкана, содержащего 85,11% брома.
· Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
· Монохлорпроизводное предельного углеводорода содержит 38.4% хлора. Определить формулу углеводорода.
· Монохлорпроизводное предельного углеводорода содержит 38,4% хлора по массе. Определите, сколько атомов углерода содержится в молекуле этого вещества.
· В монохлоралкане массовая доля хлора равна 55,04%. Определите формулу монохлоралкана.
· Определите молекулярную формулу фторпроизводного алкана, в 34,27 г которого содержится 17,44 г фтора.
· Определите молекулярную формулу хлорпроизводного алкана, в 35,24 г которого содержится 23,83 г хлора.
· Дихлорпроизводное алкана содержит 5,31% водорода по массе. Определите молекулярную формулу дихлоралкана. Приведите структурную формулу одного из возможных изомеров и назовите его.
· Вещество содержит 36.4% С, 6.1% Н и фтор. Молекулярная масса этого вещества меньше 110. Сколько всего атомов в этой молекуле?
· Органическое вещество содержит 0,2424 доли углерода, 0,0404 доли водорода, 0,7172 хлора. Плотность паров по азоту составляет 3,5357. Определите химическую формулу этого вещества.
· Органическое вещество содержит 0,2975 углерода, 0,0413 водорода, 0,6612 брома. Относительная плотность паров по воздуху равна 4,1724. Вывести молекулярную формулу вещества.
· 8-23. При монохлорировании углеводорода, содержащего 83,72% С и 16,28% Н, образовалось 2 изомерных хлорпроизводных – первичное и третичное. Установите строение углеводорода, составьте формулы продуктов хлорирования
· Содержание брома в соединении, полученном при взаимодействии алкена с бромом, составляет 69,56 мас.%. Определите структурную формулу алкена, если известно, что он может существовать в виде цис- и транс- изомеров.
· Ароматическое соединение ряда бензола содержит 90.0% углерода. Нарисовать ео возможные изомеры.
· Плотность по водороду вещества равна 22. Вещество имеет следующий состав: углерод - 54,55%, водород - 9,09%, кислород – 36,36% Вещество легко восстанавливает оксид серебра. Определить это вещество.
· Органическое вещество природного происхождения содержит 40 мас.% углерода, 6,67 мас.% водорода и кислород. Сколько всего атомов содержит молекула этого соединения, если известно, что его молярная масса равна 180 г/моль?
· В предельной одноосновной карбоновой кислоте массовая доля кислорода равна 43,24%. Определите формулу кислоты.
· Предельная одноосновная карбоновая кислота содержит 48.6%С. Какая это кислота?
· Установите молекулярную формулу предельной карбоновой кислоты, метиловый эфир которой содержит 9,09% водорода.
· При взаимодействии первичного одноатомного спирта, содержащего 60% углерода и 13,3% водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна
Определите молекулярную формулу каждого из веществ.
· При взаимодействии одноатомного спирта, содержащего 52,17% углерода и 13,04% водорода, с органической кислотой, образуется вещество, плотность паров которого по водороду равна 51. Определите молекулярную формулу каждого вещества, участвующего в реакции, и дайте им название.
· При взаимодействии одноатомного спирта, содержащего 37,5% углерода, 12,5% водорода, с органической кислотой образуется вещество, плотность паров которого по водороду равна 37. Определите молекулярную формулу каждого вещества, участвующего в реакции, и дайте им название.
· Эфир с молярной массой 130 г/моль при гидролизе образует кислоту, в серебряной соли которой массовая доля серебра составляет 59,66%. Определите число атомов углерода в молекуле спирта, образовавшего эфир.
· Определите молекулярную формулу предельного многоатомного спирта, в 31,25 г которого содержится 14,15 г кислорода.
· Определите молекулярную формулу предельного многоатомного спирта, в 37,67 г которого содержится 16,62 г углерода.
· Путресцин содержит 54,5% (С), 13,6% (Н), остальное приходится на азот. Плотность его паров по водороду равна 44. Установите молекулярную формулу путресцина.
· Одно из важнейших химических соединений реагентов, относящихся к классу диаминов, содержит 40% (С), 46,7% (N), остальное – водород. Установите молекулярную формулу этого органического соединения.
· Вещество содержит 69,2 % С, 3,85 % Н и азот. Молекулярная масса этого вещества меньше 150. Сколько всего атомов в этой молекуле?
· Предельный амин содержит 31.1% азота. Определите возможное строение этого амина.
· Установите молекулярную формулу предельного третичного амина, содержащего 23,73% азота по массе.
· Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу аминокислоты.
· Газообразный углеводород имеет относительную плотность по кислороду 1,375, а массовые доли углерода и водорода в нем составляют соответственно 81,8% и 18,2%. Какое это соединение?
· Относительная плотность паров углеводорода по кислороду равна 2,25. Массовая доля углерода в нем равна 83,33%. Выведите молекулярную формулу этого углеводорода.
· Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
· Относительная плотность паров углеводорода по азоту равна 3. Массовая доля углерода в нем равна 85,71%. Выведите его молекулярную формулу.
· Относительная плотность паров углеводорода по водороду равна 35. Массовая доля водорода в нем равна 14,285%. Выведите молекулярную формулу углеводорода.
· Относительная плотность паров углеводорода по азоту равна 3,5. Массовая доля углерода в нем равна 85,71%. Выведите молекулярную формулу углеводорода.
· Углеводород массой 12,5 г при н. у. занимает объем 5 л. Массовая доля водорода в нем равна 14,29%. Выведите молекулярную формулу углеводорода.
· Относительная плотность паров углеводорода по водороду равна 41. Массовая доля водорода в нем равна 12,2%. Выведите молекулярную формулу углеводорода
· Относительная плотность паров углеводорода по кислороду равна 2,125. Массовая доля углерода в нем равна 88,24%. Выведите молекулярную формулу углеводорода
· Относительная плотность паров углеводорода по углекислому газу равна 2,41. Массовая доля углерода равна 90,6%. Выведите молекулярную формулу углеводорода.
· При хлорировании на свету некоторого углеводорода получается единственное монохлорпроизводное, массовая доля хлора в котором равна 22,98%. Назовите исходный углеводород.
· При хлорировании на свету некоторого углеводорода получается единственное монохлорпроизводное, массовая доля хлора в котором равна 21,07%. Назовите исходный углеводород.
· Относительная плотность паров органического соединения по кислороду равна 2,75. Массовая доля углерода в этом веществе равна 68,18%, массовая доля водорода равна 13,64%, остальное — кислород. Выведите молекулярную формулу этого вещества.
· Относительная плотность паров органического соединения по воздуху равна 4. Массовая доля углерода в этом веществе равна 72,41%, массовая доля водорода равна 13,79%, массовая доля кислорода равна 13,79%. Выведите молекулярную формулу этого вещества.
· Относительная плотность паров органического вещества по углекислому газу равна 2,41. Массовая доля углерода в этом веществе равна 45,28%, массовая доля водорода равна 9,44%, а остальное приходится на кислород. Выведите молекулярную формулу этого вещества.
· Относительная плотность паров органического вещества по водороду равна 60. Массовая доля углерода в этом веществе равна 50%, массовая доля водорода равна 10%, массовая доля кислорода равна 40%. Выведите молекулярную формулу органического вещества.
· Относительная плотность паров органического соединения по метану равна 7,75. Массовая доля углерода в этом веществе равна 67,74%, массовая доля водорода равна 6,45%, а остальное приходится на кислород. Выведите молекулярную формулу этого соединения.
· Относительная плотность паров органического соединения по азоту равна 4,5. Массовая доля углерода в этом веществе равна 57,14%, массовая доля водорода равна 4,76%, массовая доля кислорода равна 38,10%. Выведите молекулярную формулу этого соединения.
· 10 л газообразного соединения при н. у. имеют массу 13,4 г. Массовые доли углерода и водорода в нем составляют соответственно 40% и 6,7%, остальное — кислород. Установите молекулярную формулу соединения.
· Относительная плотность паров органического соединения по кислороду равна 3,125. Массовая доля углерода в этом веществе равна 72%, массовая доля водорода равна 12%, остальное — кислород. Выведите молекулярную формулу этого соединения.
· Массовая доля углерода в предельной одноосновной карбоновой кислоте составляет 54,5%. Какая это кислота? Какие эфиры будут ее изомерами?
· Относительная плотность паров органического соединения по неону равна 5,4. Массовая доля углерода в этом веществе равна 58,82%, массовая доля водорода равна 9,8%, а остальное — кислород. Выведите молекулярную формулу органического соединения. Предложите возможные структуры.
· Относительная плотность паров органического соединения по кислороду равна 4,5. Массовая доля углерода в этом веществе равна 66,67%, массовая доля водорода равна 11,11%, массовая доля кислорода равна 22,22%. Выведите молекулярную формулу органического соединения.
· Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
· Массовая доля углерода в моноамине равна 63,16%, массовая доля азота равна 24,56%. Выведите молекулярную формулу амина.
· Выведите молекулярную формулу моноаминокарбоновой кислоты, массовая доля азота в которой составляет 11,97%.
· Массовая доля кислорода в предельном эфире аминоуксусной кислоты составляет 27,35%. Напишите возможные структурные формулы этого эфира.
Дата добавления: 2020-12-12; просмотров: 355; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 М (CхНу)= 21 · 2 = 42
М (CхНу)= 21 · 2 = 42