Характеристика коллоидных систем. Опыты Грема
Билет
Поверхностные явления и дисперсные явления в природе, технологии, в решении проблем охраны окружающей среды.
Своеобразие дисперсных систем определяется большой удельной поверхностью дисперсной фазы и физико-химическим взаимодействием дисперсной фазы и дисперсионной среды на границе раздела фаз. C повышением дисперсности вещества все большее значение имеют его свойства, определяемые поверхностными явлениями, т. е. совокупностью процессов, происходящих в межфазовой поверхности. Эти свойства обусловлены избытком свободной энергии поверхностного слоя, особенностями его структуры и состава.
Поверхностные явления могут иметь физический характер или сопровождаться химическими превращениями; они протекают на жидких (легкоподвижных) и твердых межфазных границах. Поверхностные явления, связанные с действием поверхностного натяжения и вызываемые искривлением жидких поверхностей раздела, называются также капиллярными явлениями. К ним относятся:
1) капиллярное всасывание жидкостей в пористые тела;
2) капиллярная конденсация, установление равновесной формы капель;
3) установление газовых пузырей;
Установление менисков.
Свойства поверхности контакта двух твердых тел или твердого тела с жидкой и газовой средами определяют условия таких явлений, как адгезия, смачивание, трение.
Молекулярная природа и свойства поверхности могут коренным образом изменяться в результате образования поверхностных мономолекулярных слоев или фазовых (полимолекулярных) пленок. Такие изменения часто происходят вследствие физических процессов (адсорбции, поверхностной диффузии, растекания жидкости) или химического взаимодействия компонентов соприкасающихся фаз. Любое «модифицирование» поверхностного (межфазного) слоя обычно приводит к усилению или ослаблению молекулярного взаимодействия между контактирующими фазами. Физические или химические превращения в поверхностных слоях сильно влияют на характер и скорость гетерогенных процессов — коррозионных, каталитических, мембранных и др. Поверхностные явления отражаются и на типично объемных свойствах тел. Так, уменьшение свободной поверхностной энергии твердых тел под действием адсорбционно-активной среды вызывает понижение их прочности (эффект Ребиндера).
|
|
|
Особую группу составляют поверхностные явления, обусловленные наличием в поверхностном слое электрических зарядов:
1) электроадгезионные явления;
2) электрокапиллярные явления;
Электродные процессы.
Поверхностные явления имеют место в любой гетерогенной системе, состоящей из двух или нескольких фаз, поэтому их роль в природных и технологических процессах чрезвычайно велика. Во взаимосвязи броуновского движения и поверхностных явлений протекают все процессы, приводящие к изменению размеров частиц высокодисперсной фазы (коагуляция, коалесценция, пептизация, эмульгирование). В грубодисперсных и макрогетерогенных системах на первый план выступает конкуренция поверхностных сил и внешних механических воздействий. Поверхностные явления, влияя на величину свободной
|
|
|
поверхностной энергии и строение поверхностного слоя, регулируют зарождение и рост частиц новой фазы в пересыщенных парах, растворах и расплавах, взаимодействие коллоидных частиц при формировании разного рода дисперсных структур. На глубину и направление процессов, обусловленных поверхностными явлениями, часто решающим образом влияют ПАВ, меняющие в результате адсорбции структуру и свойства межфазных поверхностей.
Билет
Высокораздробленное состояние вещества. Дисперсные системы, дисперсная фаза дисперсионная среда.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
|
|
|
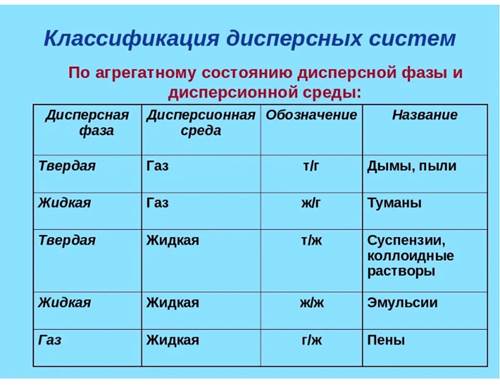 |
То вещество, которое присутствует в дисперсной системе в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ. Вещество, присутствующее в дисперсной системе в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между дисперсионной средой и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными, т. е. неоднородными.
Билет
Характеристика коллоидных систем. Опыты Грема
Возникновение науки коллоидной химии связано с исследованиями английского химика Т. Грэма. После пионерских исследований М. Фарадея (1857 г.), когда впервые были получены устойчивые коллоидные растворы высокодисперсного золота, в 1861 г. Грэм изучал диффузию разных веществ в водных растворах и обнаружил, что некоторые из них (желатин, агар-агар и т. п.) диффундируют в воде намного медленнее, чем, например, соли и кислоты. Также эти вещества при пересыщении растворов не кристаллизовались, а формировали студнеобразную, клейкую массу. Эти вещества Т. Грэм назвал коллоидами (от греч. kolla — «клей», eidos — «вид»). Так появилось название науки — «коллоидная химия». Т. Грэм выдвинул гипотезу о существовании в природе двух противоположных классов химических веществ — кристаллоидов и коллоидов. Эта идея заинтересовала многих ученых, и во второй половине XIX в. началось бурное развитие коллоидной химии. В России в это время коллоидной химии также уделялось большое внимание, во многом под влиянием Д. И. Менделеева. Исследования температурной зависимости поверхностного натяжения органических жидкостей (1861 г.) привели Менделеева к открытию понятия критической температуры веществ. Менделеев высказал также идею о связи между поверхностным натяжением и другими свойствами вещества. В эти годы были открыты многие вещества с коллоидными свойствами, разработаны различные методы очистки и стабилизации коллоидов, созданы методы их исследования. По мере открытия новых коллоидов на смену гипотезе Т. Грэма в первой половине XX в. пришла концепция универсальности коллоидного (дисперсного) состояния вещества: «Коллоидное состояние не является обусловленным особенностями состава вещества. При определенных условиях каждое вещество может находиться в коллоидном состоянии». Эту концепцию сформулировал профессор Санкт-Петербургского горного института П. П. Веймарн в 1906–1910 гг. Он показал, что типичные коллоиды (например, желатин) можно выделить в кристаллическом виде и, напротив, из кристаллоидных веществ можно приготовить коллоидный раствор (например, поваренной соли в бензоле). Произошло смещение приоритетов коллоидной химии. Главным направлением стало изучение дисперсного (коллоидного) состояния веществ. Примерно к 1920-м гг. фундаментальные проблемы коллоидной химии условно разделили на три группы: состав, строение и свойства коллоидных частиц; взаимодействие частиц с дисперсной средой; контактные взаимодействия частиц друг с другом, приводящие к образованию коллоидных структур. В этот период были открыты основные законы коллоидной химии — закон броуновского движения и диффузии коллоидных частиц (А. Эйнштейн), гетерогенной природы коллоидных растворов (Р. Зигмонди), седиментационно-диффузионного равновесия дисперсий в поле силы тяжести (Ж. Перрен) и в центрифуге (Т. Сведберг), светорассеяния (Дж. Рэлей), коагуляции золей электролитами (Г. Шульце и В. Гарди). Появление во второй половине XX в. высокоразрешающих методов изучения строения веществ (ЯМР, электронной и атомно силовой микроскопии, компьютерного моделирования, фотон-корреляционной спектроскопии и др.) позволило перейти к систематическому исследованию строения и свойств коллоидных систем. Современное определение данной науки гласит: коллоидная химия — это учение о свойствах и превращениях веществ в дисперсном и ультрадисперсном состояниях и поверхностных явлениях в дисперсных системах. Объекты исследования коллоидной химии имеют высокоразвитую поверхность и представляют собой различные золи, суспензии, эмульсии, пены, поверхностные пленки, мембраны и пористые тела, наноструктурированные системы (нанотрубки, пленки Ленгмюра-Блоджетт, гибридные органо-неорганические композиционные материалы, нанокомпозиты).
|
|
|
Дата добавления: 2021-02-10; просмотров: 699; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
