Решить задачи используя методические рекомендации. 12 и 13 задачи решить двумя способами.
Задача 1.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: NH4Сl; определяемое вещество NH4Сl, приблизительное содержание 65 %; весовая форма AgCl, масса 0,2г.
Задача 2.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: бронза; определяемое вещество Pb, приблизительное содержание 23 %; весовая форма PbCrO4, масса 0,5г.
Задача 3.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец:
BaСl2 . 2H2O в смеси; определяемое вещество BaCl2, приблизительное содержание 60 %; весовая форма BaSO4, масса 0,1г.
Задача 4.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: Fe3O4; определяемое вещество Fe3O4, приблизительное содержание 90 %; весовая форма Fe2O3, масса 0,1г.
Задача 5.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец:
BaBr2 . 2H2O; определяемое вещество BaBr2 . 2H2O, приблизительное содержание 93 %; весовая форма BaSO4, масса 0,2г.
Задача 6.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: Na2CrO4; определяемое вещество Na2CrO4, приблизительное содержание 50 %; весовая форма PbCrO4, масса 0,1г.
|
|
|
Задача 7.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: доломит; определяемое вещество CаСО3, приблизительное содержание 80 %; весовая форма СаО, масса 0,23г.
Задача 8.
Вычислить навеску исследуемого образца, необходимого для получения определенного количества весовой формы. Исследуемый образец: суперфосфат; определяемое вещество Са, приблизительное содержание 35%; весовая форма СаСО3, масса 0,5г.
Задача 9. Рассчитайте массу навески для приготовления децинормального раствора 250,0 мл щавелевой кислоты (H2C2O4•2H2O).
Задача 10. Определите нормальность раствора KMnO4, если на титрование 10,0 мл его раствора было израсходовано 12,5 мл 0,1 н. раствора щавелевой кислоты.
Задача11. Необходимо приготовить 500 мл раствора гидроксида натрия с молярной концентрацией эквивалента 0,1 н. из раствора щелочи с массовой долей 13,28%, плотностью p=1,145 г/см3.
Задача 12. Нужно приготовить 0,02 н. раствор серной кислоты 500 мл из 0,1 н. раствора кислоты.
Задача 13. Вычислите объём 0,02 н. раствора НСl, который можно приготовить из фиксанала (0,1 моль-экв).
Сделать вывод по работе
Методические указания
|
|
|
Растворы, титр которых находят не по точной навеске, а устанавливают по тому или иному стандартному веществу, называют стандартизированными или растворами с установленным титром.
Так, нормальность раствора гидроксида натрия и перманганата натрия устанавливают по стандартному раствору щавелевой кислоты, а нормальность соляной кислоты - по исходному раствору тетрабората натрия
Приготовление рабочего раствора по неточной навеске.При этом нет необходимости отбирать точную навеску вещества, так как при всей тщательности взвешивания из таких веществ нельзя получить раствор с точной концентрацией. Поэтому для приготовления рабочих растворов навеску взвешивают на технических весах и применяют неточную мерную посуду. Для стандартизации рабочего раствора его титруют другим стандартным раствором.
Установление титров растворов — стандартизация — может быть осуществлено гравиметрическим и объемным методами. В последнем методе титр устанавливается быстрее, поэтому он в основном и используется. Точную навеску первичного стандарта (метод отдельных навесок) или раствор первичного стандарта (метод пипетирования) титруют стандартизируемым раствором. Правильность установки титра проверяют вычислением систематической ошибки установки титра.
|
|
|
4)Приготовление титрованного раствора из фиксанала.
Фиксанал - запаянная ампула, в которой находится точно известное количество вещества или раствора (0,1 моль·экв).
Содержимое ампулы количественно переводят в мерную колбу заданного объема, разбивая ампулу о вложенный в воронку боек, вторым бойком разбивают верхнее углубление ампулы, с помощью промывалки через отверстие тщательно промывают ампулу. Для промывки рекомендуется не менее, чем 6-кратный объем воды (по сравнению с вместимостью ампулы). Раствор доводят до метки дистиллированной водой и перемешивают. Из фиксанала готовят как стандартные, так и рабочие растворы. Это быстрый и достаточно точный способ приготовления титрованных растворов.
Для каждого титриметрического метода разработаны методики стандартизации применяемых титрантов, даются рекомендации по выбору первичных стандартов. Необходимо помнить, что характеристики стандартных растворов должны быть определены с необходимой точностью. Титр, молярность и нормальность определяют до четвертой значащей цифры, не считая нулей после запятой (например, TNaOH = 0,004014 г/см3 ; СKMnO4 = 0,04995 н.).
|
|
|
Р а с ч ё т м о л я р н о й к о н ц е н т р а ц и и э к в и в а л е н т о в к и с л о т ы в п р и г о т о в л е н н о м р а с т в о р е
а) Из сходящихся (различающихся не более, чем на 0,1 см3) значений объёмов раствора кислоты, израсходованных на титрование, рассчитайте среднее значение объёма и запишите его в отчет:
Vср.(кисл) = 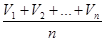 = … (см3).
= … (см3).
б) Рассчитайте молярную концентрации эквивалентов кислоты в приготовленном растворе и запишите в отчет:
сэ(кисл.) =  = … моль/дм3.
= … моль/дм3.
в) Рассчитайте относительную ошибку приготовления раствора кислоты:
e = 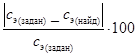 = … %.
= … %.
Практическая работа № 6
Тема: Вычисления при выполнении анализов методами оксидиметрии
Цель работы: научиться решать задачи на оксидиметрические методы анализа
Задание
Решить задачи по уровням сложности. Сделать вывод по работе.
Блок
Задача 1. Вычислить массу молярную массу эквивалента КМnО4, участвующего в реакции 2МnО4- + 5Fe2+ + 8Н+ — 2 Mn2+ + 5Fe3+ + 4Н20.
Задача 2. Сколько молей эквивалентов Н2С204 • 2Н2O содержится в 1,8908 г этого вещества? Из навески приготовлен раствор, используемый в перманганатометрии.
Блок
Задача 1. Рассчитать титр раствора NaOH, молярная концентрация эквивалента которого 0,12 моль/дм3
Задача 2. Титр раствора НСl 0,03647 г/см3. Чему равен его титр по КОН?
Задача 3. Вычислить титр раствора, содержащего 5г. Nа2СО3 в 500 мл раствора воды.
Задача 4. На титрование 25 мл раствора HCl, молярная концентрация эквивалента которого 0,124 моль/дм3, израсходовано 23,42 мл раствора КOH. Определить молярную концентрацию эквивалента раствора КOH.
Блок
Задача 1. Для анализа взято 1г Na2CO3. При титровании с метиловым оранжевым было израсходовано 48,65 см3 0,25 N раствора HCl. Определить % содержание соды в растворе.
Задача 2.
Навеска КОН массой 1,2046 г растворена в мерной колбе вместимостью 250 см3. На титрование 20 см3 полученного раствоар израсходовано 14,82 см3 0,105 N раствора HCl. Определить процентое содержание КОН в образце.
Задача 3.
Вычислить рН раствора, если при добавлениии к 100 см3 0,1N одноосновной слабой кислоты (Кд = 1,75*10-5) добавлено 50 см3 0,1N NaOH.
Задача 4. Рассчитать молярную концентрацию эквивалента раствора нитрита натрия, содержащего 13,8 г соли в 200 см3 раствора. Какой объем раствора перманганата калия с молярной концентрацией эквивалента 0,5 моль/дм3 потребуется на титрование 10 см3 исходного раствора нитрита натрия?
Задача 5. На титрование раствора пероксида водорода в кислой среде израсходовано 25 см3 раствора перманганата калия с t(KMnO4) = 0, 008 г/см3. Рассчитать массу пероксида водорода, содержащегося в исходном растворе.
Задача 6. Какую массу щавелевой кислоты Н2С2О4 · 2Н2О необходимо взять для приготовления 200 см3 раствора щавелевой кислоты с молярной концентрацией эквивалента С (½ Н2С2О4 · 2Н2О) = 0,02 моль/дм3?
Методические рекомендации
классификация методов оксидиметрии
Все методы оксидиметрии классифицируют в зависимости от окислителя или восстановителя, применяемого в рабочем растворе, на следующие виды:
1) перманганатометрия: основным титрантом служит раствор КМn04; наряду с ним обычно используются растворы сульфата железа (II) FeS04 или щавелевой кислоты Н2С2О4;
2) йодометрия: титранты - растворы йода и тиосульфата натрия Na2S203;
3) хроматометрия: основной титрант - раствор дихромата калия К2Сг207;
4) броматометрия: титрант - раствор бромата калия КВг03;
Характеристика отдельных методов
окислительно-восстановительного титрования
Таблица 1.1 – Расчет фактора эквивалентности
Дата добавления: 2021-02-10; просмотров: 115; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
