Методы исследования мужских половых клеток
УДК 591.3:611.013.1: 599
Составители: Гудошникова Т. Н., Трофимов В. А., Кудряшова В. И., Аксенова О. Н.
Рецензент − профессор кафедры биологии и спортивной медицины Мордовского государственного педагогического института им. М. Е. Евсевьева доктор биологических наук профессор О. С. Шубина
Изучение половых клеток млекопитающих: метод. рекомендации
/ сост.: Т. Н. Гудошникова, В. А. Трофимов, В. И. Кудряшова, О. Н. Аксенова. – Саранск : Изд-во Мордов. ун-та, 2011. – 36 с.
Изложены основы развития половых клеток, т.е. сперматогенез и оогенез, их отличительные особенности, морфофункциональная организация половых клеток, методики исследования их основных свойств.
Предназначено для студентов биологических и сельскохозяйственных специальностей.
© Гудошникова Т. Н., Трофимов В. А., Кудряшова В. И., Аксенова О. Н., 2011
(составление)
© Оформление. Издательство Мордовского университета, 2011
ВВЕДЕНИЕ
В учебном плане подготовки бакалавров и специалистов биологов важное место отводится биологии размножения и развития (БРР). Целью данной дисциплины является выяснение закономерностей предзародышевого развития (т.е. формирования половых клеток), всех процессов зародышевого развития, причин аномалий и возникновения уродств. Важное научно-практическое значение БРР связано с получением новых знаний о размножении и развитии на молекулярном уровне и их применении для решения актуальных проблем медицины и животноводства, остро стоящих перед специалистами в связи с развитием технологий экстракорпорального оплодотворения у людей и искусственного осеменения у сельскохозяйственных животных.
|
|
|
В связи с этим подчеркнем, что изучение половых клеток млекопитающих является важной проблемой современной биологии. Полученные данные позволяют дополнять и расширять теоретическую базу медицины и животноводства, развивать имеющие и создавать новые инструменты для решения практических задач, связанных с репродукцией. Знание частных вопросов гаметогенеза позволяет селекционерам выбирать эффективный генетический материал для создания новых пород животных. Ранняя диагностика морфофункциональных изменений половых клеток позволяет избежать нежелательных последствий, дает возможность предотвратить рождение аномального потомства.
В настоящее время все большую социальную и медицинскую значимость приобретает проблема бесплодного брака. Нарушение оплодотворяющей способности мужчин оказывается причиной бесплодного брака в 40 − 50% наблюдений. Одним из важнейших методов в оценке функционального состояния половых желез и плодовитости мужского пола является исследование спермы. Специальные методы исследования половых клеток играют важную роль в постановке и формировании окончательного диагноза.
|
|
|
В животноводстве все большее распространение получает искусственное осеменение животных, эффективность которого зависит от значительного числа факторов, зависимых от активности сперматозоидов.
В настоящих рекомендациях рассматриваются теоретические и практические аспекты изучения половых клеток, позволяющие ознакомиться с проблемами, возникающими перед биологами, медиками и зоотехниками, изучающими и использующими сперматозоиды в своей работе, а также найти некоторые пути их решения.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Развитие и размножение половых клеток
Первичные половые клетки. Клетки организма подразделяются на половые и соматические. В отличие от соматических клеток, половые гаметы (от греч. gametes – супруг) специализированы на воспроизводстве поколений организмов и имеют половинный (гаплоидный) генетический набор (lcln, или 23 хромосомы – у человека). Различают мужские и женские половые клетки, которые несут генетическую информацию по отцовской и материнской линиям. В половых клетках у человека присутствуют 22 аутосомы и 1 половая хромосома, которая обозначается как X или Y – у мужчин и X – у женщин. При слиянии мужской и женской половых клеток в процессе оплодотворения образуется диплоидная клетка – зигота, дающая начало всем клеткам нового организма. При первом знакомстве со строением зрелых мужских и женских половыхклеток обращает на себя внимание их высокая функциональная целесообразность. У большинства организмов (насекомые, позвоночные и другие) обособление половых клеток происходит на ранних этапах эмбриогенеза. В отличие от соматических клеток, половые клетки тотипотентны, т.е. сохраняют способность формировать все органы и ткани организма. Половые клетки у животных, имеющих морфологически выраженные гонады, закладываются вне гонады. С момента выделения и до вселения в гонаду их называют первичными половыми клетками (ППК). У большинства животных ППК – единственный источник зрелых гамет. ППК попадают в область зачатка гонады с током жидкости или активно мигрируя через клеточные пласты на большие расстояния посредством амебовидного движения. Миграция клеток может происходить посредством гаптотаксиса, контактного ориентирования и хемотаксиса. У некоторых видов ППК можно распознать по своеобразной морфологии (размеры, форма) либо по специфическим гистохимическим реакциям окрашивания цитоплазмы. Так, для ППК млекопитающих и птиц характерен высокий уровень активности щелочной фосфатазы. Используя метод выявления этого фермента можно проследить путь перемещения ППК вплоть до момента проникновения в гонады. Первоначально ППК присутствуют в зародыше в небольшом количестве, но они проходят ряд делений и число их возрастает. У зародышей мыши первые ППК выявляются в стенке аллантоиса и в прилегающем желточном мешке. Считается, что в этот момент ППК уже разделились на две группы, которые будут мигрировать в правую и левую гонады. Затем ППК двигаются вверх по дорсальной брыжейке, на 10 – 11-е сутки они достигают закладки гонады и дают начало линии стволовых половых клеток в гонаде. ППК могут нормально дифференцироваться в половые клетки только в том случае, если попадут в половые валики и вступят в контакт с соматическими клетками гонад, получая при этом необходимую информацию для последующей дифференцировки в оогонии или сперматогонии. Если же на своем пути ППК оказываются в окружении других зачатков и не достигают гонад, то либо гибнут, либо становятся источником тератом. Мужские и женские ППК неотличимы. Несмотря на то, что пол зародыша определяется хромосомным набором, полученным зиготой при оплодотворении, различия в их строении становятся заметными лишь при дифференцировке половой железы. Зачатки мужских и женских гонад состоят из корковой и мозговой области. В случаях развития семенников или яичников возникают различия в положении половых клеток; у самцов они располагаются в мозговой, а у самок – в корковой области, давая начало соответственно сперматогониям либо оогониям.
|
|
|
|
|
|
Гаметогенез. Развитие половых клеток – гаметогенез – происходит в семенниках или яичниках. Процесс развития мужских половых клеток называется сперматогенезом, женских половых клеток – оогенезом.
Сперматогене́з (от греч. sperma, spermatos – семя, genesis – происхождение, возникновение) представляет собой превращение первичных мужских половых клеток в зрелые сперматозоиды и происходит регулирующим влиянием гормонов. Сперматогенез можно разделить на три основные стадии: размножение клеток путем митоза, мейоз и спермиогенез. Митоз первичных половых клеток происходит на протяжении всей жизни особи мужского пола, начиная с периода полового созревания. Митотически активные клетки, находящиеся вблизи наружной стенки семенных канальцев, известны под названием сперматогоний. Сперматогонии А представляют собой популяцию стволовых клеток. В ней имеется группа темных неделящихся клеток, которые, вероятно, образуют «долгосрочный резерв». Некоторые из этих клеток превращаются в митотически активные бледные клетки, а в конечном счете – в сперматогонии В, которые делятся митотически, дифференцируются в сперматоциты 1-го порядка и вступают в мейоз. Сперматогонии В не всегда располагаются на базальной мембране. Они отличаются от сперматогоний своими округлыми ядрами, содержащими конденсированный хроматин, располагающийся либо вблизи нуклеолеммы, либо вблизи ядрышка. В их цитоплазме содержатся свободные рибосомы, митохондрии, достаточно хорошо выраженный комплекс Гольджи, гранулярный эндоплазматический ретикулум. Для превращения светлой сперматогонии в сперматогонию требуются четыре последовательных митотических деления, при которых генетически клетки не меняются, но происходит их морфофункциональная перестройка. После того как в этих клетках пройдет последнее самоудвоение ДНК, они получают название прелептотенных сперматоцитов 1-го порядка, имеющих большое ядро с хорошо видимыми обособленными хромосомами, по-прежнему содержащее их полный диплоидный набор; теперь они готовы к прохождению мейотической стадии сперматогенеза. Сперматоциты 1-го порядка, или первичные сперматоциты, соединены между собой межклеточными мостиками, которые остаются при митозе как сперматогонии А благодаря неполному разделению клеток. Последующие поколения клеток также остаются соединенными между собой, в результате чего образуется синцитий, клетки которого составляют клон. Клетки синцития делятся синхронно, лишь единичные клетки не делятся. Во время первого деления мейоза (мейоз I) каждый такой сперматоцит 1-го порядка делится на две дочерние клетки. В это время на гистологическом препарате можно наблюдать характерные фигуры разделяющихся хромосом на стадиях метафазной пластинки, анафазы, обособления ядер и образования перетяжки клеток. В результате мейоза I образуются две дочерние клетки – сперматоциты 2-го порядка, каждый из которых содержит гаплоидный набор d-хромосом ( d-хромосома – хромосома после репликации ДНК, которая состоит из двух дочерних молекул ДНК). Вторичные сперматоциты расположены ближе к просвету канальца. Во время второго деления мейоза (мейоз II) из каждого сперматоцита 2-го порядка образуются две сперматиды. Таким образом, в результате деления одной сперматогонии образуются четыре сперматиды, каждая из которых обладает гаплоидным набором хромосом (рис. 1).
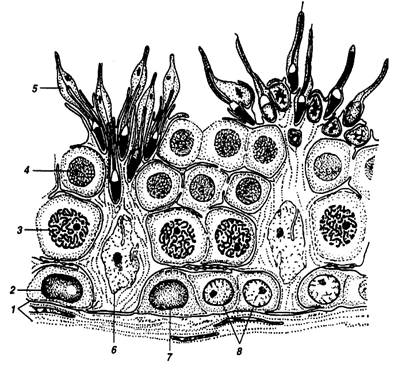
Рисунок 1 – Участок эпителия семенных канальцев, на котором показана связь между клетками Сертоли и развивающимися сперматозоидами:
1 – ограничивающая мембрана; 2 – темная сперматогония А; 3 – сперматоциты в середине пахитены; 4 – сперматиды на ранних стадиях развития; 5 – сперматиды в конце развития; 6 – клетки Сертоли; 7 – бледная сперматогония А; 8 – сперматогонии В
(Б.Карлсон; 1983)
Сперматида – мелкая клетка округлой формы с крупным ядром, которое впоследствии приобретает овоидную форму и располагается эксцентрично (ближе к стенке канальца). Процесс первого мейотического деления занимает несколько недель, тогда как второе завершается в течение 8 ч, поэтому сперматоциты 2-го порядка найти на препаратах трудно. В результате мейотической фазы сперматогенеза образуются четыре гаплоидные сперматиды, содержащие по 22 соматические и 1 половой хромосоме у человека. В отличие от образования женских половых клеток, где всегда образуются гаметы, содержащие женскую Х-хромосому, при сперматогенезе образуются различные сочетания аутосомных и половых хромосом: половина клеток содержит половую Х-хромосому, половина – Y-хромосому.
Таким образом, сперматозоиды можно условно разделить на «женские» (X) и «мужские» (Y): первые после оплодотворения дадут женский пол (XX),
вторые – мужской (XY). Суммарно из одной стволовой сперматогонии образуются 64 сперматиды. По мере созревания клетки продвигаются от базальной мембраны к просвету канальца, и в различных участках канальца можно наблюдать сперматогенные клетки на разных этапах развития и дифференцировки (рис. 1, 2) .

Рисунок 2 – Схема сперматогенеза:
1 – стенка извитого семенного канальца; 2 – поддерживающий эпителиоцит, или сустенциоцит (клетка Сертоли); 3 – сперматогонии; 4 – сперматоциты; 5 – сперматиды; 6 – сперматозоиды (по И. В. Алмазову и Л. С. Сутулову)
Важная особенность сперматогенеза заключается в том, что в ходе последовательных делений цитокинез (расхождение клеток) не доходит до конца. Клетки остаются связанными между собой посредством цитоплазматических мостиков диаметром 1 − 2 мкм, образуя синцитий. Поскольку молекулы и ионы легко проникают через межклеточные мостики, клетки такого клона развиваются синхронно. Такая связь нарушается только при достижении ими стадии сперматид.
Генетически сперматиды представляют собой конечный продукт мейоза. Но, прекращая деление, они подвергаются глубоким преобразованиям, превращаясь из относительно обычных на вид клеток в чрезвычайно специализированные – сперматозоиды.
Третий период сперматогенеза – превращение сперматид в сперматозоиды – носит название спермиогенез, или метаморфоз сперматид. В ходе сложного процесса спермиогенеза сперматиды дифференцируются в зрелые сперматозоиды. Дифференцирующие сперматиды лежат в углублениях плазматической мембраны клеток Сертоли. При спермиогенезе область ядра, обращенная к стенке семенного канальца, постепенно вытягивается и заостряется. Комплекс Гольджи формирует гранулы, которые сливаются между собой, образуя акросомальную гранулу (акробласт), контактирующую с апикальной частью ядра. Одновременно гиперплазирующиеся мешочки комплекса Гольджи окружают акросомальную гранулу, в результате чего образуется акросома, содержащая протеолитические ферменты (в основном гиалуронидазу и трипсиноподобный акрозин), которые при контакте с яйцеклеткой разрушают ее прозрачную зону. При отсутствии или недоразвитии акросомы сперматозоид теряет способность оплодотворять яйцеклетку.
Из одной центриоли начинают образовываться микротрубочки, группирующиеся сначала по три, а затем по две, к ним мигрируют митохондрии, образующие вокруг микротрубочек характерную спиральную структуру. Формируется специализированная органелла движения – жгутик. Одновременно большинство внутриклеточных структур редуцируется. В результате примерно за 16 дней круглая сперматида со сферическим ядром превращается в чрезвычайно специализированную клетку, имеющую маленькую головку длиной 5 мкм и шириной 3 мкм, подвижный хвост длиной 50 мкм, предназначенный для единственной задачи – доставки наследственного материала отца в материнскую яйцеклетку.
В процессе спермиогенеза существенно уменьшается количество цитоплазмы формирующегося сперматозоида. Большая часть ее образует остаточное тельце, которое отделяется от клетки и фагоцитируется поддерживающим эпителиоцитом, или сустентоцитом (клеткой Сертоли). Меньшая часть цитоплазмы покрывает тонким слоем ядро, связующую, промежуточную и не полностью главную части сперматозоида. Разделение клеток одного клона происходит на последних этапах формирования сперматозоидов, которые отделяются от клеток Сертоли и попадают в просвет канальца, где находится жидкость, вырабатываемая клетками Сертоли.
Сперматозоид – мужская половая клетка. Учеловека длиной около
65 мкм, имеет головку и жгутик (хвостовой конец), покрыт, словно чехлом, цитоплазматической мембраной, удлиненная и закругленная (спереди) головка (длина около 5 мкм, ширина около 3 мкм и толщина около 1 мкм) заполнена в основном ядром. С точки зрения гидродинамики, головка наиболее приспособлена для выполнения функции продвижения в жидкости половых путей женщины, проникновения в яйцеклетку и внесения в нее ДНК. Плотное ядро заполнено конденсированным хроматином, лишь некоторые участки его имеют более светлый вид – это ядерные пузырьки. Почти все ядро сперматозоида окутано акросомой, отделенной узкой щелью от цитолеммы и наружной ядерной мембраны. Ядерные поры имеются лишь в дистальном отделе ядра в области связующей части. Уплощенная, несколько вогнутая дистальная часть ядра, лежащая на базальной чашечке – тонкой пластинке мелкозернистого электронно-плотного вещества, образует сочленяющую ямку. На ультрамикроскопическом уровне в головке сперматозоида различимы акросомальная и постакросомальная зоны, в хвосте – промежуточный, главный и концевой отделы. Большую часть головки занимает ядро, заполненное конденсированным хроматином. Пространство между ядром и передним участком плазмолеммы спермия занято акросомальной вакуолью – специализированной лизосомой, содержащей группу ферментов – лизинов оболочек яйцеклетки: акрозин (разрушает прозрачную зону овоцита), пенетразу (диссоциирует клетки лучистого венца), гиалуронидазу (расщепляет гиалуроновую кислоту), кислую фосфатазу (разрушает форсхолин при прохождении спермиев через плазмолемму овоцита). Шейка спермия представляет собой короткий отдел, в котором находятся проксимальная центриоль и 9 сегментированных колонн. Жгутик, или хвостовой конец, сперматозоида состоит из связующей, промежуточной, главной и конечной (терминальной) части. Связующая часть длиной около 1 мкм, начинается базальной чашечкой, содержит проксимальную и дистальную центриоли, окруженные столбчатым основанием, образованным девятью сегментированными полосатыми столбами, являющимися отростками плотных столбов. Проксимально полосатые столбы формируют головку, которая контактирует с базальной чашечкой. От промежуточной части через весь жгутик проходит аксонема, состоящая из девяти периферических двойных и одной пары центральных микротрубочек. Каждая периферическая двойная трубочка состоит из более электронно-плотной трубочки А, снабженной двумя «ручками», и менее плотной трубочки В, лишенной «ручек». От каждой трубочки А к центральной паре отходит полоска осмиофильного вещества, содержащего сократительный белок динеин.
Через промежуточную часть длиной около 7 мкм и толщиной около
1 мкм вокруг аксонемы проходят девять плотных продольно ориентированных волокон, окруженных митохондриальным влагалищем, образованным спирально расположенными митохондриями с хорошо развитыми кристами.
Митохондрии синтезируют АТФ, необходимую для движения жгутика. До сих пор окончательно не выяснена роль плотных волокон. Возможно, они вместе с динеином участвуют в осуществлении движений сперматозоида. Плотное кольцо, связанное с цитолеммой, находится на границе между промежуточной и главной частями сперматозоида. На этом уровне заканчивается митохондриальное и начинается волокнистое влагалище. Промежуточный отдел содержит аксонему и 9 продольно ориентированных элементов цитоскелета, состоящих из кератиноподобных белков и являющихся продолжением сегментированных колонн. Кнаружи от этих волокон располагаются митохондрии. Аксонема построена по принципу реснички, биения которой инициируются катионами кальция, находящимися в окружающей среде, и митохондриальной АТФ спермия. Через главную часть жгутика длиной около 45 мкм и толщиной около 0,5 мкм проходит аксонема, окруженная лежащим под цитолеммой волокнистым влагалищем. Последнее представляет собой тонкофибриллярный чехол, состоящий из двух продольных столбов, расположенных друг против друга, от которых в обе стороны отходят циркулярно расположенные фибриллы. В проксимальной половине главной части между волокнистым влагалищем и аксонемой проходит семь плотных волокон, остальные два трансформировались в продольные столбы волокнистого влагалища. При переходе проксимальной половины главной части в дистальную плотные волокна заканчиваются, и далее аксонема окружена лишь волокнистым влагалищем, которое простирается до начала конечной (терминальной) части, образованной покрытой цитолеммой аксонемой. В самом конце жгутика описанная структура аксонемы нарушается и количество микротрубочек уменьшается. В концевом отделе хвоста элементы цитоскелета исчезают, и аксонема прикрыта лишь плазмолеммой. У человека дуплеты аксонемы в концевом отделе распадаются на 18 одиночных микротрубочек (рис. 3).
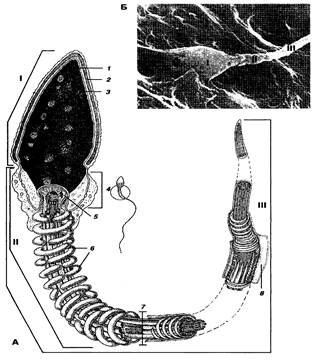
Рисунок 3 – Строение сперматозоида. А – схема, Б – электронная микрофотография; I – головка; II – средняя часть; III – жгутик; 1 – ядро, 2 – акросома; 3 – ядерная оболочка; 4 – шейка; 5 – полосатые столбы; 6 – митохондрии; 7 – аксонема; 8 – цитоплазма
Суммарно у человека развитие сперматозоидов происходит в течение 74 (73 − 75) суток, и каждый час их в яичках образуется около 100 млн штук. Однако сперматозоид, образовавшийся в яичке, еще не способен оплодотворять: жгутик пока не может самостоятельно двигаться и ферменты акросомы не «созрели» для проникновения через защитные оболочки яйцеклетки. Эти свойства сперматозоид приобретает в результате перехода через придаток яичка. Общая длина спермиев составляет 50 − 70 мкм, средний объем 16 − 19 мкм. Для каждого вида животных время, необходимое для превращения сперматогония в зрелый спермий (включая время пребывания в придатке) постоянно, хотя различия между видами существенны. Продолжительность сперматогенеза составляет: у быка – 54 дня; у хряка – 34 дня; у жеребца – 42. Сперматозоиды, закончившие формирование, попадают в систему семявыводящих путей. При совокуплении освобождаются спермии не прямо из семенника, а из каудальной части ("хвоста") придатка семенника. В канале придатка спермии накапливаются в больших количествах (20 − 40 млрд у быка). Здесь они претерпевают дальнейшие морфофункциональные изменения ("дозревают") в течение 8 − 20 дней. В кислой безкислородной среде канала придатка спермии впадают в состояние, подобное анабиозу, приобретают уплотненную липопротеидную оболочку и отрицательный заряд, что предохраняет их от действия кислых продуктов и от агглютинации в половых путях самки. Оплодотворяющую способность спермии сохраняют в придатках семенника до 2 − 3 месяцев. Достигшие каудального отдела придатка спермии обладают высокой оплодотворяющей способностью и могут высвобождаться при эякуляции. По выходе из яичка спермии морфологически сформированы, но функционально незрелы – они неподвижны, не способны к оплодотворению и, помимо этого, являются носителями ряда специфических антигенов, инактивация которых (как и приобретение подвижности и оплодотворяющей способности – капацитации) происходит в системе семявыносящих путей мужского тракта.
Оогенезом называется дифференцировка половых клеток по женскому типу. Развитие женских половых клеток у млекопитающих локализовано в женских гонадах – яичниках (локализованный оогенез). В случае локализованного оогенеза ооцит может развиться без участия вспомогательных питающих клеток (солитарный тип) или при участии специальных клеток (алиментарный тип). Солитарный оогенез встречается у некоторых кишечнополостных, червей и моллюсков. Алиментарный тип оогенеза может быть фолликулярным или нутриментарным. При фолликулярном типе оогенеза растущий ооцит окружен фолликулярными (соматическими по происхождению) клетками, которые вместе образуют функциональную структуру – фолликул. Это наиболее распространенный оогенез. Он встречается у подавляющего большинства животных, к числу которых относятся все хордовые. Фолликулярные клетки не участвуют в синтезе белков желтка, все виды РНК синтезируются в самом ооците. Среди многочисленных функций фолликулярного эпителия – проведение и селекция гетеросинтетических макромолекул, защитная, регуляторная, синтез вторичных оболочек и др. При нутриментарном типе оогенеза ооцит окружен трофоцитами, связанными с ним цитоплазматическими мостиками. Трофоциты – абортивные половые клетки, т.е. имеющие общее происхождение с ооцитом. На один ооцит приходится огромное количество трофоцитов, снабжающих половую клетку РНК. В вителлогенезе трофоциты участия не принимают: желток образуется за счет поступлений высокомолекулярных веществ из вне. У млекопитающих оогенез протекает по тому же типу, что и сперматогенез, однако имеет некоторые особенности. Женская половая клетка, завершившая развитие (яйцеклетка), обладает гаплоидным ядром, сложно организованной цитоплазмой и всеми факторами, необходимыми для инициации и поддержания развития.
В оогенезе различают 3 периода: размножение, рост и созревание.
В период размножения диплоидные оогонии совершают определенное, характерное для данного вида число митотических делений, а затем переходят к стадии роста и становятся ооцитами первого порядка (ооцит 1). Особенностью оогенеза, отличающей его от спермиогенеза, является меньшая митотическая активность оогониев. У высших позвоночных пролиферация оогониев происходит только в эмбриональный период и запас половых клеток (ооцитов) в яичниках взрослых самок не пополняется (рис. 4 ).
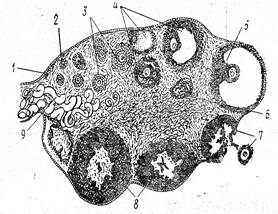
Рисунок 4 – Схема строения яичника. Последовательные стадии созревания фолликулов: 1– зачатковый эпителий, 2 – первичный фолликул, 3 – многослойный фолликул, 4 – образование полости граафова пузырька, 5 – зрелый графов пузырек, 6 – атрезия фолликула, 7 – выход яйцевой клетки, 8 – желтое тело, 9 – сосуды
В период роста осуществляются два процесса: в ядре происходит профаза мейоза, а в цитоплазме растущего ооцита 1 накапливаются органеллы, питательные вещества, источники энергии, необходимые для обеспечения потребностей зародыша. Рост ооцита неравномерен. Он длится очень долго – недели, месяцы и даже годы. В нем различают два этапа: малый рост, когда ассимилируются новые вещества и ими обогащается преимущественно цитоплазма, пропорционально увеличиваются объемы ядра и цитоплазмы. В цитоплазме накапливаются РНК, белки, рибосомы, органеллы. Этот этап продолжается до середины диплотены. В ядре происходят события, связанные с коньюгацией гомологичных хромосом и кроссинговером. Приблизительно с середины диплотены ооциты 1 вступают в период большого роста или вителлогенеза, при этом увеличивается объем цитоплазмы (в сотни, тысячи раз) и она постепенно заполняется желточными включениями. Помимо желтка в этот период откладываются углеводы, липиды, рибосомы, но основное вителлогенез. Желток представляет собой смесь белков, жиров, углеводов, основной из них белок вителлогенин. По происхождению он может быть эндогенным, синтезируемым самим ооцитом, и экзогенным, который синтезируется в печени или жировом теле. У большинства животных желточные белки относятся к экзогенным. Из вителлогенина в ооците образуется вителлин, состоящий из липовителлина и фосфитина. Вителлогенин поступает в ооцит путем пиноцитоза, в цитоплазме пиноцитозные пузырьки сливаются и образуются гранулы примордиального желтка. К ним присоединяются элементы аппарата Гольджи и формируются дефинитивные желточные гранулы. Постепенно весь ооцит заполняется желточными и липидными включениями, за исключением цитоплазмы вокруг ядра и по периферии. Ооцит увеличивается в размерах в тысячи раз. Глубокие изменения в периоде роста претерпевает и ядро, что сказывается внешне в его укрупнении. Оно сильно набухает, содержимое его как бы расплывается, а хромосомы даже могут исчезнуть из пределов оптической видимости. Размеры клеток колоссально возрастают. Затем овоцит 1-го порядка вступает в период созревания, или мейоз. Здесь же совершается редукционное и эквационное деление. Процессы деления в ядре протекают совершенно, так же как и при мейозе мужского ряда, судьба же цитоплазмы иная. При редукционном делении одно ядро увлекает с собой большую часть цитоплазмы, а на долю другого остается лишь мизерная часть. Поэтому возникает одна полноценная клетка – овоцит 2-го порядка, и вторая крошечная – направительное, или полярное тельце. При втором эквационном делении несимметричное распределение цитоплазмы повторяется и опять образуется одна крупная полноценная клетка – овотида и маленькое полярное тельце. Овотида по составу ядра и функционально является вполне зрелой. Период формирования в овогенезе отсутствует. Таким образом, в овогенезе из одной овогонии возникает только одна зрелая яйцеклетка, полярные же тельца остаются недоразвитыми, рассасываются и погибают. Зрелые женские гаметы называют яйцеклетками или яйцами, а отложенные в воду икрой.
Женская половая клетка – яйцеклетка – высокоспециализированная гаплоидная клетка организма, обладающая потенциальной способностью к развитию, в отличие от сперматозоидов, крупная и неподвижная. У большинства млекопитающих и человека ее размеры достигают 100 − 200 мкм (у человека 130 мкм в диаметре, у мыши – 60, у коровы – 100, у кроликов, кошек и собак 120 − 130 мкм). Вариации размеров в основном не зависят от количества желтка. В ее цитоплазме запасено все, что необходимо для роста и развития зародыша. Если сперматозоид в ходе спермиогенеза избавляется от большей части своей цитоплазмы, то ооцит активно накапливает различные трофические компоненты и органеллы, РНК, структурные белки, предшественники синтеза ДНК и РНК, а также желток, который служит источником питания для зародыша. Количество и распределение желтка имеют важное значение для развития. Яйцеклетки животных, у которых личинки или зародыши рано переходят на активное питание, содержат мало желтка. В тех случаях, когда яйцеклетка содержит большие запасы желтка, из яйцевых оболочек выходит вполне сформированная особь. В яйцеклетках плацентарных млекопитающих, чьи эмбрионы развиваются внутриутробно и получают питательные вещества из материнского организма, объем желтка составляет менее 5 % объема яйца. Другими словами, количество желтка определяет условия и продолжительность развития зародыша. По количеству желтка различают яйцеклетки: многожелтковые (полилецитальные), маложелтковые (олиголецитальные), содержащие среднее количество желтка (мезолецитальные), безжелтковые (алецитальные). Количество желтка видоспецифично и не зависит от условий питания самки. Желток может размещаться в клетке равномерно (изо-или гомолецитальные), поэтому различают клетки телолецитальные, у которых желток преимущественно или полностью концентрируется у вегетативного полюса, и центролецитальные, у которых он собран в центральной зоне. В случае телолецитальных яйцеклеток полюс, на котором расположен желток, называется вегетативным, а противоположный ему – анимальным. У плацентарных млекопитающих они практически не содержат желтка и характеризуются как алецитальные.
На ультрамикроскопическом уровне яйцеклетка человека имеет крупное округлое ядро, в котором преобладает эухроматин, и цитоплазму с умеренным количеством митохондрий с немногочисленными ламеллярными кристами. Хорошо развита система белкового синтеза из-за высокого содержания рибо- и полисом, коротких канальцев гранулярной эндоплазматической сети. В них отсутствует центросома. В ядрах различимы хроматиновые нити и ядрышки. В цитоплазме редко и диффузно расположены немногочисленные скопления вителлиновых гранул – коллекторов трофических включений.
У высших плацентарных млекопитающих и человека женские половые клетки не существуют изолированно. За исключением ранних стадий развития (первичных половых клеток, овогоний), они находятся в тесном контакте с соматическими клетками яичника (фолликулярными эпителиоцитами и соединительнотканными клетками), которые формируют вокруг каждой половой клетки эпителиальную и соединительнотканную оболочки. Комплекс «половая клетка – соматические оболочки» именуется овариальным фолликулом. Строение овариального фолликула усложняется в процессе овогенеза.
Кроме плазматической оболочки, характерной для каждой животной клетки, яйцеклетки обычно окружены специализированными оболочками. Различают первичные, вторичные и третичные оболочки. Первичные строятся самим яйцом. Это уплотненный наружный слой его цитоплазмы. Вторичные оболочки образуются фолликулярными клетками, окружающими половую клетку. Третичные оболочки формируются из веществ, выделяемых яйцеводами во время прохождения по ним яйца. Первичная оболочка – желточная – прилегает к поверхности яйцеклетки и присуща всем животным; иногда бывает пронизана выростами яйца, выглядит радиально исчерченной и называется zona radiata. Вторичные и третичные оболочки есть не у всех яиц (рис. 5). 3 2 1
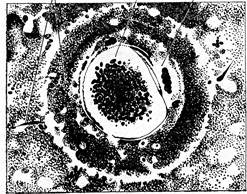
Рисунок 5 – Яйцо женщины: Яйцо (2) окружено фолликулярными клетками; видны сперматозоиды (3); некоторые проникли через барьер из фолликулярных клеток; слева видно полярное тельце (1)
ПРАКТИЧЕСКАЯ ЧАСТЬ
Методы исследования мужских половых клеток
Изучение спермальной морфологии. Спе́рма (от греч. σπερμα – семя), семя, эякулят (эйякулят) – жидкость (мутная, вязкая, опалесцирующая, светло-серого цвета), выделяемая при эякуляции (семяизвержении) самцами животных. Состоит из сперматозоидов и семенной жидкости.
Объём спермы, выделяемой при каждой эякуляции, различен у разных видов: у человека в среднем 2 − 4 мл; у быка 4 − 5 мл; у жеребца 60 − 100; у дикого кабана до 250; у барана 1 − 1,5; у кита до 3000 мл.
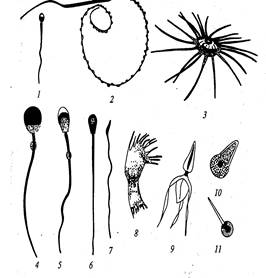
Рисунок 6 – Формы сперматозоидов человека и животных:
1 – человек; 2 – тритон; 3 – речной рак; 4 – морская свинка; 5 – свинья; 6 – бык; 7 – петух; 8 – ветвистоусый рак, 9 – десятиногий рак; 10 – лошадиная аскарида; 11 – острица
Вещества, содержащиеся в сперме: аскорбиновая кислота, кальций, характерные для каждой группы крови антитела, холестерин, холин, лимонная кислота, фруктоза, дезоксирибонуклеиновая кислота, витамин В12, глутатион, инозит, молочная кислота, спермин, мочевина, гиалуронидаза, гиалуроновая кислота, пировиноградная кислота, пиримидин, спермидин, мочевая кислота, ионы Zn2+, Cl−, Mg2+, NO3−, PO43−, K+, Na+.
Оплодотворяющее действие спермы зависит от количества и качества сперматозоидов. Количество сперматозоидов в сперме животных неодинаково (у барана − около 30 %, у быка около − 14 %, у хряка, жеребца − 7 − 8 %) и может варьироваться у одного и того же животного в зависимости от условий жизни (рис. 6). У большинства беспозвоночных и некоторых позвоночных животных (рыб, земноводных, пресмыкающихся, многих птиц и млекопитающих) наблюдается сезонность выделения спермы. При некоторых патологических состояниях организма сперма может быть лишена сперматозоидов (азооспермия), иметь их в небольшом количестве (олигоспермия), содержать неподвижные (некроспермия) или аномальные сперматозоиды (тератоспермия).
В медицине анализ спермы используют для установления причин бесплодия и для искусственного оплодотворения.
В судебно-медицинской практике анализ спермы, как и других биологических жидкостей, используется для идентификации личности.
В сельскохозяйственном производстве сперма используется при искусственном осеменении животных.
Сперма состоит из форменных элементов – спермиев, секретов придатка семенника и секретов придаточных половых желез. Порция спермы, выделяемая самцом за одну садку, называется эякулятом. Объем эякулята и концентрация в нем спермиев у самцов разных видов различны. В пределах вида это зависят от интенсивности использования производителя (частоты садок), условий кормления и содержания. При серьезных нарушениях в кормлении и эксплуатации производителей объем эякулята может снижаться ниже минимально допустимого – олигосперматизм. При глубоких поражениях половых органов, а также в результате рефлекторной задержки эякуляции (при болевых ощущениях в области конечностей, таза, поясницы) сперма может не выделяться совсем – асперматизм. Это же явление наблюдается при спазматическом сокращении выводных протоков половых органов.
Количество и внешний вид спермы, соотношение жидкой части и спермиев варьируют в зависимости от вида животных и их индивидуальных особенностей. Соотношение отдельных составных частей спермы у различных животных разное. Так, придатки семенников быка выделяют 0,6 мл жидкости с содержанием спермиев 4,9 млрд/мл и общим количеством их около
3 млрд. Спермии с секретом придатков составляют 15 % объема эякулята, секрет пузырьковидных желез – до 40 %, предстательной железы – 5 − 6,1; куперовых и уретральных желез – 35 − 40 %. Сперма содержит 85 − 98 % воды и 2 − 15 % сухого вещества.
Спермии – основная часть спермы, без них невозможно оплодотворение. Спермий состоит из головки, шейки (соединительной части), тела и хвоста (жгутика). Спермий содержат около 25 % сухого вещества и
75 % воды. Из сухого вещества 85 % составляют белки, 13,2 % – липиды и
1,8 % – минеральные вещества. В спермиях имеется также значительное количество фосфора (около 2,7 %), причем в головках содержание его доходит до 4%. В головках спермиев присутствует большое количество белков, связанных с ДНК. В акросоме установлено некоторое наличие мукополисахаридов. Остальные части спермиев (шейка, тело и хвост) состоят из белков, свободных липидов и солей. Спермии содержат ряд ферментов, принимающих участие в окислительных процессах, происходящих внутри их (рис. 4).
Часть спермы, не содержащая спермиев, называется плазмой спермы (семенной плазмой). Ее относительный объем в эякуляте зависит от вида животных (70 % у барана, 30 % у быка, 90 − 92 % у хряка и жеребца). Семенная плазма продукт в основном придаточных желез, является стабилизирующей, разбавляющей, активирующей и питательной средой для спермиев. Она стабилизирует плазменную мембрану спермиев, содержит энзимы, растворяющие акросому, простогландины, инозит, андрогены, антиагглютинины (в секрете простаты), аскорбиновую кислоту, фруктозу, лимонную кислоту. При кастрации уровень двух последних компонентов падает.
Свойства спермиев. Жизнеспособность спермиев вне организма зависит от температуры и состава жидкости, в которой они находятся. Наиболее подвижны спермии при температуре, близкой к температуре тела животных (37 − 39 ° С). Более высокая температура убивает их. При понижении температуры движение спермиев замедляется, а при температуре, близкой к 0 0 С, они переходят в состояние анабиоза. При нарушении осмотического давления в окружающей среде спермии гибнут. В гипотоническим растворах гибель спермиев наступает вследствие набухания их от проникновения внутрь воды, а в гипертонических – наоборот, в результате обезвоживания цитоплазмы. Свежеполученная сперма быка и барана имеет нейтральную (рН 7,0) или слабокислую реакцию (рН 6,7 − 6,9), сперма хряка и жеребца – щелочную (рН 7,2 − 7,6). Небольшое увеличение кислотности в сперме ведет к замедлению движения спермиев, но они остаются живыми. Избыточная кислотность прекращает движение спермиев и убивает их. Чрезмерная щелочность, достигаемая, например, добавлением соды, усиливает движение спермиев, но затем убивает их.
Дыхание −наиболее распространенный процесс у спермиев, при котором окисляются все питательные вещества – белки, жиры и углеводы с образованием энергии Н2О, СО2 и других продуктов. Этот процесс происходит под влиянием целого ряда дыхательных ферментов – цитохромоксидазы, дегидрогеназы, цитохромов и рибофлавина – составной части флавиного фермента.
Гликолиз (фруктолиз). Характеризуется выделением энергии для жизненных процессов, протекающих в спермиях без доступа воздуха. Этот процесс отличается от дыхания тем, что при нем расщепляются только отдельные сахара, такие как фруктоза и глюкоза. Фруктоза при гликолизе распадается до молочной кислоты с освобождением энергии. Распад фруктозы до молочной кислоты с освобождением энергии под влиянием ферментов проходит через следующие звенья: фруктозофосфорная кислота, фруктозодвуфосфорная кислота, фосфотриоза – фосфоглицериновая кислота, фосфопировиноградная кислота, пировиноградная кислота. Эта реакция обратима, так как часть молочной кислоты способна снова переходить в сахара.
Дыхание и гликолиз по своим энергетическим возможностям неравнозначны. Из одного моля фруктозы при дыхании образуется 680 000 кал, а при гликолизе – лишь 33 000 кал, то есть в 20 раз меньше. Дыхание является наиболее экономным с точки зрения распада углеводов и наиболее эффективным процессом, снабжающим спермии энергией.
На основании этого выделены два типа спермы: в первом (бык и баран) энергия образуется за счет процессов дыхания и гликолиза, так как в ней содержится много фруктозы (200 − 300 мг%), во втором (хряк и жеребец) энергия образуется главным образом при дыхании, так как малое содержание в ней фруктозы неспособно обеспечивать гликолиз.
Оценка качества спермы животных.Полученную от производителя сперму подвергают исследованию, чтобы определить ее пригодность для осеменения. Оценка качества спермы является важным звеном в технологическом процессе на станциях и пунктах искусственного осеменения. От качества спермы в значительной степени зависит оплодотворяемость самок. Исследованию подвергают каждый эякулят в отдельности. При взятии спермы у быков-производителей, когда берут подряд два эякулята, следует оценивать качество каждого порознь, а уже затем их можно смешать (если это необходимо). Если один из эякулятов имеет показатели ниже допустимых по инструкции, его нельзя употребить для осеменения.
Санитарная оценка спермы по внешним признакам. Сразу же после взятия эякулята определяют его объем и исследуют цвет, запах и консистенцию (эту оценку иногда называют макроскопической или органолептической). Цвет спермы зависит прежде всего, от вида животного. Нормальная сперма барана белая с желтоватым оттенком, сперма быка чаще всего белая, иногда с желтоватым оттенком, сперма жеребца и хряка серовато-белая (наподобие цвета разбавленного молока). Розовая или красноватая окраска спермы свидетельствует о примеси крови, попавшей в сперму в результате свежей травмы половых органов. Темно-красный цвет сперма приобретает при свежих разрывах мелких капилляров мочеполового канала, буро-красную – при травмах давнего происхождения. Буроватые сгустки в сперме или зеленоватая окраска ее указывает на примесь в сперме гноя. Хлопья в сперме появляются при воспалении пузырьковидных желез. Интенсивно желтый цвет спермы говорит о примеси в ней мочи. Запах спермы обычно слабый специфический. Сперма барана имеет запах жиропота. Наличие неприятного гнилостного запаха указывает на воспалительный процесс в половых органах производителя. Сперма с патологическими включениями и гнилостным запахом, а также с наличием трихомонад или бактерий (если они видны под микроскопом) непригодна для осеменения самок. Консистенция спермы зависит главным образом от насыщенности ее сперматозоидами. Нормальная сперма барана по консистенции похожа на сливки или сметану, сперма быка – на молоко, сперма хряка и жеребца имеет водянистую систему. В сперме жеребца часто бывает примесь железистого секрета пузырьковидных желез, в сперме хряка – студенисто-клейкие зерна луковичных желез. Объем эякулята быка и барана измеряют по делениям на спермоприемнике, при помощи градуированной пипетки или шприца, а также в градуированной смесительной колбе для спермы быка. Эякулят в полиэтиленовом спермоприемнике одноразового пользования взвешивают на весах. Все приспособления для измерения предварительно стерилизуют и нагревают до температуры 30 0 С, так как резкое охлаждение спермы, в особенности свежеполученной, вызывает холодовый удар и гибель сперматоцитозоидов. Для определения объема эякулята жеребца полученную сперму из спермоприемника процеживают через сложенную вчетверо стерильную марлевую салфетку в теплый (60 0 С) стерильный мерный цилиндр или мензурку и накрывают стеклянной крышкой. Тягучий секрет пузырьковидных желез, оставшийся на марле, выбрасывают, так как он мешает при работе со спермой и снижает жизнеспособность сперматозоидов. Подобным образом измеряют объем эякулята хряка, только с той разницей, что слизистые зерна секрета луковичных желез остаются на фильтре, вставленном в головку спермоприемника перед взятием спермы от производителя. Если фильтра нет, то полученную сперму процеживают через марлевую салфетку. В пластмассовых спермоприемниках объем эякулята можно определить по делениям.
Оценка спермы по густоте. Для исследования спермы под микроскопом от общего объема берут 2 − 3 мл в ермы под микроскопом от общего объема берут 2 − 3 мл в стерильный флакон из-под антибиотиков. Микроскопическая оценка спермы проводится на определение подвижности, концентрации и выживаемости спермиев. Стерильной пипеткой или стеклянной палочкой наносят на чистое сухое предметное стекло каплю спермы и накрывают ее покровным стеклом, переносят на предметный столик микроскопа, помещенный в специальный термостат с температурой 40 − 42 ° С, или на нагревательный столик, и оценивают сперму при увеличении микроскопа в 200 − 300 раз. В одной капле спермы под микроскопом одновременно определяют густоту и подвижность спермиев. Густота спермы, определяемая при глазомерной микроскопической оценке, дает приблизительное представление о количестве спермиев в 1 мл эякулята. Это субъективная оценка, ошибка может достигать 25 − 30 %. Густая сперма (условное обозначение Г) соответствует концентрации 200 млн и больше спермиев в 1 мл – все поле зрения микроскопа густо заполнено спермиями. Средняя сперма (условное обозначение С) соответствует концентрации от 100 до 200 млн спермиев в 1 мл − заметны промежутки между спермиями. Редкая сперма (условное обозначение Р) соответствует концентрации менее 100 млн спермиев в 1 мл − заметны большие промежутки между спермиями. Глазомерная оценка концентрации спермы по густоте расположения спермиев ориентировочна и по ней не может быть установлена степень разбавления спермы (рис. 7, 8, 9).

| 
|
| Рисунок 7 – Густая сперма (Г) | Рисунок 8 – Сперма средней густоты (С) |
|
| |
| Рисунок 9 – Редкая сперма (Р) | |
Сперму исследуют при температуре 38 − 40 ° С, для чего используют термостаты или обогревательные столики.
Оценка спермы по интенсивности дыхания. П риборы и материалы. Микроскоп, стеклянная трубка диаметром 0,8 − 1,0 мм (можно использовать трубку от шприца-катетера), предметные стекла, 2 глазные пипетки, стеклянные палочки, песочные часы, 0,01% раствор метиленовой синьки, белая бумага, салфетки. Активность спермы оценивают по скорости обесцвечивания (восстановления) метиленовой синьки, смешанной со спермой (методика Н. П. Шергина). При дыхании спермии потребляют кислород, растворенный в смеси, в результате этого синька обесцвечивается. Интенсивность дыхания зависит от концентрации и активности спермиев. Спермии, способные к прямолинейно-поступательному движению, имеют более высокую активность жизненных процессов и дыхания. Следовательно, чем выше концентрация спермиев и чем большее их количество способно к прямолинейно-поступательному движению, тем быстрее расходуется кислород, скорее происходит обесцвечивание метиленовой синьки и, соответственно, выше качество спермы. Оценку качества свежеполученной спермы по скорости обесцвечивания метиленовой синьки проводят при температуре 18 − 22 0 С, т.к. понижение температуры замедляет интенсивность энергетических процессов и дыхания спермиев. При снижении температуры на 10 0 С интенсивность дыхания уменьшается примерно вдвое, а при 0 0 С почти прекращается.
Приготовление 0,01% раствора метиленовой синьки. 0,5 г синьки растворяют в 200 мл 1% раствора хлористого натрия и настаивают три дня. Затем готовят рабочий раствор: к 1 части раствора синьки добавляют 9 частей 1% раствора хлористого натрия.
На предметное стекло глазной пипеткой нанести по одной капле краски и спермы и быстро смешать их стеклянной палочкой. Смесь набрать в стеклянную трубочку, чтобы столбик ее был длиной около 2 см. Трубку положить на лист белой бумаги и наблюдать за обесцвечиванием синьки. Обычно она обесцвечивается в середине столбика. На концах столбика могут оставаться голубые кольца, т.к. с концов смесь постоянно обогащается кислородом воздуха. Для оценки качества спермы жеребца и хряка этот метод не используется, поскольку обесцвечивание смеси метиленовой синьки со спермой затягивается до 60 мин.
Определение процента живых спермиев.Приборы и материалы. Микроскоп, обезжиренные предметные стекла, шлифованные покровные стекла, пипетки, стеклянные палочки, раствор эозина, 96 % спирт, салфетки. Оболочка спермиев, у которых энергично протекают обменные процессы, не пропускает в протоплазму лабораторные краски, поэтому живые спермии не окрашиваются. Мертвые и ослабленные с колебательным движением спермии легко пропускают краску внутрь и, следовательно, окрашиваются этой краской. Наличие в сперме мертвых и патологически измененных спермиев снижает качество спермы.
Активность (подвижность) спермы, т. е. процент живых нормальных спермиев, определяют путем ее глазомерной оценки под микроскопом –движущихся и неподвижных спермиев. При этом различают три вида движения спермиев: поступательное – спермии двигаются только по прямой линии вперед; колебательное – спермии не перемещаются, а только изгибаются на одном месте; манежное – поступательное движение спермиев хотя и происходит, но по кругу небольшого диаметра, а не по прямой, как при поступательном движении.
Сперма, в которой спермии имеют только колебательное движение, или кружатся на одном месте, или совсем не обнаруживают движения, непригодна для осеменения.
Для правильной оценки спермы необходимо пользоваться микротермостатом, обогревательным столиком или поставить микроскоп с препаратом спермы в ящик-термостат из фанеры, обогреваемый помещенной в него электрической лампой, которая дает освещение для микроскопа и поддерживает температуру на уровне 38 − 40 ° С. Чтобы поддерживать температуру на определенном уровне, в термостате устраивают вентиляционное окно. Контролируют температуру термометром, вставленным в отверстие термостата.
Активность (подвижность) спермиев оценивают по десятибалльной шкале. Для оценки спермы (сразу после ее взятия) из спермоприемника берут пипеткой или стеклянной палочкой небольшую каплю спермы и осторожно накрывают покровным стеклом. Препарат кладут на столик микроскопа и глазомерно определяют количество (процент) движущихся спермиев. При оценке 9 баллов – 90 % спермиев имеют прямолинейное поступательное движение; 8 баллов – 80 % и т.д.спермиев. Если один спермий с прямолинейным поступательным движением приходится на несколько неактивных (мертвых, с манежным и колебательным движением), активность (подвижность) спермиев обозначают буквой К; сперма, в которой спермии совсем не движутся, обозначается буквой Н (некроспермия). В журнале (карточке) по использованию производителя окончательная оценка спермы обозначается по двум показателям: густоте спермы (количеству спермиев) и подвижности спермиев (рис. 10).
Высшую оценку (10 баллов) получает сперма, в которой практически почти все (100 %) спермии имеют прямолинейное поступательное движение.
Например, Г-10 – сперма густая, около 100 % спермиев с прямолинейным поступательным движением; С-8 – сперма средняя, около 80 % спермиев имеют прямолинейное поступательное движение.


Спермии с поступательным движением Спермии мертвы
Рисунок 10 – Оценка спермы по подвижности спермиев: а – 10 баллов; б – 8 баллов; в – 6 баллов; г – 4 балла; д – 2 балла; е – Н (некроспермия)
Различие живых и мертвых спермиев по окраске.Этот объективный метод впервые был предложен В. А. Морозовы и основан на том, что живые спермии, способные поступательно двигаться, не воспринимают красок. Мертвые же спермии, а также, по-видимому, с колебательным движением легко окрашиваются.
Техника определения количества мертвых и живых спермиев заключается в следующем. На обезжиренное спиртом и эфиром предметное стекло наносят небольшую каплю спермы, добавляют к ней каплю 5 % водного раствора эозина, 1 − 2 с перемешивают стеклянной палочкой и делают тонкий мазок, чтобы он высох в течение минуты. Все это надо выполнять очень быстро, чтобы живые спермии не погибли и не восприняли окраску, прежде чем высохнет мазок.
Высохший мазок немедленно просматривают под микроскопом. Спермии, бывшие в момент смешения с краской живыми, хорошо выделяются на розовом фоне своей белой неокрашенной головкой. Мертвые спермии окрашиваются в розовый цвет. Производят подсчет 500 спермиев подряд, отмечая при этом число окрашенных, и вычисляют процент живых и мертвых спермиев. При навыке этот способ дает точные результаты и заслуживает широкого распространения.
Определение содержания патологических форм спермиев. Определение числа уклоняющихся (патологических) форм спермиев имеет большое практическое значение, так как при значительном количестве в эякуляте таких спермиев резко снижается оплодотворяющая способность спермы (рис. 11).
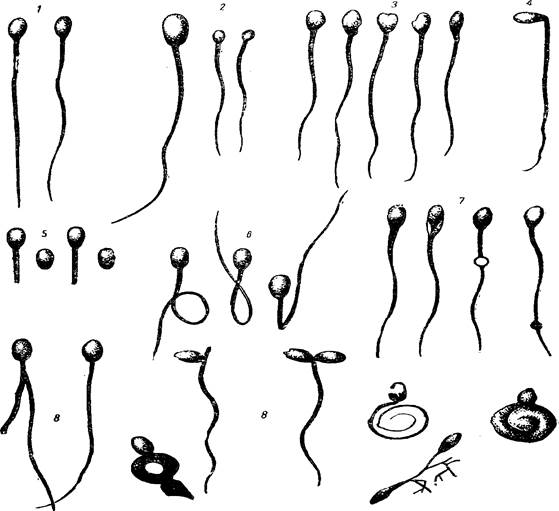
Рисунок 11 – Нормальные и уклоняющиеся (патологические) формы спермиев:
1 – нормальные; 2 – гигантские и карликовые; 3 – с деформацией головки; 4 – с надломом шейки; 5 – свободные (но нормальные по форме) и бесхвостные спермии; 6 – с закручиванием и ненормальным искривлением хвоста; 7 – спермии с каплей и утолщением хвоста; 8 – прочие патологические формы
Азооспермия – отсутствие спермиев в эякуляте. Олигоспермия – в сперме имеется небольшое количество спермиев, иногда с хорошей подвижностью, но плохой выживаемостью. Некроспермия – неподвижность спермиев в свежеполученной сперме. Тератоспермия – появление большого количества патологических спермиев.
Даже в хорошей сперме можно обнаружить спермии, уклоняющиеся в своем строении от нормы: гигантские и карликовые, с деформацией головки, двумя головками, с надломом у шейки, двухвостые, спермии с неправильным телом и закрученным хвостом и т. д. Наличие в эякулятах большого числа уклоняющихся (патологических) форм спермиев свидетельствует о заболевании семенников, выводящих путей и придаточных половых желез.
Способы подготовки обезжиренных стекол. 1. Чистые стекла выдерживают в смеси спирта и эфира (соотношение 1:1) в течение суток. Затем извлекают и протирают насухо. 2. После тщательного мытья в растворе детергента предметные стекла промывают в дистиллированной воде, протирают, заворачивают в бумагу – и выдерживают в сушильном шкафу не менее 30 минут. 3. Полевой способ. На холодную поверхность электроплиты помещают в один слой чистые стекла. После того как стекла раскалятся, плиту выключают. Дают стеклам остыть. Рецепт краски. В 100 мл дистиллированной воды растворяют 1,7 г эозина и 3 г цитрата натрия. На обезжиренное предметное стекло нанести 1 каплю семени и 1 − 2 капли краски эозина. Капли смешать и ребром шлифованного стекла сделать тонкий ровный мазок. Он должен быстро высохнуть на воздухе. Активные спермии, сохранившие избирательную способность мембран, отталкивают краску и не окрашиваются, неактивные окрашиваются в красный или розовый цвет. Просмотреть мазок под микроскопом. В каждом поле зрения следует подсчитать количество нормальных и патологических, или живых и мертвых, спермиев. Рекомендуется подсчитать не менее 500 спермиев. Вычисляют процент неактивных спермиев, он не должен превышать у барана – 14, быка – 18, у жеребца и хряка – 20.
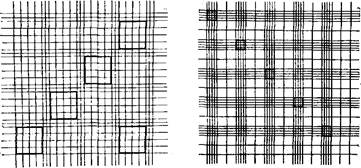
Определение концентрации спермиев в сперме. Количество спермиев в полученном эякуляте более точно можно определить посредством счетных камер с сеткой Тома, Горяева, Бюркера и Ключарева − Предтеченского, применяемых в медицинской практике для подсчета форменных элементов крови (рис. 12).
1 2
 3
3
Рисунок 12 – Сетка счетных камер: 1 – Тома, 2 – Горяева, 3 – Бюркера
Камеры состоят из толстого стекла с нанесенными на нем поперечными прорезями, образующими три поперечно расположенные плоские площадки. Средняя площадка продольной прорезью разделена на две, каждая из которых имеет выгравированную на ней сетку. По обе стороны средней площадки расположены две другие, которые на 0,1 мм выше средней. Плоскости этих площадок служат для притирания покровного стекла.
Когда покровное стекло плотно притерто к предметному стеклу до появления радужных колец, на месте выгравированной сетки создается камера, закрытая с двух сторон. С других двух сторон остаются капиллярные щелевидные отверстия, через которые камеру заполняют спермой.
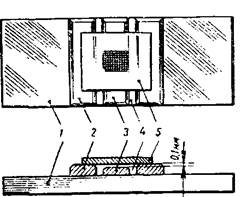
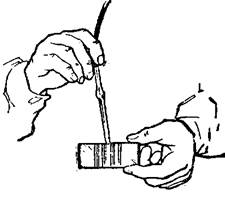
Счетные камеры различаются между собой размером площадки сетки и группировкой квадратов. Постоянной резиновую трубку, лаборант насасывает необходимое количество спермы, обтирает кончик смесителя мягкой чистой салфеткой, а затем набирает в него 3 % раствор хлористого натрия, который умерщвляет спермиев и разбавляет сперму, что облегчает подсчет (рис. 13, 14).
| 
|
| Рисунок 13 – Счетная камера для подсчета спермиев: 1– предметное стекло, 2 – опорные стеклянные пластинки, 3 – стеклянная пластинка с сеткой, 4 – желобок, 5 – покровное стекло | Рисунок 14 – Заполнение сетки счетной камеры для подсчета спермиев |
Затем оба конца смесителя зажимают пальцами (большим и указательным правой руки) и в течение 2 − 3 мин переворачивают его вверх и вниз (встряхивают). Находящаяся в смесителе сперма смешивается с раствором хлористого натрия. После этого из смесителя выпускают четыре-пять капель эритроцитный меланжер. Внутри него обычно находится красная бусинка. Эритроцитный меланжер позволяет разбавлять сперму в 100 или 200 раз. На стенке имеются деления – метки: 0,5; 1,0 и 101. Второй меланжер лейкоцитный. Внутри него находится белая бусинка. Этим меланжером сперму разбавляют в 10 − 20 раз; его применяют для разбавления более редкой спермы (хряка, жеребца).
Подготовка спермы к подсчету спермиев в счетной камере. Перед тем как набрать сперму в смеситель, на верхний его конец, имеющий расширение, надевают резиновую трубку. Кончик смесителя обтирают чистой салфеткой и наносят каплю спермы на среднюю пластинку камеры. По щелевидным капиллярным отверстиям сперма проникает под покровное стекло и заполняет сетку. При этом на сетке камеры не должно быть воздушных пузырей, так как это мешает точности подсчета.
Подсчет спермиев. Концентрация спермиев выражается числом их в
1 мм3 спермы в миллионах или в 1 мл спермы в миллиардах и обозначается буквой С. Для определения концентрации спермиев заполненную спермой счетную камеру осторожно переносят на предметный столик микроскопа, который должен иметь горизонтальное положение. При слабом увеличении на стекле находят сетку. Спермии подсчитывают при таком увеличении (в 400 − 600 раз), чтобы в поле микроскопа помещался один большой квадрат. В счетной камере Тома спермии подсчитывают в четырех больших квадратах, расположенных по диагонали сетки, и в одном квадрате в углу (рис. 15).

Рисунок 15 – Порядок подсчета спермиев в одном квадрате
В камерах Горяева и Ключарева − Предтеченского спермии подсчитывают в пяти больших квадратах, расположенных по диагонали сетки, считая в каждом квадрате 16 малых квадратиков. Таким образом подсчитывают спермии, находящиеся в 80 малых квадратиках.
При пользовании счетной камерой с сеткой Бюркера число спермиев подсчитывают в 80 малых квадратах, начиная сверху. Один малый квадрат в правом нижнем углу не принимают во внимание.
В каждом маленьком квадратике подсчитывают спермии, головки которых лежат в данном квадратике и размещены на верхней и левой линиях квадрата. Спермиев, расположенных на нижней и правой линиях, в число спермиев данного квадратика не включают. Число спермиев каждого квадратика записывают, а затем складывают. Для подсчета удобно пользоваться счетчиками для форменных элементов крови. Затем производят пересчет числа спермиев в 1 мм3. Так как площадь каждого маленького квадратика составляет 1/400 мм2, то для перевода на 1 мм2 следует подсчитанное в 80 малых квадратиках число спермиев умножить на 5, а для перевода на 1 мм3 – еще на 10 (так как глубина камеры 0,1 мм) и, наконец, на степень разбавления. Для определения числа спермиев в 1 мл (1 см3) число их в 1 мм3 умножают на 1 000.
Расчет числа спермиев производят по формуле
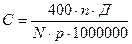 ,
,
где n – число подсчитанных спермиев; Д – степень разбавления; N – число сосчитанных малых квадратов (80); р – глубина камеры, мм.
Множитель 400 введен в формулу потому, что площадь малого квадратика равна 1/400 мм2. Следовательно, для перевода на 1 мм2 необходимо подсчитанное число спермиев умножить на 400. Полученная в формуле величина С (концентрация спермиев) разделена на 1 000 000, поэтому получается содержание спермиев в миллионах на 1 мкл (мм3), или, что то же, в миллиардах на 1 мл (см3).
Чтобы получить более точные данные, при определении концентрации спермиев рекомендуют повторить смешение и подсчет спермиев произвести дважды. Расхождение результатов должно быть в пределах не более 10 %. Если оно больше 10%, то производят подсчет в третий раз и берут среднее из двух подсчетов, расходящихся не более чем на 10 %.
Для определения концентрации спермиев в сперме жеребца во Всесоюзном научно-исследовательском институте коневодства разработаны стандарты. Стандарты представляют собой шесть запаянных пробирок, в которые налита жидкость, имитирующая сперму жеребца. В каждой пробирке жидкость по мутности соответствует сперме с концентрацией в 10, 50, 100, 200, 300 и 500 млн спермиев в 1 мл. К стандартам приложены две пустые пробирки такого же диаметра, как и пробирки с жидкостью.
Определение концентрации сперматозоидов по стандартам производится следующим образом: в пустую пробирку наливают сперму и просматривают на свет, сравнивая со стандартными пробирками. Подбирают стандарт, наиболее близкий по мутности к определяемой сперме, и указанную на пробирке концентрацию принимают за концентрацию исследуемой спермы. Может быть и промежуточная концентрация, например 75 млн (мутнее 50, но прозрачнее 100). Если сперма густая и концентрация спермиев больше 500 млн в 1 мл, то ее можно разбавлять глюкозной средой в 2 раза и затем определить ее концентрацию по стандартам, умножив на 2 полученный результат.
К комплекту стандартов приложена стеклянная палочка, которую прикладывают к обратной стороне просматриваемых пробирок. По степени видимости палочки удобнее установить сравнительную степень мутности спермы и стандартов.
Определение концентрации спермиев с помощью фотоэлектроколориметра. В лабораториях племпредприятий (станций) по искусственному осеменению сельскохозяйственных животных для определения концентрации спермиев пользуются фотоэлектроколориметром ФЭК-4. Методика пользования фотоэлектроколориметром дается в прилагаемом к прибору руководстве.
Пользуясь фотоэлектроколориметром, можно легко и быстро определить концентрацию спермиев в сперме. На исследование одной пробы спермы затрачивается не более 2 − 3 мин, что позволяет, не задерживая технической обработки, определить концентрацию спермиев каждого эякулята, поступающего в лабораторию. Фотоэлектроколориметрический метод определения концентрации спермиев в сперме основан на способности спермы ослаблять пропускаемый через нее пучок света пропорционально ее концентрации. Чем выше концентрация спермиев в сперме, тем сильнее ослабляется пучок света. Применение приборов, способных регистрировать изменения силы светового пучка в относительных единицах, позволяет судить о величине концентраций исследуемых образцов спермы.
Концентрацию спермиев можно определить также при помощи эритрогемометра.
Определение абсолютного показателя выживаемости спермиев . Абсолютный показатель выживаемости спермиев определяется с помощью разведения спермы. Сперму, разбавленную в различное число раз, хранят при 0 ° С (с предосторожностями против шока при охлаждении). Для разбавления употребляется синтетическая среда, например глюкоза безводная – 30 г для быка и 8 г для барана, натрий цитрат 3-замещенный 5-водный – 14 г для быка и 28 г для барана, желток куриного яйца – 120 мл для быка и 150 мл для барана, вода – 1 л. Можно пользоваться и другой средой.
Различные разбавления спермы готовят так. В 11 пронумерованных мелких пробирок наливают: в 1-ю – 0,5 мл неразбавленной спермы, а в остальные 10 – по 0,5 мл синтетической среды. Затем во 2-ю пробирку приливают 0,5 мл неразбавленной спермы. Перемешав содержимое 2-й пробирки, из нее берут 0,5 мл смеси и переносят в 3-ю пробирку. Перемешав, из 3-й пробирки берут 0,5 мл смеси и переносят в 4-ю пробирку и так продолжают до последней. Получается в 1-й пробирке неразбавленная сперма, а в остальных – разбавленная в 2, 4, 8, 16, 32, 64, 128, 256, 512 и 1024 раза (из последней 11-й пробирки 0,5 мл смеси выливают). В пробирках сразу же и в последующие дни ежедневно проводят оценку активности спермиев (в одно и то же время). Оценку проводят под микроскопом при 40 °, смешивая при этом каплю спермы из пробирки с каплей 3% цитрата.
Оценки проводят до прекращения поступательного движения спермиев. Абсолютный показатель выживаемости (S) вычисляют по формуле
S=Σat,
где Σ – знак суммы; а – активность спермы; t – показатель времени, подсчитанный по формуле
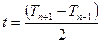 ,
,
где Tn+1 – часы от начала опыта до следующего определения; Tn − 1 – часы от начала опыта до предыдущего определения.
Вычисления производят для каждого определения и получают суммы.
Хорошая сперма быка и барана должна иметь абсолютный показатель выживаемости спермиев при разбавлении спермы в 16 − 32 раза не ниже
1 400 (может быть 3600 и выше), сперма хряка – не ниже 900, сперма жеребца – не ниже 400.
Количественное определение содержания лецитиновых зерен. Для точного количественного определения содержания лецитиновых зерен применяется следующая методика: полученный материал вдвое разводится дистиллированной водой с добавлением 1 капли метиленового синего для лучшей дифференциации лецитиновых зерен. После тщательного перемешивания капля образованной взвеси переносится в камеру Горяева. Производится подсчет лецитиновых зерен в 100 больших квадратах, что соответствует 1 600 маленьким квадратам. Для подсчета используется формула
X=Y×4000×1000×2/1600=Y×5000,
где Х – число лецитиновых зерен в 1 мл эякулята, Ү – число лецитиновых зерен в 100 больших квадратах камеры Горяева, 1 600 – число малых квадратов в 100 больших, 1/4000 – объем одного малого квадрата. Для определения количества лецитиновых зерен в 1 мл эякулята необходимо число лецитиновых зерен в 1 мл камеры Горяева умножит на 5 000.
Спермограмма – исследование эякулята (спермы) мужчины под микроскопом. Это основной и фактически единственный анализ, который позволяет оценить способность мужчины к зачатию ребенка. Но при этом также следует заметить, что никакое отклонение от нормы показателей спермограммы не может означать полной невозможности зачатия. Любые отклонения показателей спермограммы от нормы могут вести лишь к снижению вероятности зачатия естественным путем, но никак не к полному отсутствию такой вероятности.
Техника исполнения анализа.Эякулят оценивают внешне на глаз, затем наносят на предметное стекло и исследуют под микроскопом.
Значение результатов анализа.
Объем эякулята. Норма − 3 − 5 мл. Снижение объема эякулята чаще всего свидетельствует о недостатках транспортировки материала и поэтому большого диагностического значения не имеет. Если на исследование доставлен весь полученный материал и выявляется снижение его объема, это может свидетельствовать о недостаточной функции половых желез – предстательной железы, семенных пузырьков и некоторых других, что в свою очередь может быть проявлением сниженного уровня мужских половых гормонов в крови. Превышение объема спермы иногда бывает связано с воспалительным процессом перечисленных желез, главным образом с простатитом и везикулитом.
Цвет. Норма − белый, сероватый, желтоватый. Появление красного или бурого оттенка эякулята может быть связано с примесью крови в сперме, что бывает при травмах половых органов, хроническом везикулите, калькулезной форме простатита. Желтый цвет спермы может быть обусловлен употреблением пищевых красителей или приемом некоторых лекарственных препаратов. В этом случае большого диагностического значения этот показатель не имеет.
РН. Норма − 7,2 − 7,8. Отклонение от нормы может быть связано с воспалением половых желез, в первую очередь с простатитом или везикулитом.
Время разжижения. Норма − до 60 мин. Повышение времени разжижения может быть следствием длительного хронического воспаления половых желез – хронического простатита или везикулита. Реже увеличение времени разжижения бывает связано с ферментной недостаточностью организма. В результате увеличения времени разжижения сперматозоиды дольше набирают свою полноценную подвижность. Это приводит к их более длительному контакту с кислой средой влагалища, что резко снижает их шансы на проникновение в матку и на оплодотворение. Этот показатель спермограммы имеет прямую связь с вероятностью зачатия.
Вязкость спермы. Вязкость спермы определяется по длине нити, которую сперма образует, стекая с пипетки или специальной иглы. Длина нити измеряется в сантиметрах. Норма − до 0,5 см. Увеличение вязкости спермы чаще всего бывает связано с хроническим воспалением половых желез – простатитом и везикулитом. Повышенная вязкость спермы ведет к затруднению передвижения сперматозоидов во влагалище, к более длительному контакту с кислой средой влагалища, что значительно снижает шансы на оплодотворение. Этот показатель спермограммы напрямую связан с вероятностью зачатия.
Концентрация сперматозоидов. Норма − более 20 млн в 1 мл эякулята. Снижение концентрации сперматозоидов носит название олигозооспермия. Чаще всего олигозооспермия указывает на сниженную эффективность работы яичек, что может быть связано со снижением уровня мужских половых гормонов в крови, воспалительным процессом в яичках, перенесенным воспалительным или токсическим поражением сперматогенного эпителия яичек, состоянием иммунитета, изменением обмена веществ и некоторыми другими факторами. Полностью причины, ведущие к снижению концентрации сперматозоидов, не изучены. Этот показатель спермограммы один из самых важных, он напрямую связан с возможностью зачатия естественным путем. Некоторые лаборатории рассматривают показатель полизооспермии – увеличение концентрации сперматозоидов более 120 млн/мл. Существует мнение, согласно которому полизооспермия является предшественником олигозооспермии у ряда пациентов. Предполагается, что пациенты с полизооспермией нуждаются в наблюдении андрологом и в периодическом проведении контрольных спермограмм. Однако на возможность оплодотворения в настоящий момент такой результат не влияет.
Количество сперматозоидов. Норма − более 60 млн в эякуляте. Причины снижения количества сперматозоидов те же, что и причины снижения их концентрации.
Подвижность сперматозоидов.Подвижность сперматозоидов также является одним из самых важных показателей спермограммы, результат которого напрямую влияет на вероятность зачатия естественным путем. В зависимости от подвижности сперматозоиды делятся на 4 группы: группа А – активноподвижные с прямолинейным движением, группа В – малоподвижные с прямолинейным движением, группа С – малоподвижные с колебательным или вращательным движение, группа D – неподвижные. Норма − А > 25 % или A+B > 50 %. Снижение подвижности сперматозоидов носит название астенозооспермия. Причины ее весьма разнообразны – от различных заболеваний (воспалительные заболевания половых желез, варикоцеле и другие) до различного рода токсических и тепловых воздействий на яички. Существует мнение, что к снижению подвижности приводит поражение инфекцией передающейся половым путем – уреаплазмой. Однако способность уреаплазмы действовать непосредственно на сперматозоиды и снижать их способность к движению не доказана.
Морфология сперматозоидов.Этот показатель отражает процент нормальных форм сперматозоидов, способных к оплодотворению. С вероятностью зачатия естественным путем он напрямую связан. Норма − более 20 %. Снижение количества нормальных форм сперматозоидов носит название тератозооспермия. Это часто наблюдается при токсических и радиационных поражениях органов мошонки, реже при воспалительных или перенесенных инфекционных заболеваниях. На морфологию сперматозоидов сильное влияние оказывает экология в регионе проживания мужчины.
Живые сперматозоиды. Процент живых сперматозоидов в эякуляте напрямую связан с возможностью зачатия естественным путем. Норма − более 50 %. Снижение количества живых сперматозоидов носит название некроспермия. Это встречается в первую очередь при радиационном, токсическом или тепловом поражениях ткани яичек, реже при инфекционных заболеваниях и воспалении половых желез. Есть данные о том, что одномоментно возникшую некроспермию может вызвать сильный стресс.
Клетки сперматогенеза.Это слущенные клетки сперматогенного эпителия семенных канальцев яичек. Норма − до 2 %. Повышение количества клеток сперматогенеза свидетельствует о воспалительном, инфекционном или ином поражении ткани яичек, что свидетельствует о секреторной форме мужского бесплодия.
Агглютинация – склеивание сперматозоидов между собой. Норма − отсутствие явления. Агглютинация сперматозоидов может быть проявлением нарушения иммунной системы, аутоиммунных воспалительных процессов. Также агглютинация может проявляться при хронических воспалительных процессах в половых железах мужчины. Возникновение агглютинации само по себе не снижает вероятность зачатия естественным путем, но оно почти всегда ведет к снижению подвижности сперматозоидов.
Агрегация – скопление сперматозоидов в большие сгустки. Норма − отсутствие явления. Агрегация сперматозоидов может происходить при длительном хроническом воспалении половых желез, чаще всего она появляется одновременно с повышением времени разжижения и вязкости эякулята. Сама по себе агрегация не влияет на вероятность зачатия естественным путем, но выраженная агрегация может резко нарушать подвижность сперматозоидов.
Лейкоциты −белые кровяные тельца − в определенном количестве должны присутствовать в эякуляте. Норма − до 106 в 1 мл (до 3 − 4 в поле зрения). Повышение количества лейкоцитов является признаком острого или хронического воспалительного процесса в органах малого таза мужчины. Само по себе это не влияет на вероятность зачатия естественным путем, но чаще всего ухудшает почти все другие показатели спермограммы.
Эритроциты − красные кровяные тельца крови. В норме отсутствуют. Появление эритроцитов в эякуляте может быть признаком травмы, опухолевых заболеваний половых органов, наличия камней предстательной железы, хронического простатита или везикулита. Показатель не оказывает влияния на возможность зачатия естественным путем, но может быть признаком серьезного заболевания органов малого таза.
Амилоидные тельца −специфические образования, формирующиеся в предстательной железе. В норме присутствуют. Отсутствие амилоидных телец может быть свидетельством снижения функции предстательной железы, что чаще всего встречается при ее длительно текущем хроническом воспалении. Этот показатель не оказывает непосредственного влияния на возможность зачатия естественным путем.
Лецитиновые зерна вырабатываются предстательной железой. В норме присутствуют. Отсутствие лецитиновых зерен в эякуляте свидетельствует о снижении функции предстательной железы, что возможно при ее длительном хроническом воспалении. Этот показатель не оказывает непосредственного влияния на вероятность зачатия естественным путем.
Слизь.В норме отсутствует или наблюдается небольшое количество. Большое количество слизи чаще всего появляется при выраженном воспалительном процессе половых желез.
Дата добавления: 2021-01-21; просмотров: 145; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

