Ответ для проверки: Взорвётся. Подтвердить решением.
Лекция №1
Тема « Предмет и задача физической химии»
Задание на дистанционное обучение: Конспектируем лекции. Закрепляем знания решением задач. Ответы выслать в виде фото на эл. адрес rusnk_55@mail.ru В отправлении на первой странице отчета Крупно написать фамилию свою с именем
В физической химии рассматриваются явления, протекающие на стыке физики и химии.
Развитие химической термодинамики показало, что взаимосвязь строения вещества с его химическими свойствами принципиально не может быть однозначной величиной.
Помимо строения вещества на протекание химических процессов влияют внешние условия - давление и температура, без учёта воздействия которых невозможно указать направление реального пути химического превращения.
Применение законов и методов физической химии имеет огромное значение в металлургии.
Агрегатное состояние вещества
Большинство веществ при определённых условиях может находится в одном из трёх агрегатных состояний - в газообразном, жидком, твёрдом.
При значительном расстоянии силы взаимодействия между молекулами невелики, и молекулы могут совершать поступательное движение. Этим условиям соответствует газообразное состояние при котором объём газа принимает любые размерю.
Если расстояние между частицами вещества малы, то между ними действуют значительные силы притяжения и противоположные по направлению силы отталкивания. Результатом взаимодействия этих сил является расположение частиц одной относительной другой в определённом порядке с образованием кристаллической решётки. Такое расположение характерно для твёрдых веществ.
|
|
|
Переходным между твёрдым и газообразным состоянием является жидкое состояние вещества, в котором расстояние между частицами малы, однако силы взаимодействия не настолько велики, чтобы прекратить поступательно движение частиц.
Как и газы жидкости принимают форму сосуда.
Агрегатное состояние веществ определяется условиями, в которых они находятся, при этом важнейшим из них являются температура и давление. Изменение условий сопровождаются фазовыми переходами.
Агрегатные превращения сопровождаются выделением или поглощением теплоты.
При плавлении или испарении всегда поглощается теплота, при конденсации и кристаллизации - теплота выделяется.
При этих фазовых переходах, в определённый отрезок времени существуют две фазы, представляющие собой два агрегатных состояния вещества.
1. Переход вещества из жидкого состояния в газообразное называют парообразованием или испарением, если парообразование происходит только с поверхности жидкости.
|
|
|
2. Переход из твёрдого состояния в газообразное называют сублимацией, из газообразного в твёрдое - десублимацией.
3. Процесс перехода газа в жидкое состояние называют конденсацией.
4. Переход из твёрдого состояния в жидкое представляет процесс плавления, а обратный переход - процесс кристаллизации.
Газообразное состояние вещества
При достаточном разряжении частицы газа настолько удалены одна от другой, что можно пренебречь силами их взаимодействия, и занимаемой им частью объёма. Газ в таком состоянии называется идеальным.
Состояние газа можно охарактеризовать трем параметрами: температурой, давление и объёмом.
Давление газа в системе СИ выражается в паскалях. Паскаль - это давление, при котором на площадь в 1 м2 действует сила в 1 Ньютон. ( 1 Н).
Р =1 Н/1м2 =Н/м2 = 1 Па (паскаль)
В качестве единицы объёма в системе СИ принимается кубических метр (м3). Допускается применение дольных и кратных единиц (дм3; см3;мм3). В химии (аналитической химии, физической химии) в качестве единицы объёма используется литр (л):
1л =1дм3 =1*10 -3м3
Единицей измерения в термодинамической Т температуры в системе СИ является
1 Кельвин (К). Для выражения результатов практических измерений температуры t градус Цельсия(0С).
|
|
|
1 градус Цельсия(0С) =11 К
Соотношение между данными шкалами выражается уравнением:
Т= t +273,15, или Т = t +273
Температура 00С (273К) и давление 101325 Па характеризует нормальные условия для газа (н.у.). Объём, занимаемый газом при этих условиях, обозначают V0.
В производственных условиях довольно часто приходится иметь дело газами, находящимися пи низких давлениях и высоких температурах. В этом случае при расчётах без большой погрешности можно использовать простые закономерности, установленные для идеальных газов.
Закон Бойля-Мариотта. Для данной массы газа при T =const произведение давления (Р) на объём (V) есть величина постоянная, или при постоянной температуре объёмы данной массы газа обратны пропорциональны давлениям, под которыми находится газ:
P*V = const при T =const
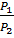 =
= 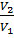
Закон Гей-Люссака. При постоянном давлении объёмы данной массы газа прямо пропорциональны абсолютным температурам:
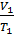 =
= 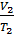
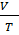 = const
= const
Закон Шарля. При постоянном объёме, давление идеального газа прямо пропорционально его температурам.
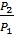 =
= 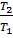 , при V= const
, при V= const
Закон Авогадро. В равных объёмах различных газов при одинаковой температуре и при одинаковом давлении содержится одинаковое число молекул, а при нормальных условиях (н.у.) 1 кило моль газа занимает объём V = 22,415 м3.
|
|
|
При расчётах газов и газовых смесей используется уравнение состояния Менделеева-Клайперона, выведенное на основе объединённого уравнения для идеальных газов:
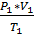 =
= 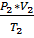 =……= const с применением закона Авогадро:
=……= const с применением закона Авогадро:
P*V = nRT
Задание. При решении задач необходимо вначале выяснить какой из параметров (давление, температура, объём) постоянен. И используя один из законов решить задачу. Если все параметры переменные, то применяем Закон Менделеева - Клайперона
Задача 1. Вычислить объём дымовых газов при нормальном давлении, если их объём при P = 98 880 Па и постоянной температуре V = 10м3
Ответ для проверки: 9,766м3
Задача 2. В стальном баллоне ёмкостью 12 л находится кислород под давление P = 1,418*107 Па и при 00 С. Какой объём (м3) займет это количество кислорода при н.у. (нормальные условия) ?
Ответ для проверки: 1,680м3
Задача 3. При 170С газ занимает объём 680 м3. Какой объём займёт этот же газ при1000С, если давление его останется неизменным?
Ответ для проверки: 874, 6м3
Задача 4. Сжатый воздух в баллоне имеет температуру 150С. Во время пожара температура воздуха в баллоне поднялась до 4500С. Взорвался ли баллон, если при этой температуре он может выдержать давление не более
P =9,8*106 Па ? Начальное давление P =4,8*106 Па
Ответ для проверки: Взорвётся. Подтвердить решением.
Дата добавления: 2021-01-21; просмотров: 104; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
