Необратимые реакции первого и второго порядков
Лекция_основные положения химической кинетики в приложении к простым и сложным реакциям
Несмотря на ряд отличий от небиологических катализаторов, катализируемые ферментами реакции вполне подчиняются общим теоретическим соображениям. Рассмотрим основные понятия химической кинетики.
Химическая кинетика – раздел физической химии, который изучает протекание реакций во времени. Как правило, основная цель кинетического исследования – установление механизма реакции. Под механизмом понимают совокупность элементарных реакций, через которые протекает процесс.
К задачам кинетического исследования относят определение числа элементарных реакций, установление числа и строения реакционных центров, выяснение скоростьопределяющей реакции, выяснение кинетических параметров элементарных стадий. Выяснение этих вопросов и есть установление механизма процесса.
Скорость химической реакции V – количество вещества, превращенного (образовавшегося или распавшегося) в единицу времени в единице объёма. Для конденсированных сред удобнее использовать не количество вещества, а концентрацию. Следовательно, определение будет: скорость химической реакции – это концентрация вещества, превращенного в единицу времени при постоянном объеме. Аналитически это можно изобразить:
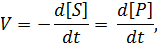
| (5.1) |
где [S] и [P] – концентрации исходного вещества и продукта.
|
|
|
Скорость не может быть определена непосредственно, но можно определить концентрации реактантов в разные моменты времени, и вычислить из них скорость:
- начальную V0, конечную;
- истинную (мгновенную), задается выражением (5.1);
- среднюю за промежуток времени 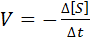 ;
;
- максимальную Vmax и т.д.
Для простых реакций не имеет значения, как именно определяется скорость, по накоплению любого продукта или по расходованию любого из исходных веществ.
Скорость реакции является функцией концентраций веществ, вступающих в реакцию, которая составляет математическое выражение (5.2) основного постулата химической кинетики: скорость химической реакции пропорциональна произведению концентраций веществ, вступающих в реакцию, в степенях, равных порядку по соответствующему реактанту.
| Для реакции aA + bB + … → сС + dD + … | (5.2) |
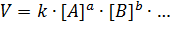 , ,
| (5.3) |
где коэффициенты a и b равны стехиометрическим коэффициентам простой реакции, а для сложной реакции являются определенными числами, не связанными со стехиометрией реакции и, следовательно, могут иметь целочисленные, дробные и даже отрицательные значения.
Константа скорости k численно равна скорости при концентрации исходных реагентов 1 моль/л. То есть, является абсолютной мерой скорости реакции, не нуждающейся в уточнении концентраций реактантов. Величины констант позволяют сравнивать скорости стадий, отмечать скоростьлимитирующие стадии, оценивать эффективность катализа.
|
|
|
Следует различать порядок реакции, молекулярность и стехиометрию.
Молекулярность – число молекул, реагирующих друг с другом в элементарном акте, например, молекулярность прямой и обратной реакции (5.4) равна двум:
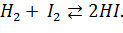
| (5.4) |
Стехиометрия – количественное соотношение реагентов, необходимое для образования 1 моль продукта, присутствующего в наименьшем количестве. Стехиометрические коэффициенты этой реакции равны ½:
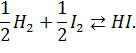
| (5.5) |
Порядок реакции по веществу – показатель степени, в которую возводится концентрация вещества в основном постулате химической кинетики. Как указывалось ранее, совпадает со стехиометрическим коэффициентом только для элементарной реакции. Сумма частных порядков по всем реагентам дает суммарный порядок реакции, он может быть целочисленным, дробным и даже отрицательным.
Реакции можно классифицировать разными способами:
- простые (элементарные акты взаимодействия, не могут быть разделены на более простые) и сложные, состоящие из нескольких элементарных актов;
|
|
|
- по молекулярности (определяется числом частиц, участвующих в каждом элементарном акте, (5.6) – (5.8). Тримолекулярные реакции очень редки, а участие в элементарном акте еще большего количества частиц практически невозможно.
| мономолекулярные | A → | (5.6) |
| бимолекулярные | A + B → | (5.7) |
| тримолекулярные | A + B + С → | (5.8) |
- по порядку;
- по фазовому составу реактантов: гомогенные, гетерогенные;
- каталитические и некаталитические.
Необратимые реакции первого и второго порядков
Примеры реакций первого порядка – разложение азометана, пятиокиси азота, диметилового эфира.
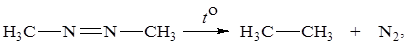
| (5.9) |
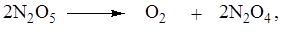
| (5.10) |
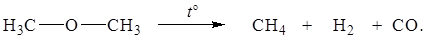
| (5.11) |
Или в общем виде:
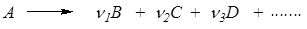
| (5.12) |
Общее для этих реакций то, что происходит превращение одной молекулы А в некие продукты. Этот процесс зависит только от ее внутреннего состояния и не зависит от взаимодействия с другими молекулами. Распад в этом случае спонтанный.
Пусть объем реакционной смеси постоянный, начальная концентрация вещества А равна а моль/л, за некоторый промежуток времени от t до dt превращается х моль/л этого вещества, и его концентрация становится (а - х):
|
|
|
| время | Концентрация исходного вещества, моль/л | Концентрация превращенного вещества, моль/л |
| t = 0 | a | 0 |
| t + dt | a - x | x |
Приращение концентрации превращенного вещества (или приращение с обратным знаком израсходованного вещества) за время dt будет пропорционально этому времени:
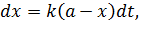
| (5.13) |
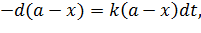
| (5.14) |
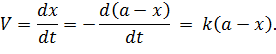
| (5.15) |
Полученное дифференциальное уравнение решается при разделении переменных, константу определяют из начальных условий:
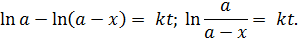
| (5.16) |
Полученное равенство является уравнением прямой (y = kx), проходящей через начало координат. Построив таковую по экспериментальным точкам, из нее можно определить константу скорости реакции (рисунок 5.1).
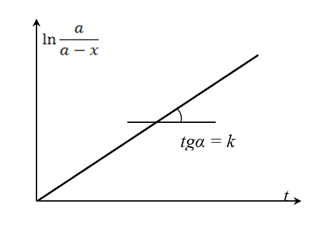
|
| Рисунок 5.1 – Определение константы скорости из уравнения скорости реакции первого порядка в логарифмическом виде. |
Из (5.16) выразим константу скорости.
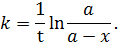
| (5.17) |
Как видим, константа скорости имеет размерность единицы времени в степени (-1) – с-1, мин-1. Выразим концентрацию исходного вещества 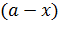 как функцию времени из (5.16):
как функцию времени из (5.16):
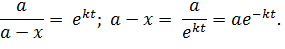
| (5.18) |
Это убывающая показательная функция, описывающая расходование исходного вещества.
Если выразить 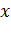 как функцию времени, узнаем скорость увеличения доли превращенного продукта:
как функцию времени, узнаем скорость увеличения доли превращенного продукта:
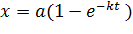 . .
| (5.19) |
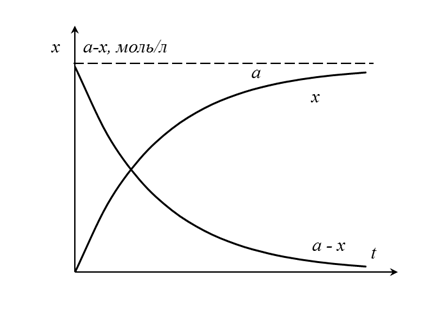
Это тоже показательная функция, график которой симметричен графику предыдущей относительно оси абсцисс (рисунок 5.2). Обе кривые называются кинетическими кривыми.
В точке пересечения кривых концентрации превратившегося и оставшегося субстрата равны, то есть, превратилась половина субстрата. Время, прошедшее с начала реакции до этой точки, называют периодом полупревращения (полураспада) τ. Определим его, основываясь на уравнении в логарифмическом виде (5.16).
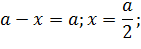
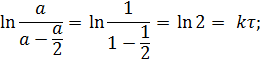
| |
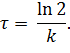
| (5.20) |
Как видно, для реакции первого порядка период полураспада не зависит от начальной концентрации, а зависит только от константы скорости реакции, то есть от природы превращающегося вещества и условий процесса. Эта величина характеризует среднюю продолжительность жизни молекулы (частицы).
Еще одним примером реакции первого порядка является спонтанный (нецепной) распад радиоактивных атомов, хотя процесс и не является химическим.
|
| Рисунок 5.2 – Кинетические кривые расходования субстрата (x) и увеличения доли превращенного субстрата (накопления продукта, a - x) |
Если в элементарном акте участвует две молекулы, то наблюдается реакция второго порядка. Например, реакция омыления эфира щелочью:
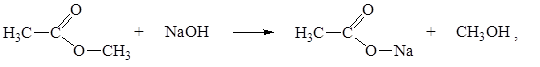
| (5.21) |
стадии радикально-цепного процесса:
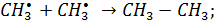 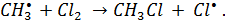
| (5.22) |
В общем виде подобные реакции могут быть записаны так:
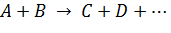 . .
| (5.23) |
В реакционной смеси постоянного объема взаимодействуют вещество А с начальной концентрацией а моль/л и вещество В с начальной концентрацией b моль/л. За время от t = 0 до t + dt превращено по x моль/л каждого из веществ:
| время | Концентрация вещества A, моль/л | Концентрация вещества B, моль/л |
| t = 0 | a | b |
| t + dt | a - x | b - x |
Уравнение скорости для реакции второго порядка выглядит аналогично уравнению (5.15), однако учитывает участие обоих реагентов и влияние их концентраций:
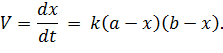
| (5.24) |
После разделения переменных, разбиения дроби на сумму дробей, интегрирования и определения константы интегрирования получаем:
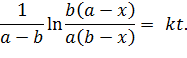
| (5.25) |
Выразим k. Очевидно, что ее размерность л·(моль·с)‑1.
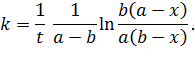
| (5.26) |
Если взяты одинаковые начальные концентрации исходных веществ, уравнение скорости упростится:
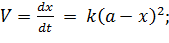 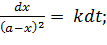 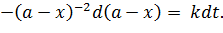
| (5.27) |
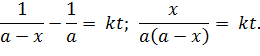
| (5.28) |
Нетрудно заметить, что полученное выражение – уравнение прямой, которую можно построить по экспериментальным данным кинетики и вычислить константу скорости (рисунок 5.3).
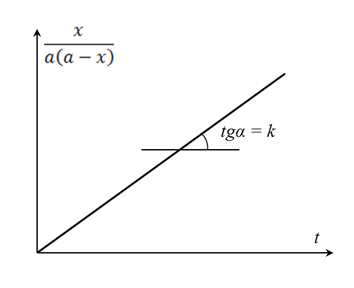
|
| Рисунок 5.3 – Определение константы скорости из уравнения скорости реакции второго порядка. |
Выразим константу и период полураспада:
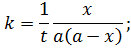
| (5.29) |
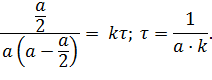
| (5.30) |
Время полураспада обратно пропорционально концентрации исходного вещества.
Дата добавления: 2021-01-21; просмотров: 364; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
