Список источников и литературы
Министерство образования и науки Республики Саха (Якутия)
Государственное бюджетное профессиональное образовательное учреждение Республики Саха (Якутия)
«Якутский медицинский колледж»
Отдел профессионального дополнительного образования
Цикл «Сестринское операционное дело»
КУРСОВАЯ РАБОТА
Трансфузиология. Препараты крови и их компоненты»
Выполнила: М.С.Михайлова,
Операционная медсестра
Хирургического отделения
В ГБУ Амгинская ЦРБ
Проверила: М.Г.Макарова.
Г.Якутск-2020г.
СОДЕРЖАНИЕ
Введение………………………………………………………………………......3
1. Общая характеристика трансфузиологии…………………………………….4
2. Компоненты крови……………………………………………………………..5
3. Препараты крови……………………………………………………………...14
Заключение ……………………………………………………………………...19
Список источников и литературы ……………………………………………..20
Отчет о хирургической работе …………………………………………………21
Приложение……………………………………………………………………...30
ВВЕДЕНИЕ
Развитие медицины, и хирургии в частности, в настоящее время проявляется ростом применения агрессивных технологий и увеличением доли тяжелых пациентов, что ведет к повышению потребности в компонентах крови. Трансфузиология является базисом для прогресса во многих областях медицины. Без ее достижений не достигли бы современного уровня медицинские дисциплины: гематология, онкология, кардиохирургия, трансплантология, военно-полевая хирургия и другие.
|
|
|
Переливание компонентов крови - неотъемлемая составляющая оказания специализированной и высокотехнологичной хирургической помощи в многопрофильных стационарах. При этом обязательным условием повышения эффективности хирургического пособия является модернизация трансфузионной терапии с применением в максимальной степени эффективных и безопасных компонентов.
Цель курсовой работы – изучить сущность трансфузиологии и исследовать методы ее применения. В соответствии с поставленной целью были сформулированы следующие задачи курсовой работы:
- изучить теоретический материал по данной теме;
- изучить методы переливания компонентов и препаратов крови;
- изучить показания и противопоказания к переливанию;
С учетом того, что переливание крови — это исключительно врачебная манипуляция, становится очевидной актуальность данного вопроса.
Общая характеристика трансфузиологии
Трансфузиология (transfusio - переливание, logos - учение) - наука о перелива-нии крови, ее компонентов и препаратов, кровезаменителей с лечебной целью путем воздействия на состав крови, биологических жидкостей организма.
|
|
|
Переливание крови - мощное средство лечения самых различных заболеваний, а при ряде патологических состояний (кровотечение, анемия, шок, большие хирургические операции и др.) - единственное и пока незаменимое средство спасения жизни больных. Кровь, ее компоненты и препараты, полученные из крови, широко применяют не только хирурги, травматологи, акушеры, гинекологи, но и терапевты, педиатры, инфекционисты, врачи других специальностей.
Лечебный метод переливания крови прошел длительный и сложный путь: от переливания крови животных человеку – к прямым трансфузиям от донора больному, от широкого применения консервированной крови – к его значительному ограничению и использованию компонентной гемотерапии. Последние десятилетия ознаменовались дальнейшими успехами в области трансфузиологии, клинической медицины, реаниматологии, онкогематологии, коагулологии, трансплантологии и других разделах науки и практики. Внедрены новые методы длительного консервирования крови, ее фракционирования на клеточные и белковые компоненты и их дифференцированное применение.
|
|
|
Как показала клиническая практика использование цельной крови имеет узкие показания и при многих патологических процессах, развивающихся в организме больного, не всегда обосновано с точки зрения получения оптимального лечебного эффекта, а в некоторых случаях может представлять определенную опасность для реципиента, поскольку при переливании цельной крови помимо эритроцитов больной получает небезразличные для него лейкоциты, тромбоциты, белки и изоантитела. Это приводит к изоиммунизации организма реципиента – образованию антител к клеточным элементам и антигенам белков плазмы крови. В последующей жизни больного (при беременности, необходимости повторного переливания крови) изоиммунизация может явиться причиной тяжелых посттрансфузионных реакций и не дать желаемого лечебного эффекта при переливании крови.
Достижения современной трансфузиологии позволили производить фракционирование крови на ряд компонентов и препаратов, при использовании которых удается получить более выраженный терапевтический эффект, чем при использовании цельной крови
Лечебная эффективность компонентов крови зависит от полноценности, выделенной из цельной крови клеток, обладающих различной чувствительностью к воздействиям внешней среды и времени (после заготовки крови) выделения.
|
|
|
Для фракционирования крови и получения из нее клеточных элементов в больших количествах применяют методы плазмо-цитофереза.
Возможности компонентной гемотерапии могут ограничить показания к использованию цельной крови главным образом случаями острых кровопотерь с резким уменьшением объема циркулирующей крови и другими экстремальными состояниями.
Таким образом, последние достижения в области фракционирования крови определили новую трансфузиологическую тактику – ограничение показаний к переливанию крови, дифференцированное использование отдельных компонентов и препаратов крови, что позволило значительно повысить лечебный эффект трансфузионной терапии, а также снизить риск развития опасных реакций и осложнений, связанных с гемотерапией и значительно увеличить ресурсы трансфузионных сред.
Компоненты крови
В хирургической практике в качестве компонентов крови достаточно широко применяются: эритроцитная масса, тромбоцитная масса, лейкоцитная масса и плазма крови. Каждый врач должен четко знать показания к применению компонентов крови. Если у больного существует дефицит тех или иных клеток крови или белковых факторов плазмы, цель гемотерапии – возместить этот дефицит. Если необходима стимуляция той или иной функции крови больного, врач должен знать, как и чем ее стимулировать.
Переливание компонентов крови — ответственная операция трансплантации. У реципиента возможно развитие изосенсибилизации к антигенам клеток крови и белков плазмы, а также возможно развитие жизненно опасной реакции «трансплантат против хозяина». При переливании крови пациент, кроме необходимых ему клеточных элементов, получает неполноценные тромбоциты, лейкоциты, агрессивные лимфоциты, антитела и антигены донора. Трансфузия компонентов крови содержит в себе риск передачи вирусных и других инфекций. Показания к переливанию крови должны быть строго обоснованы. Если возможно обеспечить эффективное лечение больного без переливания крови или нет уверенности, что оно принесет ему пользу, от переливания крови лучше отказаться.
Эритроцитная масса (ЭМ)– основной компонент крови, который по своему составу, функциональным свойствам и лечебной эффективности при анемических состояниях превосходит цельную кровь. При этом в меньшем объеме ЭМ обычно содержится то же количество эритроцитов, при значительно меньшем количестве цитрата натрия, продуктов распада клеток, клеточных и белковых антигенов и антител, чем в цельной крови. Трансфузии ЭМ занимают ведущее место в гемотерапии, направленной на восполнение дефицита красных кровяных клеток (эритроцитов) при анемических состояниях. К последним относятся:
- острые постгеморрагические анемии (кровопотеря после травмы, острых желудочно-кишечные кровотечений, хирургических операций, патологичес-ких родов и т.д.);
- тяжелые формы железодефицитных анемий, особенно у пожилых людей при наличии выраженных изменений гемодинамики и у больных в порядке подготовки к срочным операциям с предполагаемой большой кровопотерей, а также у женщин во время подготовки к родам;
- анемии, сопровождающие хронические заболевания желудочно-кишечного тракта и других органов и систем и интоксикации при отравлениях, ожогах, гнойной инфекции;
- анемии, возникающие от депрессии эритропоэза (острые и хронические лейкозы, пластический синдром, миэломная болезнь).
Для клинического применения готовят:
1) эритроцитную массу,
2) эритроцитную взвесь – в эритроцитную массу добавляют плазмозамещающий раствор ЦОЛИПК 8, а непосредственно перед трансфузией – 0,9% раствор хлорида натрия, лактосол или желатиноль;
3) отмытую эритроцитную. массу (отмывают 0Э9% раствором хлорида натрия с повторным центрифугированием);
4) размороженную отмытую эритроцитную массу.
Основными показаниями к переливанию ЭМ являются:
- восполнение кровопотери при острых циркуляторных нарушениях, связанных с травмой, шоком, операцией, родами;
- лечение постгеморрагических и других анемий;
- гемотерапия у больных с повышенной реактивностью и сенсибилизацией, с наличием антилейкоцитарных, антитромбоцитарных антител;
гемотерапия у больных гипертонией, с сердечно-легочной недостаточностью, с повышенным внутричерепным давлением, предрасположенных к тромбозам и гиперкоагуляции крови, с печеночно-почечной недостаточностью.
Трансфузия эритроцитарной массы, восполняя недостаток эритроцитов в крови реципиента, снижает опасность циркуляторных перегрузок у анемизированных больных с сердечно-сосудистой и легочной недостаточностью, пожилых и ослабленных людей.
Поскольку адаптация к снижению числа эритроцитов и гемоглобина в крови у разных больных широко варьирует (лица пожилого возраста хуже переносят анемический синдром, тогда как молодые, особенно женщины – лучше), а переливание эритроцитной массы относится к далеко небезразличной для больного операции, при выборе показаний к ней наряду со степенью анемизации больного (снижение количества эритроцитов и гемоглобина) следует ориентироваться и на появление циркуляторных нарушений, делающих показание к переливанию ЭМ абсолютным. Так при острой кровопотере, уровень гемоглобина (гематокрита) не может являться ориентиром для решения вопроса о назначении трансфузии ЭМ, поскольку в течение суток, даже при острой кровопотере, он может оставаться на удовлетворительных цифрах при крайне опасном уровне снижения ОЦК, но появление у больного одышки, сердцебиения на фоне бледности кожных покровов и слизистых оболочек является серьезным основанием для переливания ЭМ. С другой стороны, при хронических кровопотерях и недостаточности и недостаточности кроветворения основанием для переливания ЭМ в большинстве случаев является падение гемоглобина ниже 80 г/л, а гематокрита – ниже 25.
Эритроцитную массу получают из консервированной крови путем отделения плазмы. По внешнему виду ЭМ отличается от консервированной крови меньшим объемом плазмы над слоем выпавших в осадок эритроцитов. По клеточному составу ЭМ содержит в основном эритроциты и лишь незначительное количество тромбоцитов и лейкоцитов, что обуславливает меньшую ее реактогенность. Она может применяться в комплексе с плазмозаменителями и препаратами плазмы. Ее сочетание с плазмозаменителями и свежезамороженной плазмой более эффективно, чем переливание цельной крови, поскольку ЭМ содержит меньшее количество цитрата натрия, аммиака, внеклеточного калия, а также микроагрегатов из разрушенных клеток и денатурированных белков плазмы, что особенно важно для профилактики «синдрома массивных трансфузий».
Хранить ЭМ следует при температуре +40С. Сроки ее хранения определяются составом консервирующего раствора для крови или ресуспендирующего раствора для эритроцитной массы. Так ЭМ, полученную из крови, консервированной раствором глюгицир-цитроглюкофосфата, хранят 21 день; ЭМ, полученную из крови, заготовленной на растворе циглюфад – до 35 дней; ЭМ, ресуспендированную на растворе эритронаф, хранят до 35 дней.
В процессе хранения в ЭМ происходит обратимая потеря эритроцитами функции переноса и отдачи кислорода тканям организма, которая восстанавливается в течение 12-24 часов циркуляции в организме реципиента. Из этого следует практический вывод: в случае анемии, развившейся в случае острой большой кровопотери и сопровождающейся выраженной гипоксией тканей, для быстрого восполнения кислородной емкости крови следует применять ЭМ малых сроков хранения, а при умеренной кровопотере, хронической анемии можно использовать ЭМ более длительных сроков хранения.
При выраженном анемическом состоянии больного противопоказаний к переливанию ЭМ нет.
Относительными противопоказаниями к переливанию ЭМ являются: острый и подострый септический эндокардит, прогрессирующее развитие диффузного гломерулонефрита, хроническая почечная, острая и хроническая печеночная недостаточность, декомпенсация кровообращения, пороки сердца в стадии декомпенсации, миокардит и миокардиосклерозы с нарушением кровообращения I-III степени, гипертоническая болезнь III стадии, выраженный атеросклероз сосудов головного мозга, кровоизлияния в мозг, нефросклероз, тромбоэмболическая болезнь, отек легких, выраженный общий амилоидоз, остротекущий и диссеминированный туберкулез, острый ревматизм. При тромбоэмболическом состоянии больного, острой почечной и печеночной недостаточности, когда есть показания к переливанию больному эритроцитов, более целесообразно переливать отмытые эритроциты.
При переливании ЭМ больным с реологическими и микроциркуляторными нарушениями для уменьшения ее вязкости непосредственно перед трансфузией в каждую дозу ЭМ надо добавить 50-100 мл стерильного 0,9% раствора хлорида натрия.
Отмытые эритроциты (ОЭ)– получают из цельной крови (после удаления плазмы), эритроцитной массы или замороженных эритроцитов путем их отмывания в изотоническом растворе или специальных отмывающих средах. В процессе отмывания удаляются белки плазмы, лейкоциты, тромбоциты, микроагрегаты клеток и стромы разрушенных при хранении клеточных компонентов крови. Отмытые эритроциты представляют собой ареактогенную трансфузионную среду и показаны для переливания больным, у которых в анамнезе имелись посттрансфузионные реакции негемолитического типа, а также больным, сенсибилизированным к антигенам белков плазмы, тканевым антигенам лейкоцитов и тромбоцитов.
В связи с отсутствием в ОЭ стабилизаторов крови и продуктов метаболизма клеточных компонентов, оказывающих токсическое действие на организм реципиента, их трансфузии показаны при лечении выраженных анемий у больных с печеночной и почечной недостаточностью и при «синдроме массивных трансфузий». Преимуществом применения ОЭ является также меньший риск заражения реципиента вирусным гепатитом.
Срок хранения отмытых эритроцитов при температуре +40С – 24 часа с момента их заготовки.
Тромбоцитную массу (тромбоконцентрат) получают из отдельных доз цельной крови центрифугированием и последующим отделением от плазмы, а также методом тромбоцитофереза с помощью автоматических фракционаторов, позволяющих заготавливать от одного донора за несколько часов большие количества тромбоцитов.
Общими показаниями для переливания тромбоцитарной массы (ТМ) являются тромбоцитопенические кровотечения, которые могут быть обусловлены:
а) недостаточным образованием тромбоцитов – амегакариоцитарная тромбоцитопения (лейкозы, апластическая анемия, депрессии костномозгового кроветворения в результате лучевой или цитостатической терапии, острая лучевая болезнь);
б) повышенным потреблением тромбоцитов (синдром ДВС в фазе гипокоагуляции);
в) функциональной неполноценностью тромбоцитов (различные тромбоцитопатии – синдром Вернера-Сулье, Вискетт-Олдрича, тромбоцитостения Гланцмана, анемия Фанкони).
современная заместительная терапия тромбоцитопенического геморрагического синдрома амегакариоцитарной этиологии невозможна без переливания донорских тромбоцитов, полученных, как правило, в терапевтической дозе от одного донора. Минимальная терапевтическая доза, необходимая для прекращения спонтанных тромбоцитопенических геморрагий или для предупреждения их развития при оперативных вмешательствах, в том числе полостных, выполняемых у больных с выраженной (менее 40х109/л) амегакариоцитарной тромбоцитопенией, составляет 2,8 – 3,0 .х 1011 тромбоцитов.
При отсутствии кровоточивости или кровотечений в случаях , когда у больных не предполагается каких-либо плановых оперативных вмешательств, сам по себе низкий уровень тромбоцитов (20х109/л) не является показанием к переливанию тромбоцитной массы.
На фоне выраженной (5-15х109/л) тромбоцитопении абсолютным показанием к трансфузии ТМ является возникновение геморрагий (петехии, экхимозы) на коже лица, верхней половине туловища, локальных кровотечений (желудочно-кишечный тракт, нос, матка, мочевой пузырь). Показанием к экстренному переливанию ТМ служит появление геморрагий на глазном дне, указывающее на опасность развития церебральных кровотечений.
Переливание ТМ не показано при иммунных (тромбоцитолитических) тромбоцитопениях (повышенное разрушение тромбоцитов). Поэтому в тех случаях, когда наблюдается только тромбоцитопения без анемии и лейкопении, необходимо исследование костного мозга. Нормальное или повышенное количество мегакариоцитов в костном мозге говорит в пользу тромбоцитолитической природы тромбоцитопении. Таким больным показана терапия гормонами, а не переливание тромбоцитов.
Эффективность трансфузий тромбоцитов во многом определяется количеством перелитых клеток, их функциональной полноценностью и приживаемостью, методами их выделения и хранения, а также состоянием реципиента. Важнейшим показателем лечебной эффективности переливания ТМ, наряду с клиническими данными о прекращении спонтанной кровоточивости или кровотечений, является повышение числа тромбоцитов в 1 мкл через 1 час и 18-24 часа после трансфузии.
Для обеспечения гемостатического эффекта число тромбоцитов у больного с тромбоцитопенической кровоточивостью в 1-й час после трансфузии ТМ должно быть увеличено до 50-60 х 1011 тромбоцитов на каждые 10 кг веса или на 1 м2 поверхности тела.
Применяемая для переливания ТМ должна иметь такую же маркировку, как и другие трансфузионные среды (цельная кровь, эритроцитная масса). Кроме того, в паспортной части должно быть указано количество тромбоцитов в данном контейнере, посчитанное после окончания их получения. Подбор пары «донор-реципиент» осуществляется по системе АВО и резус-фактору. Непосредственно перед переливанием тромбоцитной массы врач должен проверить маркировку контейнера, его герметичность, сверить идентичность групп крови донора и реципиента по системе АВО и резус- фактору. Пробу на биологическую совместимость ТМ и крови реципиента проводить не следует.
При многократных переливаниях ТМ у некоторых больных может возникнуть проблема рефрактерности к повторным трансфузиям тромбоцитов, связанная с развитием у них состояния аллоиммунизации. Последняя вызывается сенсибилизацией реципиента аллоантителами донора(ов) и характеризуется появлением у реципиента антитромбоцитарных и анти-HLA антител. В этих случаях после переливания ТМ у реципиента наблюдается температурная реакция, отсутствие должного прироста тромбоцитов и гемостатического эффекта. Для снятия сенсибилизации и получения лечебного эффекта от переливания ТМ может быть применен лечебный плазмоферез и подбор пары «донор-реципиент» с учетом антигенов системы HLA.
В тромбоцитной массе не исключено наличие примеси иммунокомпонентных и иммуноагрессивных Т- и В- лимфоцитов. Поэтому для профилактики реакции «трансплантат против хозяина» (РТПХ) у больных с иммунодефицитом при трансплантации костного мозга обязательно облучение ТМ в дозе 15 грей (1500 рад). При иммунодефиците, обусловленном цитостатической или лучевой терапией, при наличии соответствующих условий облучение ТМ желательно
При использовании трансфузии ТМ больным с неотягощенным трансфузионным анамнезом и нуждающимся в долгосрочной поддерживающей терапии рекомендуется применять ТМ одноименную по группам крови АВО и резус-фактору. В случае появления клинических и иммунологических данных о рефрактерности последующие трансфузии ТМ осуществляются после специального подбора совместимых тромбоцитов по антигенам системы HLA, при этом в качестве доноров рекомендуется использовать близких (кровных) родственников больного.
Лейкоцитная масса (ЛМ)представляет собой трансфузионную среду с высокой концентрацией белых клеток периферической крови (гранулоциты, лимфоциты) и примесью тромбоцитов и эритроцитов.
Для получения лейкоцитной массы наиболее эффективным и оптимальным следует считать метод цитофереза на фракционаторах непрерывного действия, который позволяет за 2-4 часа пропустить через аппарат большие объемы крови и получить от одного донора 1-2х1010 лейкоцитов. В процессе центрифугирования донору возвращают эритроциты и плазму.
В практике принято использовать лейкоцитную массу, выделенную из цельной крови, непосредственно после ее заготовки.
Трансфузии лейкоцитной массы показаны главным образом при лечении больных с миелодепрессией после лучевой и химиотерапии, сопровождающейся прогрессирующими тяжелыми инфекционными осложнениями при неэффективности терапии антибиотиками (устойчивые штаммы микробов, грибки). При лечении гематологических заболеваний можно использовать кровь больных хроническим миелолейкозом для получения лейкоцитов. Дефицит лейкоцитов, необходимых больному для борьбы с гнойно-септическими осложнениями, может быть возмещен лишь переливанием большого количества лейкоцитов, обладающих фагоцитарной активностью. Терапевтической дозой считается трансфузия 12-40х109 клеток.
Переливание ЛМ в терапевтически эффективных дозах позволяет избежать или уменьшить возможность развития инфекционных осложнений в период до восстановления у больного собственного костномозгового кроветворения. Профилактическое применение ЛМ целесообразно в период проведения интенсивной терапии цитостатиками, а также при гемобластозах. Абсолютным показанием для переливания ЛМ является отсутствие эффекта от интенсивной антибактериальной терапии инфекционного состояния больного (сепсис, пневмония, некротическая энтеропатия), развивающегося на фоне миелотоксического агранулоцитоза (уровень гранулоцитов менее 0,75х109 клеток).
Трансфузии лейкоцитной массы производят капельным методом ежедневно до купирования инфекционных осложнений. Перед переливанием ее желательно подвергнуть предварительному облучению в дозе 15 грей (1500 рад.).
Подбор пары «донор-реципиент» осуществляется по системе АВО, резус(из-за значительной примеси эритроцитов), а также по реакции лейкоагглютинации или по лимфоцитотоксическому тесту.
Резко повышает эффективность заместительной терапии лейкоцитами подбор их по гистолейкоцитарным антигенам.
Как профилактическое, так и лечебное применение переливаний ЛМ эффективно при частоте трансфузий не менее трех раз в неделю.
Переливание ЛМ не показано при агранулоцитозе иммунной этиологии.
Плазма крови– жидкая часть крови, в состав которой входит большое количество биологически активных веществ: белки, липиды, ферменты, гормоны и пр. Наиболее эффективно применение плазмы свежезамороженной (ПСЗ), поскольку в ней наиболее полно сохраняются все биологические функции. Другие виды плазмы – нативная (жидкая), лиофилизованная (сухая), антигемофильная – в значительной мере теряют свои лечебные свойства в процессе изготовления и клиническое применение их мало эффективно и должно быть ограничено.
Плазму сухую замороженную получают методом плазмофереза или центрифугирования цельной крови не позже 0,5-1часа с момента взятия ее от донора. Плазму немедленно замораживают и хранят при температуре -200С. При такой температуре ПСЗ может храниться до 1 года. В течение этого времени в ней сохраняются лабильные факторы системы гемостаза. Непосредственно перед переливанием емкость с ПСЗ помещают в воду с температурой +37-380 С. В оттаявшей плазме возможно появление хлопьев фибрина, что не препятствует переливанию ее через стандартные пластиковые системы, имеющие фильтры. Появление в плазме значительной мутности, массивных сгустков, свидетельствует и недоброкачественности плазмы. Такую плазму переливать нельзя.
Переливаемая плазма должна быть одной группы с кровью реципиента по системе АВО. В экстренных случаях допускается переливание плазмы группы А ( II ) и В (III ) больному группы О(I), и плазмы группы АВ (IV) – больному любой группы. При переливании плазмы проба на групповую совместимость плазмы и крови донора проводить не следует. Размороженная плазма до переливания может храниться не более 1 часа. Повторное замораживание недопустимо. Возможность длительного хранения ПСЗ позволяет накапливать ее от одного донора с целью реализации принципа «один донор - один больной».
Показаниями к переливанию ПСЗ являются:
1) восполнение объема циркулирующей крови при массивных кровопотерях с целью нормализации гемодинамических показателей (при кровопотере свыше 25% объема крови переливание ПСЗ следует сочетать с переливание эритроцитной массы – при этом лучше использовать отмытые эритроциты);
2) ожоговая болезнь во всех клинических фазах;
3) гнойно-септическое состояние больного;
4) коагулопатии с дефицитом II-IV-VII и XIII факторов свертывания крови, гемофилии А и В, тромболические состояния на фоне гепаринотерапии (доза не менее 300 мл 3-4 раза в сутки с интервалом 6-8 часов до полной остановки кровотечения);
5) синдром дессиминированного внутрисосудистого свертывания (в этом случае плазму переливают с реологически активными препаратами – реополиглюкин ).
Плазму свежезамороженную переливают внутривенно капельно или струйно в зависимости от состояния больного. При синдроме ДВС показано струйное введение плазмы. Запрещается переливать плазму нескольким больным из одного пластикового пакета или бутылки, нельзя оставлять плазму для последующих переливаний после разгерметизации контейнера. Для профилактики развития посттрансфузионных реакций перед переливанием плазмы следует провести пробу на биологическую совместимость крови реципиента и плазмы донора.
Трансфузии плазмы противопоказаны больным с тяжелыми нарушениями функции почек (при анурии).
Современная трансфузиология разработала методы получения от донора не только цельной крови, но и плазмы – плазмаферез при котором собственные форменные элементы крови возвращаются донору через 45-50 мин. Доза эксфузии плазмы за одну процедуру 200-400 мл. Методом фракционирования из белков плазмы стали получать различные препараты, которые нашли широкое применение в клинической практике.
Препараты крови
Разработка методов фракционирования белков плазмы крови позволила значительно сократить количество случаев применения цельной плазмы и внедрить в клиническую практику использование препаратов, получаемых из крови. По терапевтической направленности эти препараты можно разделить на группы комплексного (альбумин), иммунологического (гамма-глобулин и полиглобулин), гемостатического (фибриноген, антигемофильные препараты, тромбин и др.), антианемического (эригем, ферковен, гемостимулин) и стимулирующего (сыворотка Филатова, полиобиолин и др.) действия.
В клинической практике наибольшее применение нашли препараты комплексного, иммунологического и гемостатического действия.
Альбуминявляется одним из важнейших белков плазмы крови и составляет около 50% от их общего количества. Основная роль альбумина в организме человека состоит в поддержании коллоидно-осмотического равновесия в кровеносном русле. Он, активно связываясь с различными веществами, обеспечивает транспортную функцию плазмы, служит источником азота, осуществляя питание тканей.
В настоящее время готовят 5, 10, 20 и 25% растворы очищенного альбумина. Наряду с препаратами чистого альбумина применяют также растворы, содержащие до 20% альфа- и бетта-глобулинов. В нашей стране таким препаратом является протеин. В России выпускается также альбуминад – препарат на основе альбумина, получаемый при фракционировании плазмы с помощью этакридина лактата. При добавлении стабилизаторов растворы альбумина выдерживают пастеризацию при +600 С. При этом в течении 6 часов в них инактивируются вирусы гепатита.
Иммунологически активные препараты получают из выделяемой фракции глобулинов. Основным препаратом, получаемым из крови человека, является «неспецифический» гамма-глобулин, выпускаемый в нашей стране в большом количестве.
Этот препарат эффективен для профилактики кори и вирусного гепатита. Однако при ряде других инфекций его отчетливое лечебное действие проявляется не всегда из-за низкого содержания в нем специфических антител. В связи с этим исключительно актуально получение гамма-глобулинов направленного или специфического действия, которые получают из плазмы доноров, активно иммунизированных соответствующими антителами.
В настоящее время вместо ранее применяемого наименования «гамма-глобулин» принят общий термин «иммуноглобулины». Препарат, полученный из плазмы произвольно отобранных доноров, получил название «нормальный иммуноглобулин человека», гипериммунные препараты включают в свое название специфичность антител, например «иммуноглобулин человека антистафилококковый».
Разработаны иммунные препараты крови направленного действия против коклюша, оспы, столбняка, ботулизма. Внедряются в лечебную практику иммуноглобулины антирезус, антистафилококковые плазма и иммуноглобулин. Последние применяются в тех случаях, когда медикаментозная антимикробная терапия исчерпала свои возможности.
Введение иммуноглобулина антирезус препятствует появлению у резус-отрицательных женщин антител, которые могут образовываться вследствие иммунизации эритроцитами резус-положительного плода. Наблюдения показали, что введение иммуноглобулина через 30 мин после инъекции резус-положительных эритроцитов резус-отрицательным добровольцам вызывает гибель 50% введенных эритроцитов.
Из препаратов гемостатического действия в хирургической практике нашли широкое применение фибриноген, тромбин и гемостатическая губка.
Фибриноген представляет собой белую или слегка кремового цвета леофильно высушенную белковую фракцию плазмы. Пористая масса фибриногена легко растворима в дистиллированной воде. Его применяют при гип- и афибриногенемии, при активных кровотечениях, при операциях с аппаратом искусственного кровообращения. В профилактических целях фибриноген используют при подготовке к операции больных, у которых понижено содержание фибриногена в крови.
Раствор фибриногена вводят через систему с фильтром внутривенно капельно. Доза вводимого препарата зависит от показаний и колеблется от 0,8 до 8 г и больше. Чаще вводят 2-4 г фибриногена.
Выпускают фибриноген во флаконах емкостью 250 и 500 мм, в которых находится соответственно по 1 и 2 г препарата. Препарат растворяют непосредственно перед использованием растворителем, упакованным вместе с ним.
Тромбин образуется из неактивного протромбина при его ферментативной активации тромбопластином. В высушенном виде он представляет собой белую или слегка розоватую рыхлую массу, хорошо растворимую в изотоническом растворе хлорида натрия.
Тромбин способствует быстрому образованию тромба при кровотечениях из капиллярных сосудов и паренхиматозных органов. Раствор тромбина применяют только местно. Внутривенное введение тромбина недопустимо, так как при этом возникает угроза развития распространенного тромбоза. Для остановки поверхностного кровотечения раствором пропитывают стерильную фибринную губку или стерильный марлевый тампон, которые прикладывают к кровоточивому участку тканей с капиллярным кровотечением.
Гемостатическая губка представляет собой леофилизированный белковый препарат, полученный из плазмы донорской крови путем ее обработки тромбопластином в присутствии солей кальция. Она представляет собой сухую пористую массу кремового цвета, хорошо впитывающую жидкость. После пропитывания губки тромбином гемостатический эффект ее увеличивается.
Гемостатическая губка выпускается в специальных упаковках в высушенном виде. Препарат стерилен, сохраняет свои свойства в течение года. Его применяют при капиллярных кровотечениях из различных органов и тканей путем прикладывания и плотного прижатия к кровоточащему участку тканей после предварительного его осушивания.
Для остановки кровотечения может быть использован биологический антисептический тампон (БАТ), который готовят из плазмы донорской крови с добавлением желатина, кровесвертывающих и противомикробных средств (пенициллин, фурациллин и др.). Препарат оказывает гемостатический эффект при капиллярных кровотечениях и способствует продлению действия введенного в его состав антимикробного препарата. Его применяют также для профилактики раневой инфекции (при лечении инфицированных ран) и для заполнения послеоперационных полостей.
В клинической практике широкое применение получили растворы, которые при внутривенном введении могут в определенной мере заменить лечебные действия донорской крови. Эти растворы получили название кровезаменители или кровезамещающие среды. Они применяются для трансфузионной терапии при различных патологических состояниях и по своим функциональным действиям подразделяются на следующие группы:
| Гемодинамические | Дезинтоксикационные | Для белкового парентерального питания | Регуляторы водно-солевого и кислотно-щелочного состояния |
| Препараты на основе декст-ра-на: а) среднемолеку-лярные: полиглюкин, макродез, интра-декс, декстран, плазмодекс; б) низкомолеку-лярные: реополиглюкин, реомакродекс; в) препараты желатина: желатиноль, геможель, жело-фузин | Препараты на основе низкомолекулярного поливинилпир-ролидона: гемодез, перистон-Н, неокомпенсан. Препараты на основе низкомолекулярного поливинилового спирта: полидез | Белковые гидролизаты: гидролизат казеина, аминопептид, ами-кин, аминозол, ами-ген, аминон. Смеси аминокислот: полиамин, мориамин, аминофузин, вамин, фриамин | Солевые раство-ры: изотонический раствор хлорида натрия, раствор Рингера -Локка, лактосол, рингер-лактат. Осмодиуретики: маннитол, сорбитол |
· гемодинамические – заполняя кровеносное русло обеспечивают восстановление нарушенного в результате кровопотери или шока артериального давления до нормального уровня;
· дезинтоксикационные – способствуют выведению токсинов из организма больного при различных отравлениях и интоксикациях;
· восстанавливающие уровень белков и регулирующие водно-солевое и кислотно-щелочное состояние в организме больного.
Основными показаниями к применению кровезаменителей являются кровопотеря и шок различного происхождения, интоксикация организма и нарушение белкового обмена. Главными лечебными функциями кровезаменителей являются:
- заполнение кровеносного русла, обеспечивающее восстановление до нормального уровня артериального давления, снизившегося в результате кровопотери;
- освобождение организма от токсинов в случае отравления токсическими веществами;
- обеспечение доставки питательных белковых веществ всем органам и тканям организма.
Четкое понимание функций кровезаменителей позволит врачу успешно лечить больных, находящихся в тяжелом состоянии.
ЗАКЛЮЧЕНИЕ
Работа хирургической клиники неразрывно связана с проведением заместительной трансфузионной терапией компонентами крови. Оперативное вмешательство обязательно предполагает использование трансфузионных методов.
Каждый переливаемый компонент крови решает свою специфическую задачу. Переливание свежезамороженной плазмы восполняет дефицит плазменных факторов свертывания и в определенной степени повышает коллоидно-осмотическое давление в сосудистом русле. Эритроциты переливают только для восполнения дефицита переносчиков кислорода. Тромбоциты назначают при нарушениях сосудисто-тромбоцитарного гемостаза и для коррекции развившейся «тромбоцитопении потребления».
Показания к переливанию крови и сами трансфузиологические процедуры строго регламентированы инструкцией по применению компонентов крови, утвержденные приказом МЗ РФ № 363 от 25.11.2002. Важнейшее правило - введение в организм пациента той трансфузионной среды, недостаток которойугрожает его жизни.
Список источников и литературы
1. Жибург Е.Б. Трансфузиология / Е.Б. Жибург. — СПб.: Издательский дом «Питер», 2002. - 736 с.
2. Седов А.П. Переливание крови и кровезаменителей в хирургии и педиатрии / А.П. Седов. — М.: Издательско-торговая корпорация «Дашков и К», 2006. - 128 с.
3. Жибурт Е.Б. Правила переливания плазмы /Книга. - М. : Медицина, 2008. - 240 с.
4. Гостищев В. К. Общая хирургия. - М.: ГЕОТАР-МЕД, 2008 - 608 с.
5. Жибурт Е.Б., Шестаков Е.А., Вергопуло А.А., Кузьмин Н.С. Правила и протоколы переливания крови. М.: Национальный медико-хирургический центр имени Н.И. Пирогова, 2014.- 32 с.
6. А.А. Рагимов, Г.Н. Щербакова Инфузионно-трансфузионная терапия. - М., РАЕН, 2011. - 410 с.
7. Стандарты качества в службе крови. Под ред. Е.Б. Жибурта. - М.: НПЦ «Интелфорум», 2005. - 256 с.
Отчет о хирургической работе
| № | Показатели | 2017 | 2018 | 2019 |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Количество хирургических коек (в том числе дневных коек) | 16 (1) | 16 (1) | 16 (1) |
| 2 | Число врачей хирургов | 3* | 2** | 1** |
| 3 | Количество операций: всего | 342 | 298 | 200 |
| 4 | Количество плановых операций | 148 | 150 | 35 |
| 5 | Количество операционных больных | 324 | 272 | 196 |
| 6 | Пользованных больных | 432 | 472 | 469 |
| 7 | Хирургическая активность | 75,09 | 57,69 | 41,7 |
| 8 | Умерло оперированных больных | 4 | 0 | 1 |
| 9 | Послеоперационная летальность | 1,23% | 0 | 1 |
| 10 | Число послеоперационных осложнений | 3 | 3 | 1 |
| 11 | % послеоперационных осложнений | 0,93% | 0,99% | 0,99% |
| 12 | Среднее число койко-дней оперированных больных | 9,36 | 9,9 | 9,0 |
| 13 | Средняя длительность предоперационных койко – дней | 1,2 | 1,3 | 1,3 |
| 14 | Средняя длительность послеоперационных койко - дней | 8,16 | 8,6 | 7,7 |
| 15 | Число оперированных больных на 1 хирурга | 324 | 136 | 98 |
| 16 | Число операций на 1 хирурга | 342 | 149 | 100 |
| 17 | Количество операций на 1 койку | 21,38 | 18,6 | 12,5 |
| 18 | Оперированных на койку | 26,5 | 17 | 12,25 |
| 19 | Количество экстренных операций | 194 | 148 | 165 |
*- с сентября 2017 года.
**- с июля 2018 года.
***- с декабря 2019 года.
Более детально представлено на следующих рисунках:
 Рис.1
Рис.1
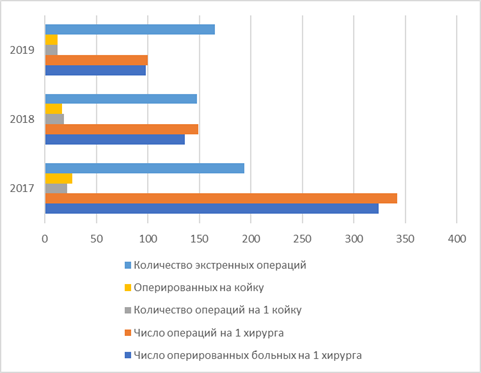 Рис.2
Рис.2
 Рис.3
Рис.3
Пояснительная записка к отчету по хирургической службе
l. Хирургическая служба Амгинского района представлена стационаром на 16 коек (1 дневная койка) в с.Амга и хирургическим приемом в амбулатории. Амгинский район расположен в центральной части РС (Я). Площадь района – 29,4 тыс. квадратных километров. В районе расположены 14 населенных пунктов, 1 из которых заречное. Сообщение с г. Якутском: зимой – автотрасса, летом – автотрасса, затем паромная переправа через реку Лена.
Население района – 16083, из них детей до 14 лет – 4380, подростков – 709 человек, взрослого населения – 10994 человек.
В отделении работали 3 врача – хирурга на 3 ставки до июля 2018 год, после работали 2 врача – хирурга до декабря 2019г., с декабря 2019г. работает 1 врач – хирург. Работают 2 операционных медсестер, 4 постовых медсестер, 2 санитарок оперблока, 4 постовых санитарок, 1 посудница. В отделение анестезиологии и интенсивной терапии работает 2 врача анестезиолога – реаниматолога. Средний возраст врачей 30 лет. Стационар обслуживают в основном молодые специалисты, трудовой стаж которых доходит до 10-ти лет. Тем не менее, работа ведется грамотная, молодые специалисты справляются с поставленными задачами.
Средний возраст медицинских сестер 52 лет. Опытный сформировавшийся коллектив, профессионалы своего дела. Ежегодно проходят квалификацию. Санитарки немаловажное звено в хирургической службе – 5 штатных единиц.
ll. Хирургическое отделение ЦРБ расположено на 2-ом этаже типового каменного здания. Имеется 16 коек, из них: 16 круглосуточных и 1 дневная койка. В хирургическом отделении два операционных зала (экстренный и плановый), две перевязочные (чистая и гнойная), гипсовая комната, ординаторская, процедурный кабинет, столовая для больных, шесть палат (по 3-4 койки). В операционном блоке имеются бестеновые лампы – 2, Martini M1 702, боковой осветитель – 2, Martini M1 501, ОПЛ-М, наркозные аппараты типа Фаза 5 – 1 шт., аппарат для ИВЛ – 2шт., РО – 6 Н, кислородный концентратор – 1, электрокоагуляторы – 2, ЭХВЧ – МТУСИ, ЭХВЧ – 3504 у одного, из которых износ составляет 99,9%. Электроотсосы – 2, ОУМ – 1 и другое.
На одном этаже с хирургическим отделением находится отделение анестезиологии, реанимации и интенсивной терапии (ОАРИИТ) на 4 койки. Здесь работают два врача анестезиолога – реаниматолога, две медсестры – анестезистки (одна из них по совместительству), четыре постовые медсестры, четыре постовые санитарки. В хирургическом отделении работают 1 врач - хирург на 3 ставки, и врач – хирург на 1 ставку в поликлинике.
В целом материально – техническая база соответствует требованиям. В конце 2010 года была установлена интернет-сеть телемедицины для видеоконференций с коллегами в г. Якутске. Оборудование было протестировано и используется по назначению, значительно упрощая и помогая работе хирургического отделения (диагностике, методологии лечения) в с.Амга.
lll. Стационар работает в полноценном режиме. Отделением смешанного типа курируются взрослые и детские хирургические, травмотологические, урологические, ЛОР, глазные, стоматологические, онкологические больные. Неотложная хирургическая и травматологическая помощь в ночное время и в выходные дни оказывается дежурным хирургом. Дежурство ведется врачами на дому по графику, составленному на каждый месяц. Кроме амбулаторной и стационарной работы хирурги участвуют в медосмотрах, медкомиссиях, планово и экстренно выезжают в населенные пункты улуса. Всего за 2019 год выездов было 15 и все плановые.
За год проведено 200 операций, из них:
- экстренные 165,
- планове 35,
- в том числе малых операций 50.
Оперировано 196 больных.
Количество операций снизилось по сравнению с предыдущим годом за счет плановых операций. Стоит учесть, что это также зависит от изменения количества врачей – хирургов.
Планово были проведены следующие операции:
- грыжесечения при ущемленной грыже – 4-м пациентам, из них 3 взрослые и 1 ребенок;
- операция Винкельмана при водянке яичка 1-му ребенку;
- прочие операции на мочеполовой системе (циркумцизии) – 2-м детям и 2-м взрослым старше трудоспособного возраста с рубцовым фимозом;
- операции Мар Мара при варикоцеле 2-3 степени 2-м пациентам – подростку и взрослому;
- операция эпицистостомии – 1-му больному;
- остеосинтез бедренной кости пластиной с УС – 2-м больным;
- 1 остеосинтез бедра гамма штифтом при чрезвертельном переломе;
- остеосинтез костей голени – 6-м больным при закрытых 5-ти переломах костей голени;
- остеосинтез плечевой кости – 1-му пациенту;
- остеосинтез костей предплечья – 5 пациентам;
- остеосинтез ключицы – 9-ти больным;
- остеосинтез при переломах лодыжек голеностопного сустава – 1-му больному;
- пластика АКС - 1-му больному;
- ампутация на уровне бедра по поводу критической ишемии при облитерирующим атеросклерозе – 3-м больным;
- остеосинтез при переломе надколенника – 1-му больному.
- экзартикуляции пальцев кисти при различных травмах – 2 операции;
- операции на костях кисти – 1;
- закрытая репозиция отломков с интрамедуллярным спицевым остеосинтезом
- операции по восстановлению поверхностных сгибателей пальцев кисти при застарелых травмах – 2 операции;
- удаления металлоконструкций различной локализации – 20 операций;
- остеонекрэктамии при отморожениях – 2 больным;
- секвестрэктомия – 1-му больному с хроническим остеомиелитом;
- некротомии и никроэктомии больным с ожогами и поверхностными отморожениями – 4-м больным;
- удаление опухолей (липомы, фибромы, гигромы) – 7;
- скелетные вытяжения – 11;
- внутрисуставное введение заменителей синовиальной жидкости в коленный сустав 10 больным;
- лапароцентез – 1-му больному с асцитом;
- трахеостомии – 2-м больным при ИВЛ, больным с ОНМК.
После плановой операции летального исхода нет.
Экстренно проведены следующие операции:
- аппендэктомии – 60 (дети 29, взрослые 31);
- операции при острой кишечной непроходимости – 3, из них 3 при спаечной болезни;
- лапаротомии – 5, из них 2 при перитонитах, 2 с диагностической целью;
- торакотомии – 3, с ушиванием ранения легкого;
- торакоцентез, дренирование плевральной полости – 10-ти больным при травмах и при плевритах.
- вскрытие тромбированных геморроидальных узлов – 2;
- ПХО обширных ран – 4;
- малые операции пхо ран, вскрытия и дренирования абсцессов и флегмон – 40;
- закрытые вправления вывихов суставов 3 – плечевого сустава, 2 – локтевого сустава;
После экстренных операций осложнений нет.
После экстренной операции 1 больной умер, оперирован по поводу острого мезентериального тромбоза.
Послеоперационная летальность в 2019 году составила 0,52%. Умерло за год в отделении – 2 больных, общая летальность 0,42%.
Структура гистологического исследования операционного материала (количество случаев):
- операции на коже и подкожной клетчатке – 5;
- на костно – мышечной системе – 1;
- на органах брюшной полости – 2;
- на органах грудной клетки – 0;
- операции на нервной системе – 0;
- операции на сосудах – 0;
- операции на органах уха, горла, носа – 0, и т.д.
- острый аппендицит – 60, исследовано гистологически – 60.
Антирабические помощь: обратились – 22. Вакцинировано – 22. Отказ – 0.
На врачебных конференциях и медсоветах заслушивались актуальные вопросы по оказанию первой, до врачебной помощи при термических травмах, холодовых травмах, при СДС, диагностика острого аппендицита, ЖКБ острый каменный и бескаменный холецистистит, первая помощь при травмах конечностей.
Рассмотрены вопросы про раннюю диагностику онкозаболеваний и онконастороженности.
Проблемы и пути их разрешения
Основная проблема хирургического отделения — это отсутствие переносных рентген и УЗИ аппаратов, что резко затрудняет работу как с травматологическими больными, так и при хирургических заболеваниях (ЖКБ – интраоперационной холангиографии, ОКН, травмы ОКГ), как в плановом, так и в экстренном случае.
Для улучшения работы хирургической службы и увеличения плановых операций необходимо доукомплектовать ЛПУ ЦРБ 1 ставкой травматолога либо имеющимся хирургам пройти дополнительные курсы по усовершенствованию: по травматологии, нейрохирургии, проктологии, онкологии и гнойной хирургии.
Для увеличения хирургической активности необходимо расширить разновидности операций при различных заболеваниях путем внедрения новых технологий и методов. Создавая тем самым качественное оказание медицинской помощи, не уступающие другим лечебным заведениям.
Для снижения летальности необходимо проводить активную работу с населением о предосторожности водителей автомобилей, охраны труда. Воспитать нравственность и духовную культуру населения.
В отделении необходим переносной рентген аппарат.
Поздняя госпитализация хирургических больных, которая приводит к риску развития осложнений, зачастую встречается среди направленных из отдаленных наслегов. Необходимы периодические семинары для участковых врачей и фельдшеров по диагностике острой хирургической патологии и хирургической настороженности.
1) Своевременное прохождение курсов усовершенствования по графику врачей – хирургов. Обучение одного хирурга по сосудистой хирургии, проктологии и травматологии для расширения объема плановой оперативной помощи.
2) Довести категорийность врачей и среднего медперсонала до 100%.
3) Для овладения техникой лапароскопических операций приобрести операционный лапароскоп с эндоскопической стойкой с обучением специалистов.
4) Приобрести рентгенустановку для интраоперационных исследований с видеоприставкой.
5) Для улучшения материально – технической базы необходимо улучшить оснащение оперблока взамен изношенного.
6) Организовать постоянную работу по контролю качества деятельности отделения и хирургического кабинета поликлиники.
7) Хорошо порекомендовала программа «каникулярные дни», когда на оперативное лечение в отделение поступают дети школьного возраста в каникулярные дни.
8) Не маловажную роль играет диспансеризация населения, при котором и выявляются пациенты и больные с хирургической патологией, которые при тесной работе с участковыми врачами и врачами амбулатории направляются на госпитализацию, не оседая в ожиданиях.
ПРИЛОЖЕНИЕ
1. Фото в операционной.
2.Ответы на тест цикла:
| 1 | в |
| 2 | г |
| 3 | г |
| 4 | г |
| 5 | в |
| 6 | г |
| 7 | а |
| 8 | а |
| 9 | г |
| 10 | б,в |
| 11 | б |
| 12 | а |
| 13 | а,в,г |
| 14 | а |
| 15 | в |
| 16 | г |
| 17 | а,б,г,д |
| 18 | б |
| 19 | д |
| 20 | б |
| 21 | е |
| 22 | а,в,г |
| 23 | д |
| 24 | в |
| 25 | а,б |
| 26 | 2 |
| 27 | а |
| 28 | в |
| 29 | а |
| 30 | в |
| 31 | г |
| 32 | в |
| 33 | е |
| 34 | е |
| 35 | г |
| 36 | д |
| 37 | а |
| 38 | а |
| 39 | б |
| 40 | а |
| 41 | б |
| 42 | б |
| 43 | в |
| 44 | а |
| 45 | а |
| 46 | а |
| 47 |
|
| 48 |
|
| 49 |
|
| 50 |
|
| 51 |
|
| 52 |
|
| 53 | г |
| 54 | б |
| 55 |
|
| 56 | г |
| 57 | а |
| 58 |
|
| 59 |
|
| 60 | в |
| 61 |
|
| 62 |
|
| 63 |
|
| 64 |
|
| 65 |
|
| 66 | б |
| 67 |
|
| 68 | б |
| 69 | д |
| 70 | а |
| 71 |
|
| 72 |
|
| 73 | а |
| 74 | д |
| 75 | б |
| 76 | а,в |
| 77 |
|
| 78 | д |
| 79 | г |
| 80 | б |
| 81 |
|
| 82 |
|
| 83 | а |
| 84 | б |
| 85 | а |
| 86 |
|
| 87 | б |
| 88 | в |
| 89 | а,б |
| 90 |
|
| 91 | в |
| 92 | а |
| 93 |
|
| 94 |
|
| 95 |
|
| 96 | а,д,ж |
| 97 | а,в,д |
| 98 | а |
| 99 | г |
| 100 | г |
Дата добавления: 2021-01-21; просмотров: 33; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
