Методы защиты металлов от коррозии.
Коррозия металлов.
Коррозией называется разрушение металла в результате ее химического или электрохимического взаимодействия с окружающей средой. Этот процесс есть окислительно-восстановительным, гетерогенным и протекает на границе двух сред – твердой и газообразной, или жидкой.
По механизму протекания процесса различают два типа коррозии: химическую и электрохимическую.
1. Химической коррозией называется разрушение металла окислением его в окружающей среде без возникновения электрического тока.
В этом случае ОВР происходит путем перехода электронов от атома металла к частице окислителя, который находится в окружающей среде (например, действие сухих газов, жидких неэлектролитов, например керосина, или бензина). Здесь нет пространственного разделения процессов окисления и восстановления, и потому электрический ток не возникает.
Больше вреда приносит разновидность химической коррозии – так называемая газовая коррозия, то есть соединение металлов с кислородом воздуха.
При окислении металлов на их поверхности образуется пленка (слой окиси, которая при увеличении ее толщины, все больше препятствует кислороду, или другому окислителю, взаимодействовать с металлом). При комнатной температуре часто пленка изолирует металл от воздуха, и дальнейшая скорость окисления металла становится практически нулевой. При повышении температуры скорость диффузии окислителя быстро увеличивается, и окисление становится более интенсивным.
|
|
|
Например: при 250-300 °С на железе возникает видимая пленка оксидов 2Fe +O2 = 2FeО; при 600 °С и выше получается слой окалины FeО; Fe3O4; Fe2O3. Она не защищает железо от дальнейшего окисления, поскольку имеет трещины и поры, которая облегчает доступ кислорода к металлу.
Газовая коррозия протекает более интенсивно во влажной среде (ржавление железа). Наибольшая интенсивность этого процесса при относительной влажности >65%, так как при этом бурая ржавчина Fe2O3×n(FeО(OH) и Fe3O4, Fe2О3 ) гигроскопическая, притягивает и удерживает влагу.
Газовая коррозия металлов интенсифицируется в присутствии примесей SO2; CO2; Cl2. таким образом, химическая коррозия во влажной среде уже перерастает в электрохимическую и протекает в пленке воды.
2. Электрохимическая коррозия – это разрушения металла в среде электролита с возникновением внутри системы электрического тока. Основное отличие электрохимической коррозии от химической в том, что в первом случае восстановление металла окислителем может быть пространственно распределено на два процесса: анодный и катодный.
Анодный процесс – разрушение, окисление металла – переход ионов металла в раствор
|
|
|
Me + mH2O ® Me+n × (H2O)m +ne- (11.1)
Если других электродных процессов не было бы, то этот анодный процесс очень скоро прекратился бы.
Катодный процесс – это восстановления окислителей (деполяризаторов), которые присутствуют в среде (ионы и молекулы, которые восстанавливаются в среде на катоде называются деполяризаторами).
Главным катодным процессом есть:
а) коррозия с водородной поляризацией
2H+ + 2e- = H2 (11.2)
протекает для активных металлов в кислой среде.
б) кислородная деполяризация в нейтральных и щелочных средах:
O2 + 2H2O + 4e- ® 4OH- (11.3)
(в контакте с влажным воздухом, морской водой и у нейтральных растворов).
в) кислородная деполяризации в кислой среде
O2 + 4H+ +4e- ® 2H2O (11.4)
(неактивные металлы, например, медь в кислотах).
Оба этих процесса протекают одновременно и не могут протекать один без другого.
ЕК > ЕА всегда.
В соответствии с теорией электрохимической коррозии она может рассматриваться как общий результат работы многих микрогальванических элементов, которые возникают на поверхности металла при его контакте с растворами или расплавами электролитов. Их отличие от обычных гальванических элементов в том, что они, как правило, накороткозамкнуты, т.е. проводником тока, который возникает в гальваническом элементе (от анода к катоду), есть сам металл, который корродирует.
|
|
|
Гальванические элементы возникают в 3-х случаях:
1. Два разных метала в контакте между собою и в электролитах.
2. Химическая или физическая неоднородность металла, который в контакте с электролитом.
3. Разные условия, в которых находятся разные участки металла (t, концентрация электролита).
Как было сказано на предыдущещей лекции, как только начинают работать коррозийные гальванические элементы, то возникает гальваническая деполяризация, что замедляет процесс.
Интенсивность коррозии металлов зависит не только от анодной и катодной поляризации, но и от окислительной активности водородного и кислородного электродов, которые работают на катоде, активность которых сильно зависит от характера среды (по формуле Нернста).
а) 2H+ + 2e = H2 ; Е 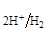 =Е°
=Е° 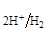 +
+ 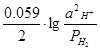 .
.
Кислая среда РН2 = 1 атм.; аН+ = 1 г×ион/л; Е 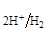 = 0 В
= 0 В
Нейтральная среда РН2 = 1 атм.; аН+ = 10-7 г×ион/л; Е 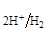 = -0.41 В
= -0.41 В
Щелочная среда РН2 = 1 атм.; аН+ = 10-14 г×ион/л; Е 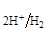 = -0.82 В
= -0.82 В
|
|
|
б) аналогично О2 + 2Н2О +4е- = ОН-
Е 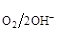 =Е°
=Е° 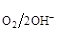 +
+ 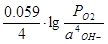 .
.
Тогда в кислой среде РО2 = 1 атм.; аОН- = 10-14 г×ион/л; Е 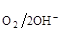 = 1.22 В
= 1.22 В
в нейтральной среде РО2 = 1 атм.; аОН- = 10-7 г×ион/л; Е 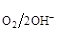 = 0.81 В
= 0.81 В
в щелочной среде РО2 = 1 атм.; аОН- = 1 г×ион/л; Е 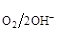 = 0.40 В
= 0.40 В
Эти цифры верны лишь в случае платинового катода, покрытого слоем губчатой платины. Если материал катода будет другой, они будут более отрицательными. Это связано с явлением перенапряжения водородного и кислородного электродов на катоде.
Явление перенапряжения связанное с катодной поляризацией, от чего потенциалы водородного или кислородного электродов, которые имеют место на катоде, становятся более отрицательными.
Например, для железа Е 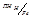 , для водородного электрода –0.36 В, а для кислородного –1.07 В.
, для водородного электрода –0.36 В, а для кислородного –1.07 В.
Поэтому коррозия будет идти лишь тогда, если ЕMe<Елаб + ЕПН.
Например, Fe в воде: рН»7; Е  =-0.40 В, Е
=-0.40 В, Е 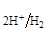 = -0.41В; j
= -0.41В; j 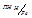 = -0.36В.
= -0.36В.
Коррозия не протекает потому, что Е  =-0.40>-0.40-0.36=-0.76 В
=-0.40>-0.40-0.36=-0.76 В
но Е 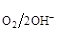 = 0.81 В, Е
= 0.81 В, Е 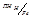 = -1.07 В, -0.40<0.81+(-1.07)=-0.26 B.
= -1.07 В, -0.40<0.81+(-1.07)=-0.26 B.
Таким образом, коррозия железа в воде происходит при окислении растворенных кислородом (-0.40 < -0.26), а не ионами водорода молекул воды H+ (-0.40 В > -0.77 В).
Методы защиты металлов от коррозии.
Важнейшие типы коррозии.
1. Атмосферная коррозия (наиболее распространенная).
2. Грунтовая коррозия (кислотность грунта, разная аэрация – участок, который хуже снабжается воздухом – анод, или на нем нет оксидной пленки).
3. Коррозия под действием блуждающих токов
Защита от коррозии:
1. Изоляция металла от коррозийной среды.
2. Электрохимическая защита.
3. Изменение свойств коррозийной среды (изменение состава среды).
4. Изменение свойств металла.

1. 
 Изоляция металла от коррозийной среды.
Изоляция металла от коррозийной среды.
 |
Использование защитных покрытий


 а) металлические б) неметаллические в) химические
а) металлические б) неметаллические в) химические
 |  | ||


анодные катодные
а) Металлические покрытия наносят :
1. горячим способом (железо покрывают Zn, Sn);
2.  металлизация (железо покрывают Al, Zn, Su, Cu);
металлизация (железо покрывают Al, Zn, Su, Cu);
3. диффузным способом;
4. методом электролиза (гальванопокрытие Cr; Ni; Cu; Au; Ag) анодные или катодные – по тому активнее или нет металл покрытия, защищаемого металла. Если более активный, то анодное покрытие, если менее активный – это катодное.
5.
Пока не разрушена герметичность защитного слоя принципиальной разницы действия анодного и катодного покрытия нет. Но как только нарушается герметичность, возникают условия для возникновения гальванопар:
| Анодное покрытие | Катодное покрытие | ||
|
Zn Fe
ЕZn < ЕFe | Н2О = Н+ + ОН-
Fe
ЕSn >ЕFe | ||
| А) Zn – 2e- ® Zn2+ | А) Fe – 2e- ® Fe2+ | ||
| К)кислая среда 2Н+ + 2е ® Н2 водородная деполяризация продукты коррозии Zn2+ + 2Cl- ® ZnCl2 | Влажный воздух O2+2H2O+4e-®4OH- Кислородная деполяризация Продукты коррозии Zn2+ + 2ОН- ® Zn(ОН)2 | к) кислая среда 2Н+ + 2е ® Н2 водородная деполяризация продукты коррозии Fe2+ + 2Cl- ® FeCl2 | влажный воздух O2+2H2O+4e-®4OH-
кислородная деполяризация
продукты коррозии
Fe2+ + 2ОН- ® Fe(ОН)2
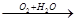 Fe(OH)3®FeООН Fe(OH)3®FeООН
|
| Разрушается покрытие | Разрушается защищаемый металл | ||
б) неметаллические покрытия: лаки, краски, масла, битумы, эмали, полимеры (пластмассы, каучук)
в) химические покрытия – которые получаются искусственно с помощью специальной обработки металла химическими реактивами:
1. оксидирование Fe; Fe2O3; Fe3O4; Al2O3 – образование слоя оксидов;
2. фосфатирование: образование слоя солей Fe3(PO4)2; Мп3(PO4)2 и прочие.
Искусственная пленка уменьшает интенсивность коррозии.

2. Электрохимическая защита.
 |  |


протекторная электрозащита
защита
а) протекторная защита: конструкцию, что защищают, в среде электролита соединяют со специальным анодом – протектором – более активным металлом, чем металл конструкции. В процессе коррозии протектор, как анод, разрушается, предотвращая тем самым разрушению конструкции.
б) электрозащита – защищаемая конструкция в среде электролита соединяется с куском старого металла (рельс, балка), что в свою очередь соединяется с анодом внешнего источника тока. Разрушается анод, а катод сохраняется.
3. Изменение состава среды.
К электролиту вводят вещества, которые называют замедлителями коррозии – ингибиторами. Они изменяют j металла в данной среде и приближают его к электродному потенциалу малоактивных металлов.
Анодные замедлители коррозии: Na2CO3, фосфаты, силикаты, хроматы, нитраты. Они адсорбируются на поверхности металла, уменьшают площадь анодных участков и замедляют коррозию.
Катодные замедлители коррозии: соли Mg; Zn; Ni, которые уменьшают площадь катодных участков.
4. Изменение свойств металла.
Легирование: специальные стали; добавки Cr, Al, Si, Ni, Mn, Ti, Nb, которые значительно повышают защитные свойства высокотемпературной окалины (повышается склонность сплавов к пассивации).
Дата добавления: 2021-01-21; просмотров: 46; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 Н2О = Н++ОН-
Н2О = Н++ОН- Sn
Sn