Важнейшие классы неорганических веществ
Химия ЕГЭ.
Повторение основного материала 8-9 класс
Химия 8 класс. Все формулы и определения.
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии




Основные определения в 8 классе
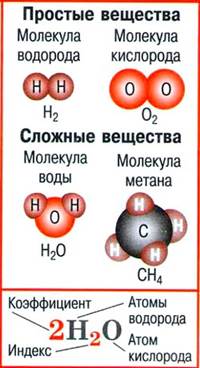
· Атом — мельчайшая химически неделимая частица вещества.
· Химический элемент — определённый вид атомов.
· Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
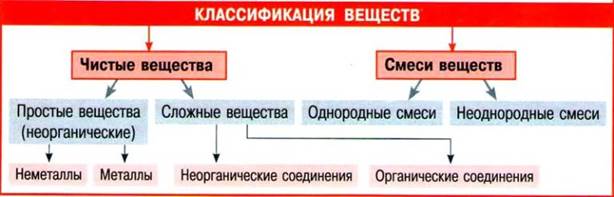
· Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
· Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
· Качественный состав вещества показывает, из атомов каких элементов оно состоит.
· Количественный состав вещества показывает число атомов каждого элемента в его составе.
· Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
· Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
· Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
· Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
· Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
· Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
|
|
|
· Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
· Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
|
|
|
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

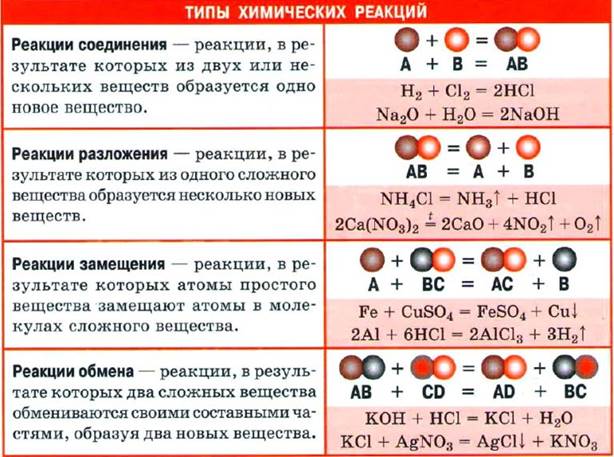
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
· Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Важнейшие классы неорганических веществ
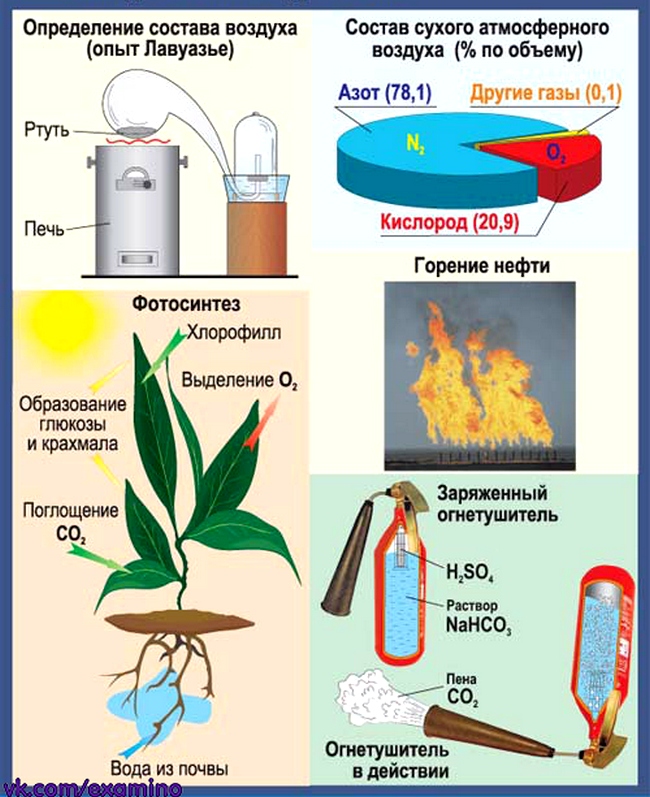
Воздух. Кислород. Горение
Дата добавления: 2021-01-21; просмотров: 123; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
