Экспериментальные исследования
Олег Павлович Спиридонов
Людвиг Больцман: Жизнь гения физики и трагедия творца

О.П. Спиридонов
ЛЮДВИГ БОЛЬЦМАН
Жизнь гения физики и трагедия творца
Предисловие
Книги об ученых, поэтах, композиторах всегда были и будут одними из любимых книг школьников. Существует, однако, огромная объективная разница в восприятии шедевров, созданных этими гениями. Если чарующая легкость пушкинского стиха, титаническая сила бетховенских творений обращены непосредственно к нашим чувствам и находят эмоциональный отклик в душе каждого, будь то ребенок или умудренный жизненным опытом человек, то для правильного понимания и оценки интеллектуальной мощи научных идей требуется определенный уровень знаний. Это предъявляет к книгам об ученых особые требования. Они обязаны, помимо чисто художественной стороны изложения, исподволь готовить учащегося к постижению научных идей, стать для него как бы небольшими пособиями в той области знаний, которой посвятил себя данный ученый. Трудности обучения при этом становятся практически незаметными, поскольку знакомство с биографией выдающегося человека естественно и органично переходит в интерес к его научной деятельности, ибо судьба ученого – это прежде всего служение науке. Борьба идей, без которой немыслимо развитие науки, становится наиболее существенной чертой его жизненного пути, нередко придавая ему поистине драматическое звучание.
|
|
|
Яркой иллюстрацией сказанному является полная высочайших творческих достижений и глубокого внутреннего напряжения жизнь гениального австрийского физика Людвига Больцмана (1844‑1906). Ни один из современных учебников физики – от школьного до солидных университетских курсов – не обходится без систематического упоминания его трудов, явившихся бесценным вкладом в развитие прекрасной науки о природе – физики. Но при жизни Больцмана его новаторские, основополагающие работы и идеи не получали должного понимания и признания. Во времена, когда существование атомов было гипотезой, не доказанной прямыми опытами, вера Больцмана в их реальность, развитие им атомно‑молекулярной теории были предметом резких выпадов в его адрес со стороны противников атомизма, представителей различных идеалистических школ. Величайшей заслугой Больцмана является то, что он принял этот вызов и вступил в борьбу за свои идеи. В этой борьбе от него потребовалось все: мощь разума и мудрость философа, задор полемиста и стойкость борца. Время показало, насколько глубоко был прав Больцман в своих предвидениях.
Портрет Больцмана был бы неполным, если бы в этой книге мы ограничились только анализом его научных работ. Да это и невозможно, ибо, читая Больцмана, трудно отделаться от впечатления, что с вами разговаривает реальный собеседник. Мы видим то живого и остроумного человека, пленяющего нас глубиной мысли и мягким юмором, то великолепного педагога, четко и ясно излагающего самые трудные вопросы физики. Мы попадаем под обаяние этого человека, непримиримо отстаивающего свои позиции, но при этом ведущего самые острые дискуссии в духе высокого благородства и уважения к противнику. Всесторонне образованный человек, знаток литературы, почитатель Гёте и, особенно, Шиллера, прекрасный пианист, тонко понимающий и чувствующий музыку, Больцман и к оценке физических теорий подходил с эстетических позиций, превыше всего ценил в них красоту и изящество. Наука и искусство сливались у него в единый комплекс общечеловеческой культуры, так же как неотделимы друг от друга истинность совершенных творений искусства и красота научных истин. «Для чего нужно, хотелось бы спросить, – восклицал он, – исключительное культивирование жизни, направленной на получение практических выгод за счет того, что единственно дает жизнь жизни, что делает ее ценной, – за счет стремления к идеалам?» Знакомство с жизнью Людвига Больцмана позволит учащимся понять чистый и светлый образ рыцаря науки и ее великого труженика, глубже понять и полюбить физику.
|
|
|
|
|
|
Глава 1.
ДИАЛОГ
Развитию атомно‑молекулярной теории посвящены наиболее значительные работы Людвига Больцмана. Гипотеза о том, что мир состоит из атомов, впервые возникла более 2500 лет назад в Древней Греции. Вряд ли стоило начинать наш рассказ со столь отдаленных времен, если бы значение идеи об атомах исчерпывалось признанием ее только как физической теории. Споры вокруг этой идеи были, по существу, спорами о происхождении и познаваемости мира – был ли он создан божьей волей и непознаваем или мир состоит из вполне материальных частиц (атомов), которые могут служить объектом изучения. Предметом дискуссии был также принципиальный вопрос о различных путях развития науки. Если признать существование атомов, т. е. зернистость, прерывистость (дискретность) строения материи, задачей науки становится изучение свойств этих мельчайших частиц. Если же признать непрерывность материи, то задачи познания существенно сужаются (зачем делить воду, если при делении мы будем получать то же химическое соединение?). Еще в Древней Греции аргументы сторонников и противников атомизма содержали в себе практически все элементы длительного и острого спора, в завершающей и наиболее острой стадии которого на рубеже XIX и XX вв. принимал активное участие Больцман. Вскоре после его смерти и во многом благодаря его трудам спор завершился признанием справедливости атомной теории. Чтобы оценить величие вклада Больцмана в развитие атомной теории материи, необходимо коротко познакомиться с тем сложным и увлекательным путем, который прошла в своем развитии атомная гипотеза от момента ее зарождения до появления первых работ Больцмана.
|
|
|
Колыбель теории
В VII‑VI вв. до н.э. в Европе на юге Балканского полуострова образовалось могучее государство – Древняя Греция, или Эллада. Успехи народов Эллады в архитектуре, литературе, изобразительном искусстве, различных областях науки и техники составляют значительную часть той основы, на которой успешно развивается мировая культура. Выражение «Древняя Греция – колыбель европейской культуры» стало классическим. Высоко оценивали эти достижения К. Маркс и Ф. Энгельс. Греческое искусство и эпос, писал К. Маркс, «…еще продолжают доставлять нам художественное наслаждение и в известном отношении служить нормой и недосягаемым образцом»{1}. Отмечая высокий уровень развития науки и культуру мышления древнегреческих философов, Ф. Энгельс подчеркивал, что «это одна из причин, заставляющих нас все снова и снова возвращаться… к достижениям того маленького народа, универсальная одаренность и деятельность которого обеспечили ему в истории развития человечества место, на какое не может претендовать ни один другой народ»{2}.
Наука и искусство развивались в Греции параллельно, как две взаимно дополняющие друг друга грани человеческой культуры. Казалось бы, зачем ломать голову над научными проблемами, когда можно вполне беззаботно жить (знатных людей обслуживали рабы), наслаждаться искусством, спортом. Но, как мудро заметил один из самых въедающихся философов Древней Греции Аристотель (384‑322 гг. до н.э.), «когда оказалось налицо почти все необходимое, а также то, что служит для облегчения жизни и препровождения времени, тогда стало предметом поисков… разумное мышление». Неистребимая тяга к «разумному мышлению» – столь же присущая человечеству черта, как и искусство. Не случайно одним и тем же именем – творец – называют Моцарта и Эйнштейна, Рахманинова и Лобачевского, одним и тем же словом – творение – называют картины Брюллова и научные работы Больцмана!
Философы Эллады задумывались над решением таких проблем, полного объяснения ряда которых не получено и до сих пор. При этом они не ограничивались сбором и описанием наблюдений, а стремились найти первопричины явлений. Различные научные взгляды детально обсуждались ими в ходе многочисленных дискуссий, которые греки считали наилучшим способом познания истины. Широко распространенный термин «диалектика» взят из греческого языка и означал ранее искусство вести беседу, спор. (Позднее под диалектикой стали понимать метод познания действительности в ее развитии и самодвижении, науку о самых общих законах развития природы, общества и мышления.) Именно в Древней Греции было завершено объединение отдельных знаний в самостоятельные науки, получившие названия: «физика» – от греч. «природа», «ботаника» – от «растение», «политика» – от «государство».
Несмотря на явный недостаток опытных результатов и их неточность, некоторые гипотезы греков о причинах тех или иных явлений нашли экспериментальное подтверждение лишь в наши дни. С позиций современности многие из этих предположений могут показаться фантастикой, но в течение долгого времени они были для ученых поводом для размышлений и исследований. Возьмем в собеседники Людвига Больцмана{3} и послушаем его оценку идей древнегреческих философов:
«Фантазия – колыбель теории, наблюдающий разум – ее воспитатель. Какими детскими были первые теории Вселенной от Пифагора и Платона до Гегеля и Шеллинга! Фантазия была могла слишком продуктивна, а самопроверки посредством эксперимента недоставало… все‑таки они содержали в себе зародыши всех позднейших великих теорий: теории Коперника, атомистики, механической теории невесомых веществ, дарвинизма и т.д.»
Кто знает, не повторится ли ситуация через несколько веков, когда современная физика, которой мы сейчас гордимся, станет столь же архаичной, как и античная в наше время, а фантазии XX в. станут предметом научных исследований будущих поколений ученых.
Одним из самых фундаментальных вопросов, обсуждавшихся древнегреческими учеными, был вопрос о происхождении и устройстве мира. Они отрицали идею сотворения мира из ничего, божеством. Например, еще в IX в. до н.э. Гесиод считал, что первичным элементом, из которого состоят все тела, является земля. Фалес полагал, что таким первичным элементом является вода, Анаксимен – воздух, Гераклит – огонь. При всей наивности этих предположений общим и главным в них является представление о первичном элементе, из которого строится остальной мир, а не о боге‑создателе. Эмпедокл допускал одновременное существование четырех первичных элементов – огня, воздуха, воды и земли. Определенный шаг вперед сделал учитель Аристотеля – Платон, допуская возможность превращения одних первичных элементов в другие. Аристотель вводит некий единый первичный элемент – субстрат, который всегда выступает в сочетании с двумя качествами и образует четыре элемента‑стихии:
субстрат + тепло и сухость = огонь,
субстрат + тепло и сырость = воздух,
субстрат + холод и сырость = вода,
субстрат + холод и сухость = земля.
Количественные изменения одного из качеств могут, по Аристотелю, превращать один элемент в другой. Правда, определить, какие свойства и как они должны смешиваться, чтобы создать то или иное вещество, должен был некий высший «разум» (?).

Демокрит
Наиболее важные черты этих теорий – существование первичных элементов и возможность их взаимного превращения – были в дальнейшем, правда, в радикально измененной форме, подтверждены наукой. Но в то же время это были теории непрерывной материи, являющейся сплошной и равномерной массой. Принятие этой точки зрения, как уже отмечалось, сужало область физических исследований.
Принципиально иную точку зрения на строение материи выдвинул и развил Демокрит. Вещества состоят из маленьких неделимых частиц, утверждал он. Эти частицы получили название «атомы», от греч. «атомос» – неделимый. Демокрит говорил, что есть только атомы и пустота. Его взгляды на движение атомов выглядят почти современными: «…атомы, в течение всей вечности, носясь вверх и вниз, или сплетаются между собой каким‑нибудь образом, или наталкиваются друг на друга, расходятся и сходятся снова между собой в такие соединения и таким образом, что они производят все прочие сложные тела и их состояния и ощущения». Демокрит впервые сформулировал принципиальное положение о том, что движение есть присущее материи изначальное свойство. Это легло в дальнейшем в основу кинетической теории вещества.
Итак, высказаны две противоположные точки зрения на строение вещества. По Демокриту, вещество прерывисто, зернисто, или, как принято говорить, дискретно. По Аристотелю, вещество является непрерывной материей. Какая из этих теорий верна? Для своего решения этот спор потребовал почти 2500 лет. Пока же оценить эти воззрения поможет мудрое замечание Л. Больцмана:
«Первое воззрение глубже проникает в сущность вещей, второе – более свободно от недоказуемых гипотез».
Несмотря на то что в дальнейшем тезис о неделимости атомов оказался несостоятельным, ценность для развития науки гипотезы Демокрита, «глубже проникающей в сущность вещей», переоценить невозможно, так как
«…гипотезы, лающие место фантазии и более смело выходящие за рамки имеющегося материала, будут всегда побуждать к новым исследованиям и приводить к совершенно непредвиденным открытиям».
Последовательно развивая свои идеи, Демокрит полностью отрицал существование любых нематериальных объектов (например, души). Даже боги состоят из атомов, смело утверждал он и объяснял веру в богов только страхом и беспомощностью людей перед грозными и непонятными в то время явлениями природы. Материалистическое мировоззрение Демокрита разделялось далеко не всеми. Платон, признавая существование объективного мира, считал его отражением потустороннего мира идей. Познание истины, по Платону, – это воспоминание о том, что душа созерцала до рождения. Аристотель вообще не придерживался какой‑либо четкой позиции в этом споре, сочетая в своих взглядах признание объективного существования мира и его познаваемости с верой в существование богов. Уже в то время борьба материалистического и идеалистического мировоззрений становится настолько острой, что Платон даже приказывал своим ученикам сжигать книги Демокрита.
«…в проблемах общею характера самые противоречивые воззрения находят своих сторонников, часто абсолютно не понимающих друг друга, несмотря на то что в специальных вопросах они единодушны и работали сообща».
Мы закончим наш рассказ о Древней Греции коротким обсуждением важнейшей проблемы, до сих пор не решенной до конца, несмотря на громадные усилия многих поколений ученых. Эта проблема также имеет непосредственное отношение к теме нашей книги, поскольку в творениях Больцмана были указаны новые пути ее решения. Речь пойдет о причинах или источниках развития.
«Разрешением великого вопроса: каким образом мы произошли, куда мы идем в течение тысячелетий, занимались величайшие гении, ставившие его самым глубокомысленным образом и так и этак».
Интересной иллюстрацией к этому полушутливому, но на самом деле до предела серьезному замечанию Больцмана служат высказывания древнегреческих ученых. Так, Демокрит утверждал, что движение каждого атома подчиняется строгим законам. Он развивал мысль о жесткой причинности всех явлений, о возможности достижения достоверного знания. Если следовать данной точке зрения, то это означало бы, что со временем все происходящее в природе можно было бы предсказать заранее, задать развитие мира на сколь угодно длительное время. При этом исключалось бы появление новых видов животных и растений, исчезло бы понятие эволюции.
Не все соглашались с этим. Последователь Демокрита Эпикур отказывался признавать строгую причинность. Приписав атомам еще одно свойство – вес, он утверждал, что им присущи не только те движения, которые обусловлены тяжестью и взаимными столкновениями атомов друг с другом, но и иные непредсказуемые, самопроизвольные, или, как в дальнейшем стали говорить, спонтанные, движения. Именно в этих отклонениях от жесткой необходимости, случайности видел Эпикур причины развития, которые избавляли мир от действия рока законов.
Конечно, идеи непредсказуемости движения атомов, случайности были далеко не очевидными. Как во времена Эллады, так и много позднее они вызывали долгие и ожесточенные споры. «Ничего более позорного не может случиться с физиком!» – так уничтожающе отрицательно говорил об идее Эпикура великий оратор древности Цицерон.
«Несмотря на все насмешки, стремление создавать теоретическое воззрение на вещи внешнего мира было непреодолимо в груди человека; из этого стремления непрестанно рождались все новые ответы».
Эпикур был не одинок в предсказании роли случайности в эволюции. Задолго до появления теории Дарвина Эмпедокл объяснял происхождение различных животных результатом отбора. По его курьезной теории случайные комбинации различных органов (ног, хвостов, туловищ) подвергались действию двух противоборствующих сил – Любви и Вражды. Неудачные сочетания уничтожала Вражда, появившиеся случайно удачные комбинации брала под свою защиту Любовь и наделяла их признаками пола, давая им тем самым способность к размножению. Замечательные мысли о развитии путем единства и борьбы противоположностей высказывал Гераклит: «Противоборствующее соединяет, из несогласия создается прекраснейшая гармония, все бывает благодаря распре».
Поиски пути
Древнегреческий период был удивительной эпохой в истории человечества, до сих пор сохраняющей для нас свое значение и привлекательность. Искусство Эллады сразу и прочно завоевало свое место в мировой культуре как «норма и недосягаемый образец». К сожалению, этого нельзя сказать о ее научных достижениях. Современный читатель понимает, как далеки от истины и зачастую наивны многие их гипотезы. И все же мы должны помнить, что наука опирается на накопленный веками опыт огромной и серьезной работы ученых. Не будем слишком строгими к некоторым предположениям ученых далекого времени. Наука еще должна была развиваться, преодолевая ошибки и заблуждения, рассчитывая на свои силы.
Вы уже знаете, что в вопросе об устройстве мира мнения греков разделились – бескомпромиссному материализму Демокрита противостояло учение о «высшем разуме» Аристотеля. Греки оставили нам и свой метод достижения истины – споры, дискуссии. Но в спорах иногда случается, что обладающий большими знаниями человек навязывает собеседнику свою точку зрения как единственно правильную. Спор при этом, естественно, прекращается, но установлена ли истина? Не окажется ли правым по мере увеличения знаний побежденный ныне? Очевидно, что метод «силового давления» никак не применим при решении спорных научных вопросов. Но если словами делу не поможешь, должен существовать какой‑то иной путь достижения истины. Каков он, пока не ясно.
Силовые попытки решения спорных проблем имели место в дальнейшей судьбе идей Демокрита и Аристотеля. Рабовладельческий строй сменяется феодальным, но наука и искусство приходят в упадок. Для этого были объективные причины. Появление многочисленных раздробленных феодальных хозяйств привело к опустению городов, затруднило общение людей. Доступ к научным знаниям становится практически невозможным, культура уступает место невежеству. Грамотные люди встречаются только среди духовенства, да и то их умение читать направлено на изучение положений священных книг и их пропаганду. Единственной владелицей человеческих душ становится религия, проповедующая послушание, аскетизм, отказ от земных радостей во имя вечного блаженства в загробном мире. Объявляется крестовый поход на все, что направлено против церковных догматов, особенно против материалистических учений древних греков. Даже слово «атом» исчезает из употребления и заменяется на латинское «корпускула» в соответствии с принятым для обучения в монастырских школах языком. Силой насаждаются учение Аристотеля, пропаганда его религиозного, идеалистического содержания. За словами неизбежно следуют дела, и вот уже в 391 г. фанатики громят Александрийскую библиотеку, в 529 г. закрывается последняя философская школа в Афинах, а сами ученые с позором изгоняются из города. Человечеству навязывают библейские представления о том, что Земля является плоской, а за покрывающим ее небесным сводом живут ангелы, архангелы и боги. Отсутствие науки создает благоприятную почву для возникновения лженаук – белой и черной магии, астрологии и т. д.
Тем, что научные достижения древних греков не пропали бесследно, мы обязаны арабам. В V‑VI вв. н.э. они переводят на свой язык труды ученых Эллады, внимательно изучают и по‑своему развивают их. Уверовав в возможность превращения элементов друг в друга, они создают особую науку (алхимию) об искусстве превращения неблагородных металлов в золото с помощью некоего философского камня. Счастливцу, открывшему секрет философского камня, были бы уготованы вечная молодость и несметные золотые богатства.
«Часто говорят, что всем в мире управляет золото, и думают, что этим высказывают высшую мудрость. Конечно, золото – гениально изобретенный измеритель ценности; обладание им желательно для многих хороших целей… но, с другой стороны, я хотел бы знать, какое настоящее благо, надолго удовлетворяющее человека, можно купить за золото, и не трудно, пожалуй, показать, что человеческое стремление направлено не к золоту, а к истине».
В XII в. алхимия перекидывается в Европу. Но и тут все попытки отыскания философского камня были бесплодны. Отсутствие элементарных научных сведений, бессистемность поисков, вера в авторитеты – вот что характерно для этого периода в развитии науки. Со свойственной ему прямотой отзывался об алхимии позже Петр I: «Тот, кто выдает себя делателем золота, должен быть или обманщиком, или невеждой в химии». Все же усилия алхимиков не были напрасными – они ввели в лабораторный обиход множество новых веществ, методов их очистки и обработки, создали первые описания химических реакций, значительно расширив тем самым круг химических знаний.
В XIII в. в Европе вновь развиваются города как центры торговли и различных ремесел. Одновременно с этим увеличивается потребность в грамотных людях и специалистах. Открываются светские школы, основываются университеты, но обучение в них еще полностью контролируется церковью. Преподаватели‑схоласты (от греч. scholastikós – ученый) учат слепой вере в божественное происхождение всего сущего, отрицают необходимость исследования природы, объясняя все ее проявления ссылками на мифические «скрытые качества». Химия тех лет представляется сводом рецептов изготовления различных смесей и справедливо называется искусством, а не наукой. Для объяснения различных физических фактов применяются туманные рассуждения о каких‑то непознаваемых «эфирах» и «флюидах». Науке явно не хватает данных для обобщения и анализа полученных результатов, не виден путь, который позволил бы надеяться на ее дальнейшее успешное развитие.
Общество, как и любой организм, непрерывно развивается. В этом движении есть и детские стадии, есть и периоды застоя, но сама тенденция к развитию вечна. Средневековые оковы очень скоро стали так же тесны человечеству, как и архаика рабства. Рост деловой активности приводит к тому, что положение человека в обществе перестало полностью определяться его родословной, по достоинству стали оцениваться знания, ум, воля и деятельность отдельной личности. Значительные сдвиги происходят и в мировоззрении людей. Изучению божественного все чаще противопоставляется изучение самого человека, его роли и места в мире. Это новое мировоззрение получило выразительное название «гуманизм» (от лат. humanos – человеческий).
Большим переменам подвергается и наука, она как бы переживает свое второе рождение. Провозглашается право на свободу научных исследований, происходит отделение науки от церкви. Меняется подход к изучению явлений природы, все шире распространяется понимание того, что законы, управляющее миром, являются объективными внутренними законами природы, развивающейся как живой и сложный организм. Укрепляется мнение о возможности постижения человеком этих закономерностей. Научные исследования получают поддержку зарождающегося буржуазного общества. «Буржуазии для развития ее промышленности нужна была наука, которая исследовала бы свойства физических тел и формы проявления сил природы. До того же времени наука была смиренной служанкой церкви и ей не позволено было выходить за рамки, установленные верой; по этой причине она была чем угодно, только не наукой. Теперь наука восстала против церкви; буржуазия нуждалась в науке и приняла участие в этом восстании{4}», – писал Ф.Энгельс об этом периоде. В различных странах возникают и начинают плодотворно работать научные общества – «Академия зорких» в Риме, «Леопольдина» в Германии, Королевское общество в Лондоне.

Рис.1. Солнечная система
Подлинную революцию во взглядах на строение мира произвела гелиоцентрическая система мира, разработанная великим польским ученым Н. Коперником (1473‑1543). Отвергая учение церкви о центральном положении Земли, он объясняет видимые движения планет вращением их вокруг Солнца (рис. 1). Впервые движение планет объяснялось естественными причинами, а не божьей волей, вот почему главный труд Коперника более 200 лет находился под запретом церковников. Критиковал положение о центральном месте Земли и гениальный Леонардо да Винчи: «Земля расположена не в центре мира, а в центре своих стихий, ей близких и с ней соединенных». Аналогичные идеи развивает итальянский философ Дж. Бруно, утверждая, что Вселенная и число миров в ней бесконечны. Борьба нового мировоззрения и религии достигает апогея – идеи Бруно были признаны еретическими, и он был сожжен на костре в Риме.
XVII в. стал веком окончательного крушения средневековой схоластики. Бесплодные, бездоказательные дискуссии уступают место новому методу исследований – экспериментальному. Идеи о решающем значении опыта для научного познания высказывались давно. Еще Р.Бэкон (1214‑1292) предполагал, что опыт может быть «внешним и внутренним». По его словам, внешний опыт – это обычное исследование, внутренний же опыт заключается в восприятии истины умом, просветленным «божественной правдой» (?). Значение опыта подчеркивал Леонардо да Винчи: «…я буду цитировать гораздо более достойную вещь – опыт, наставник из наставников».
Совершенно четко о значении опыта говорил Ф. Бэкон (1561‑1626). Именно он выдвинул на первый план роль систематического, заранее обдуманного, планомерного эксперимента: «Смутный и руководящий лишь собой опыт… есть чисто движение наощупь и скорее притупляет ум людей, чем осведомляет их. Когда опыт пойдет вперед по определенному закону, последовательно и беспрерывно, то можно будет ожидать для наук чего‑нибудь лучшего». Недаром К. Маркс называл Ф. Бэкона родоначальником «всей современной экспериментирующей науки». Переход к опытному естествознанию очень скоро принес человечеству первые, но исключительно важные в научном плане успехи.
Механический взгляд на мир
Решающее значение опыта в развитии науки в полной мере впервые проявилось при изучении движения различных тел. Например, перемещение некоторых крупных планет можно наблюдать невооруженным глазом. Именно поэтому законы движения планет, поиски причин этого движения были первыми крупными научными проблемами, на которые пытались ответить ученые.
Первые попытки объяснения причин движения различных тел были предприняты еще в Древней Греции. Аристотель, например, разделил все тела на «тяжелые» и «легкие». Тяжелые тела (камень) падают вниз, стремясь достичь введенного философом некоего «центра мира», легкие (дым от костра) улетают вверх. Таким образом, падение тел у Аристотеля было естественным движением, совершавшимся без приложения извне каких‑либо сил (впрочем, тогда не было и самого понятия «сила»). Аристотель утверждал также, что легкие тела, например пушинки, должны падать медленнее тяжелых. Его авторитет был настолько велик, что вплоть до XV в. эти наивные объяснения считались единственно верными.
С объяснением движения планет, казалось, все было гораздо проще: все молчаливо предполагали, что их движением управляют боги. Даже Коперник обходил молчанием этот вопрос. Сведений о смещениях планет скопилось так много, что, обработав эти наблюдения, немецкий астроном И. Кеплер (1571‑1630) вывел законы их движения.
Обратим внимание на то, что законы движения планет были установлены раньше понимания их причин. Это не единственный пример такого рода в науке, так же обстояло дело при открытии периодического закона элементов Д.И. Менделеевым, при создании первой модели атома Н. Бором и т. д. Во всех случаях это было для ученых дополнительным стимулом в исследовании тайн природы.
Справедливо заметить, что Кеплер довольно близко подошел к пониманию причин движения, высказав предположение, что все тела взаимно притягиваются и что сила притяжения прямо пропорциональна массам тел и обратно пропорциональна квадрату расстояния между ними. Однако признать, что силы тяготения являются причиной движения планет, Кеплер не отважился. В 1674 г. англичанин Р. Гук показал, что движение планет по эллиптическим орбитам согласуется с предположением о том, что все они притягиваются Солнцем, но не смог вывести законы этого притяжения.
Решающий шаг вперед сделал итальянский ученый, основоположник экспериментальной физики Г. Галилей (1564‑1642). Он решил проверить утверждение Аристотеля о разных скоростях падения различных по массе тел и, согласно легенде, сбросил с вершины знаменитой Пизанской башни чугунное ядро и деревянный шар. Резко различающиеся по массе предметы упали на Землю одновременно. Из этого опытного факта Галилей сделал фундаментальный вывод – все тела падают на Землю с одинаковым ускорением. Он же и измерил значение этого ускорения, которое с учетом последующих уточнений оказалось равным
g0 = 9,8 м/с2.
«Непосредственный опыт всегда очевиден, и из него в кратчайшее время можно извлечь пользу».
Открытие закона тяготения английским физиком И. Ньютоном служит блестящим подтверждением этого меткого замечания. Ньютон впервые связал два факта – ускорение свободного падения тел на Земле и период обращения Луны вокруг Земли. Обратим внимание на то, что эти данные, казалось бы, имеют различную природу – вполне «земное» ускорение и движение небесного тела. Однако Ньютон видел причину движения любых тел в их взаимодействии между собой. Этим взаимодействием является их взаимное притяжение. Ньютон сделал шаг огромной обобщающей важности – силы тяготения как на Земле, так и в космосе имеют одинаковую природу.
«Еще почти никогда в истории, меньше всего в наши дни, когда столько людей занимается наукой, не бывало, чтобы та самая голова, которая впервые натолкнулась на ту или иную идею, до конца исчерпала бы ее. Почти все идеи были предугаданы, подготовлены и слегка намечены, прежде чем являлся наконец тот, кто разрозненному материалу придавал целостность».
Ньютон впервые дал математическую формулировку закона всемирного тяготения:
F = G∙Mm/r2
где F – сила взаимного притяжения, действующая между двумя телами массами M и m, удаленными друг от друга на расстояние г. Коэффициент G – гравитационная постоянная, значение которой было измерено Г.Кавендишем в 1798 г.:
G = (6,673 ± 0,003)∙10‑11 м3/(с2∙кг).
Закон всемирного тяготения был опубликован И. Ньютоном в его знаменитом труде «Математические начала натуральной философии» одновременно с открытыми им же тремя законами движения (динамики). Применение закона всемирного тяготения (1) и второго закона динамики Ньютона
F = ma, (2)
(F – сила, действующая на тело массой m, a – ускорение, приобретаемое данным телом под действием этой силы) к движению планет дает возможность точно рассчитывать их траектории. Ученые выполнили эти расчеты и убедились, что результаты точно совпадали с многолетними наблюдениями за движениями планет.
«Кто не замечает с изумлением, как рабски склоняются вечные созвездия перед законами, которые человеческий разум хотя и не дал им, но подсмотрел у них».
Впечатление, которое произвели открытия Ньютона на современников, было огромно. Они установили истинную причину движения, опровергнув астрологические измышления, будто движение планет определяется божьей волей. Механика как наука о движениях тел и их взаимодействии превратилась в огромную силу, с которой теперь уже нельзя было не считаться!
В царство сказок возвратились боги,
Покидая мир, который сам,
Возмужав, уже без их подмоги
Может плыть по небесам.
Ф. Шиллер
Теория получает полное признание только тогда, когда она не только объясняет уже известные факты, но и предсказывает новые. Подтверждение их придает истинность родившейся теории, и именно на этом пути механика Ньютона доказала свое величие. Приведем два примера. В 1682 г. английский астроном Э. Галлей вычислил по формулам Ньютона время вторичного прихода к Солнцу наблюдавшейся в то время на небе яркой кометы. Возвращение кометы произошло в строго расчетное время! Могучая сила законов механики в полной мере проявилась и в истории открытия новой планеты. Расчеты орбиты планеты Уран (см. рис. 1) по формулам Ньютона не совпадали с наблюдениями. Для объяснения этого явления петербургский астроном А. И. Лексель предположил наличие неизвестной еще в то время заурановой планеты. В 1846 г. французский астроном У. Леверье выполнил расчеты положения этой планеты и сообщил их немецкому астроному И. Г. Галле. (Аналогичные расчеты независимо выполнил и английский астроном Д. Адамс.) Телескопы, направленные в указанную точку неба, тотчас же обнаружили новую планету – Нептун. Великая сила теории позволила ученым, не выходя из кабинета, открыть новую планету.
Успехи механики были столь впечатляющими, что с помощью ее законов стали объяснять – ив первое время довольно успешно! – и другие физические явления.
«Когда какой‑нибудь народ достиг больших успехов по сравнению с живущими по соседству с ним другими народами, как правило, он стремится добиться некоторой гегемонии над ними и нередко дело доходит до того, что он их себе подчиняет и порабощает. Точно так же обстояло дело и с научными дисциплинами. Механика вскоре стала гегемоном во всей физике».
Воображение ученых рисовало фантастические картины объяснения механическими законами всех явлений. Посмотрим, однако, к чему может привести последовательное распространение механических законов на весь окружающий нас мир. Если известно положение тела в некоторый момент и приложенные к нему силы, то можно точно предсказать положение тела для любого последующего момента времени. Эти же рассуждения можно применить ко всем объектам Вселенной и вообразить существование некоего «сверхсущества», которому было бы досконально известно как все прошлое мироздания, так и его будущее. Величественная, фантастическая и в то же время безнадежно грустная картина жизни в таком заранее предвычисленном мире! Не есть ли это подтверждение предсказываемой еще Демокритом жесткой предопределенности, сводящей все происходящее в мире к повторению прошлого, исключающей возможность развития?
«Я предвижу, какой ужас нападет на мечтателя от этих высказываний, как он будет бояться низведения всего большого и возвышенного до мертвого бесчувственного механизма и уничтожения поэзии.
Но мне кажется, что вся эта боязнь зиждется на полном непонимании сказанного. Лаже самый сложный механизм, изготовленный человеческой рукой, сколь он незначителен и безжизнен по сравнению с простейшим растительным и животным организмом».
И все же вплоть до середины XIX в. успехи, одерживаемые механикой при объяснении самых различных явлений природы, были столь велики, что механическое мировоззрение полностью владело умами ученых и казалось единственно возможным. Развитие механики привело к рождению совершенно новых разделов физики. Именно механика явилась тем мощным фундаментом, на котором впоследствии выросло могучее здание современной физики. И хотя в дальнейшем развитие науки привело к замене чисто механистического понимания природы гораздо более глубоким статистическим, одним из выдающихся творцов которого был Людвиг Больцман, значение механики можно подчеркнуть еще одной его цитатой.
«Я сам когда‑то ломал копья, защищая чисто механическое воззрение на природу мира, но только в том смысле, что оно является колоссальным шагом вперед по сравнению с прежним, чисто мистическим мировоззрением».
От гипотезы к теории
К середине XVII в. механика и астрономия достигли значительных успехов, чего никак нельзя сказать об исследованиях строения вещества. Безрезультатные усилия алхимиков поневоле заставляли ученых искать новые методы исследований. Однако сделать это было не так просто.
«При исследованиях атомов мы часто находимся во многих отношениях еще более в неблагоприятных условиях, чем в астрономии».
Можно привести по крайней мере три обстоятельства, подтверждающие эти слова. Во‑первых, в реальности существования планет, звезд не было никаких сомнений, эти объекты были видны невооруженным глазом. Атомы же, по Демокриту, – мельчайшие невидимые частицы, предположение об их существовании было гипотезой. Следовательно, в их реальности можно было сомневаться до получения прямых опытных доказательств. Параллельно с гипотезой об атомах существовали и другие воззрения, например элементы Аристотеля. Исследователям еще предстояло сделать выбор между этими двумя резко различными мнениями. Во‑вторых, движение планет легко наблюдаемо, методы же исследования атомов еще только предстояло разрабатывать. В‑третьих, судьба атомистической гипотезы с момента ее зарождения оказалась столь тесно связанной с борьбой мировоззрений, что долгое время исследования атомов запрещались церковью.
И вновь первые успехи пришли при обращении к опыту, измерениям. «Если Вы можете измерять и выражать в числах то, о чем говорите, то об этом предмете Вы кое‑что знаете; если же Вы не можете сделать этого, то Ваши познания скудны и неудовлетворительны. Быть может, они представляют собой первый шаг исследования, но едва ли позволительно думать, что Ваша мысль продвинулась до степени настоящего знания», – писал позднее английский ученый лорд Кельвин.
Впервые количественные исследования взаимопревращений химических веществ выполнил голландец Ван Гельмонт (1579‑1644). Поливая росток ивы водой и взвесив его через 5 лет, он установил, что прирост массы ивы не может быть связан с изменением массы земли в горшке, и объяснил этот факт превращением воды в землю.
Ван Гельмонт первым предложил рассматривать в качестве объекта исследований газы. Само понятие «газ» он образовал от греч. «хаос» (впоследствии выяснилось, что это название точно отражает беспорядочное движение частиц в газах). Однако объяснения природы газов Ван Гельмонтом были, по понятным причинам, предельно наивны. Так, уменьшение массы дубовых углей при сгорании он объяснял превращением их в некий «…лесной дух. Этот дух, доселе неизвестный, я и назвал новым именем газ». Ученый не мог предполагать, какой удивительный объект он предлагал для исследований, какие фундаментальные следствия для всей физики будут иметь эти исследования.
Значительная роль в развитии химии принадлежит английскому ученому Р. Бойлю (1627‑1691). Он подвергал сомнению справедливость утверждения о том, что элементы Аристотеля являются истинными элементами различных тел, и впервые в истории науки дал понятие химического элемента как «простого тела, не составленного из других». Это направляло усилия ученых на поиски простых, не разложимых далее элементов. Бойль был убежденным сторонником экспериментального метода исследований и подчеркивал, что только опыт может служить критерием правильности теорий. Он первый открыл в исследованиях газов закон, связывающий давление газа p и его объем V простым соотношением:
pV = const. (3)
Позднее этот же закон независимо от Бойля установил Э. Мариотт, и теперь он носит название закона Бойля – Мариотта.
Развивая идеи Бойля, французский химик А. Лавуазье (1743‑1794) установил, что воздух – одна из основных «стихий» Аристотеля – не является простым телом, а представляет собой смесь газов. На основании опытов он утверждал, что «стремление считать все тела природы состоящими из трех или четырех элементов происходит от предрассудка, перешедшего к нам от греческих философов». Лавуазье составил первую в истории науки таблицу химических элементов. Естественно, что во многих отношениях она была небезупречной, например наряду с простыми химическими элементами Лавуазье включил в нее глинозем, радикалы кислот и даже два невесомых «флюида» – свет и теплород.
Атомная теория получила свое дальнейшее развитие в трудах английского химика Д. Дальтона (1766‑1844). Он дал четкое определение атомного веса элемента как отношения массы атома данного элемента к массе атома водорода, наиболее легкого элемента[1]. Давая оценку этому предложению, Д. И. Менделеев писал: «Благодаря гению Лавуазье и Дальтона человечество узнало в невидимом мире химических сочетаний простые законы того же порядка, каков указан Коперником и Кеплером в видимом планетном мире». Русский ученый‑энциклопедист М. В. Ломоносов поддерживал и развивал в своих трудах атомистические представления о строении материи.
Дальнейшее развитие атомистической гипотезы было небезмятежным. В 1808 г. французский ученый Ж. Л. Гей‑Люссак открыл закон объемных отношений, согласно которому объемы как участвующих в реакции газов, так и газообразных продуктов реакции находятся в простых кратных отношениях. Это противоречило теории Дальтона, в которой соединялись равные количества атомов, и… Дальтон отказывается признавать закон Гей‑Люссака. Но один‑единственный факт, не укладывающийся в какую‑либо теорию, способен опровергнуть ее.
После открытия Гей‑Люссака судьба всей атомной теории вызвала сомнения.
«Существует огромная разница между фантазиями натурфилософов, легкомысленно сбивающихся с пути опыта, и надежными выводами теоретической физики, медленно и методически продвигающейся вперед пол непрестанным контролем эксперимента. Последняя позволяет проникать глубоко в тайны природы, не теряя надежной почвы пол ногами, и в этом она достигает своих высших триумфов».
Блестящим подтверждением этих слов может служить гениальная идея итальянского ученого А. Авогадро (1776‑1856). В 1811 г. он указал на возможность создания новой теории, объединяющей две существующие теории – Дальтона и Гей‑Люссака. Авогадро вводит в науку о строении вещества понятие молекулы – соединения атомов. Удивительное предвидение! Еще под вопросом реальность атомов, а результаты исследований требуют объяснения и находят его в созданной Авогадро молекулярной теории строения вещества.
Важнейшим следствием гипотезы Авогадро является закон, имеющий громадное теоретическое значение, – при одинаковых температуре и давлении равные объемы любых газов содержат одно и то же число молекул! Этот вывод закреплял в науке представление о дискретном, зернистом, строении вещества. Используя данные опытов Дальтона и Гей‑Люссака, Авогадро возводит удивительно стройное «молекулярное здание», предсказывая новые, уникальные факты.
Из гипотезы Авогадро вытекает существование постоянного числа молекул в моле[2] любого вещества. Объем V0, который занимает моль любого газа при нормальных условиях, также является постоянным. Этот объем был измерен экспериментально:
V0 = 22,41∙10‑3 м3.
Одной из самых первоначальных задач науки стало определение числа молекул NA в 1 моле любого вещества, получившего в дальнейшем название постоянной Авогадро. Зная V0 и NA, мы можем рассчитать важнейшие характеристики атомов – их массы, размеры, среднее расстояние между атомами в газах. Выполним эти расчеты.
Предположим, что постоянная Авогадро нам известна (о способах ее определения можно узнать в школьных учебниках физики):
NA = 6,022∙1023 моль‑1.
Поскольку масса одного моля водорода равна 2,016 г и в нем содержится NA молекул, то масса одной молекулы водорода будет равна mH2 = 3,35∙10‑24 г, а масса одного атома mH = 1,675∙10‑24 г. Поразительно могущество теории – мы «взвесили» атом водорода, не прибегая к помощи весов (да и возможны ли весы, способные взвешивать столь ничтожные тела?).
Оценим размеры атомов. Объем воды, равный 1 см3, составляет 1/18 часть моля, поэтому в нем содержится 3,34∙1022 молекул. Объем, приходящийся на одну молекулу воды, равен (1/3,34)∙1022 см3, т.е. примерно 3∙10‑23 см3. Предполагая, что молекулы расположены плотно друг к другу, оценим линейные размеры молекул воды:

Размеры других атомов и простейших молекул – этого же порядка.
Расстояние между молекулами в газах можно оценить следующим образом:
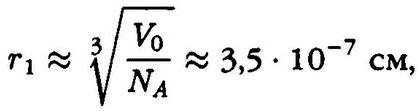
т. е. молекулы в газах находятся друг от друга на расстояниях, примерно в 10 раз больших, чем их собственные размеры.
Введение в химию атомистических представлений позволило ученым добиться несомненных успехов в познании строения вещества, но и поставило перед ними множество трудных вопросов. К открытому Бойлем и Мариоттом закону pV = const спустя почти 150 лет добавился закон Гей‑Люссака, связывающий относительное изменение объема газа и его температуру T:
V = αV0T, (4)
где α – коэффициент термического расширения газов, равный 1/273 К‑1. Вскоре французский ученый Э. Клапейрон связал воедино все три параметра газа и получил уравнение состояния идеального газа, которое носит название уравнения Клапейрона:
pV/T = const. (5)
Для одного моля газа константа в уравнении (5) равна R = 8,31 Дж/моль∙К). Это так называемая универсальная газовая постоянная.
Все эти законы были установлены экспериментально и должны были еще получить теоретическое обоснование. Пока же они порождали много вопросов, например: «Почему эти законы справедливы для всех газов, независимо от их химического состава?» Большие трудности были связаны с пониманием природы давления газов и их температуры. Все эти вопросы ставились на фоне отсутствия прямых экспериментальных доказательств реальности существования атомов. Становилось все более ясным, что искомые ответы можно было получить только при разработке каких‑либо представлений о внутреннем строении газов, построении, как говорят, модели реального газа.
Попытаемся создать такую модель. Представим газ в виде собрания большого числа (коллектива) атомов или молекул. Как эти мельчайшие частицы могут образовывать упругую силу, т. е. создавать давление газа? При ходьбе, например, мы совершенно не ощущаем сопротивления воздуха. Но, с другой стороны, накачивая шину, мы ощущаем, как постепенно растет упругое противодействие нашим попыткам сжать ее. Какова природа этой силы?
Рассмотрим пример, который поможет понять сущность газового давления. Представьте себе небольшую мельницу (рис. 2). Возьмите песчинку и бросьте ее на одну из лопастей. Поскольку масса песчинки очень мала, она отскочит от лопасти, мельница останется в покое. Увеличим число падающих на лопасти песчинок. Начиная с некоторого момента мельница начнет вращаться. Мельчайшие по сравнению с массой мельницы песчинки создали вполне реальную силу давления на ее лопасти и явились причиной ее движения.

Рис.2. Мельница
Обратимся к газам. Легко усмотреть аналогию с только что разобранным примером. Частиц газа очень много; так, в объеме 1 м3 при нормальных условиях содержится примерно 2∙1025 молекул. Чтобы создавать давление, частицы газа должны двигаться. Пока в нашем распоряжении нет никаких доказательств их движения, кроме демокритовой догадки. Но позвольте, а разве реально существующее давление газов не есть доказательство их движения? Ведь давление газа можно, по аналогии с опытом с мельницей, представить как результат соударений множества движущихся молекул газа со стенками сосуда.
«Механика объясняет не только внешние взаимоотношения тел, но и проникает в сущность материи и силы». «Давление газа, приписываемое прежде отталкивающей силе молекул, по новой теории, называемой кинетической теорией газов, объясняется уларами молекул о стенку сосуда. Это первый пример трактовки силы, вызванной невидимым глазу движением, – воззрение, которому суждено позже играть столь важную роль в механике».
Теория газов как коллектива движущихся атомов или молекул получила название молекулярно‑кинетической теории. Первым ученым, кто применил эти представления к расчетам свойств газов, был швейцарский ученый Д. Бернулли (1700‑1782). В 1738 г. он выполнил теоретический расчет давления газа и теоретически вывел закон Бойля – Мариотта. Атомистические представления в то время были еще столь мало популярны, что о замечательных идеях Бернулли и его результатах попросту забыли почти на… 100 лет. Лишь в 1845 г. очередную попытку привлечения молекулярно‑кинетических представлений к расчетам параметров газов делает англичанин Дж. Уотерстон. Рассматривая молекулу как упругий твердый шарик, он расчетным путем находит, что давление газа пропорционально его плотности и «живой силе» (так называли тогда произведение массы частицы на квадрат ее скорости). Из расчетов Уотерстона, как следствие, вытекали законы Бойля – Мариотта и Гей‑Люссака. Но судьба и этой работы поразительна, о ней отзываются как о «пустой, если не бессмысленной, основанной на чисто гипотетических принципах». Только спустя почти 50 лет она была обнаружена в архивах Королевского общества и увидела свет. Теперь уже о ней пишут совсем иное: «Фактически все основные идеи кинетической теории на первой стадии ее развития (за исключением максвелловского распределения по скоростям) содержались в этой работе».
Столь удивительная логика развития теории газов обусловлена, в первую очередь, имевшим место недоверием к атомной гипотезе. Каждому ученому приходилось как бы вновь вынашивать свои идеи и выполнять уже сделанные расчеты заново. Первой работой по теории газов, которая была воспринята всерьез, было сочинение учителя немецкой реальной школы А. Крёнига «Основания теории газов» (1856). Газ, в представлении Крёнига, – совокупность мельчайших упругих частиц, движущихся «прямолинейно с известной и постоянной скоростью». По его расчетам давление газа определялось формулой
p = nmv2/6V
где n – число молекул газа. Из этого уравнения следовали газовые законы. Но работа Крёнига была далеко не безупречной. Ошибочными были коэффициент 1/6 в формуле для давления и утверждение о прямолинейности распространения частиц газа, да еще с «известными и постоянными» скоростями. Не было ясно, как вычислять значения входящего в формулу квадрата скорости молекул v2. Формулой Крёнига, по сути, пользоваться для конкретных расчетов было невозможно. Однако стоит обратить внимание на то, что Крёниг первым высказал мысль о необходимости привлечения в молекулярно‑кинетическую теорию вероятностных представлений, ибо «траектория каждого атома настолько беспорядочна, что не поддается никакому расчету».
Уже в следующем 1857 г. другой немецкий физик Р. Клаузиус (1822‑1888) опубликовал большую работу по кинетической теории газов. Он уточнил вывод Крёнига и получил уравнение, известное теперь школьникам под названием основного уравнения молекулярно‑кинетической теории:
p = nmv2/3V. (6)
Клаузиус впервые вычислил скорости молекул газа. Например, для скорости молекул кислорода при нормальных условиях он получил v = 461 м/с, для водорода – 1844 м/с. Эти результаты вызвали большие сомнения, поскольку они противоречили известным фактам медленного распространения по комнате, например, запаха цветов и т. п. Клаузиус увидел разгадку кажущегося противоречия в столкновении частиц газа между собой и впервые ввел в физику газов важнейшее понятие средней длины свободного пробега как пути, проходимого частицей газа между двумя последовательными столкновениями. И хотя сам Клаузиус не смог рассчитать эту длину, благодаря его трудам картина движения молекул в газах существенно изменилась – траектория молекул из‑за столкновений является чрезвычайно запутанной, изломанной (рис. 3). Даже небольшой путь в определенном направлении частицы проходят за довольно большое время (это и объясняет малую скорость процессов диффузии в газах при значительных скоростях движения отдельных молекул).
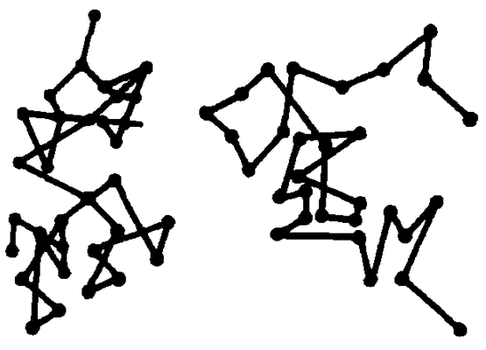
Рис. 3. Траектории молекул в газах
Клаузиус уточнил представления Крёнига о молекуле как об упругом шарике и дополнил картину тем, что, помимо чисто поступательного движения, молекулы могут обладать и внутренним движением – составляющие молекулу атомы могут колебаться относительно своих равновесных положений, молекула в целом может вращаться (рис.4). Время «фантазий» в физике еще не кончилось! Клаузиус предположил равномерное распределение энергии между различными движениями. (Теперь говорят о равномерном распределении энергии между различными степенями свободы, причем под их числом понимают число независимых между собой возможных перемещений системы. Так, для атома оно равно 3, что соответствует независимым перемещениям вдоль 3‑х координатных осей – x, y и z. Для молекул число степеней свободы увеличивается за счет появления колебательного и вращательного движений.)

Рис.4, а) Механическая модель молекулы; б) колебательное и вращательное движения молекулы
Работы Клаузиуса имели важное направляющее значение для дальнейших исследований, и очень скоро
«…из количественных экспериментов нал вязкостью Максвелл определил, что в воздухе при нормальных условиях каждая молекула газа сталкивается с другими 5 тысяч миллионов раз в секунду и что путь, пройденный молекулой между двумя последовательными столкновениями (так называемая средняя длина пробега), примерно равен десятитысячной доле миллиметра».
Используя эти данные, австрийский ученый И. Лошмидт в 1865 г. впервые вычислил размеры молекул воздуха и их число в объеме 1 м3 при нормальных условиях. Это число получило впоследствии название числа Лошмидта:
nЛ = 2,1∙1025 м‑3.
«Значение числа Лошмидта выхолит далеко за пределы теории газов. Оно позволяет глубоко заглянуть в самую природу и дает ответ на вопрос о непрерывности материи. Когда мы имеем каплю волы объемом в 1 мм3, то опыт показывает, что мы можем разделить ее на лее части, и каждая из них тоже является водой. Каждую из этих частей можно снова разделить на лее части. Число Лошмидта указывает нам пределы этой делимости. Когда мы разделим нашу каплю на триллион равных частей, то дальнейшее деление на одинаковые части становится невозможным. Мы получим индивидуальные части, о точных свойствах которых мы, правда, очень мало знаем. Мы полагаем, что их можно делить и дальше, но это деление совсем другое. Разделенные части уже не будут подобны имевшейся прежде воле».
(Эти слова написаны Больцманом в 1895 г., но уже тогда он указывал, что это деление совсем другое. Сегодня деление атомов изучается в средней школе, и прозорливостью великого физика можно глубоко восхищаться.)
Удивительные следствия вытекали из того факта, что число молекул в единице объема nЛ чрезвычайно велико. Перед наукой возникли совершенно новые проблемы принципиального характера. Поясним это. Знание начальных положений и скоростей тел позволяет на основании уравнений Ньютона рассчитывать траектории их движения. Возможно ли применить эту программу к газам? Для этого нам пришлось бы составлять и решать фантастически большое число уравнений – порядка 1025штук. Если же учесть и столкновения молекул между собой, то решать надо взаимосвязанные уравнения. Задача о расчете траекторий молекул газа приобретает невероятную математическую сложность, ее решение не под силу даже самым современным вычислительным машинам. Мы пришли к удручающему выводу: классическая механика Ньютона не может применяться к описанию свойств газов!
Очень часто и в жизни, и в науке решения трудных проблем находятся не сразу. Сначала ищется приближенное решение задачи, которое затем все более и более уточняется. Так, Бернулли, Крёниг, а затем и Клаузиус полагали, что скорости всех молекул одинаковы и равны некоторому среднему постоянному значению. По существу, это просто вынужденный упрощающий прием. Отклонения скоростей от средних значений не принимаются во внимание, ибо, по Клаузиусу, «все ошибки компенсируют друг друга. Мы можем при выводе общих формул совсем не учитывать случайных величин». Клаузиус не видит того принципиально нового, что скрывается за введением средних значений.
Однако предположение об одинаковой для всех молекул средней скорости никоим образом не отвечает действительной картине движения частиц в газах. Ведь молекулы движутся, сталкиваются между собой, обмениваются энергией, изменяют скорости движения. Введение одной средней скорости, конечно, позволяет применять к газам основные законы механики, делать возможными расчеты, описывать свойства газа в целом, несмотря на то что точные координаты и скорости каждой молекулы неизвестны. Однако это решение затушевывает принципиальное различие между классической механикой, описывающей движения отдельных частиц, и механикой совокупности громадного числа одинаковых частиц (газов).
Первым ученым, кто обратил внимание на эту существенную разницу, был английский физик Д. К. Максвелл (1831‑1879). Он указал принципиально новый путь для расчета средних величин, характеризующих состояние газа. Вместо невыполнимой задачи расчета скоростей каждой молекулы в I860 г. Максвелл предложил распределить все молекулы по группам в соответствии с их скоростью и дал метод расчета числа молекул в каждой такой группе. Столкновения частиц будут приводить к изменению числа частиц в группах, однако в силу большого числа столкновений среднее число частиц в группе будет неизменным. (Рассматривается равновесный газ, не подвергающийся воздействию извне и свойства которого не зависят от времени.)
В своем решении Максвелл использует модель газа, состоящего из большого числа твердых и совершенно упругих шаров, действующих друг на друга только во время столкновений. «Если свойства подобной системы тел соответствуют свойствам газов, то этим будет создана важная физическая аналогия, которая может привести к более правильному познанию свойств материи», – подчеркивает он. Обсудим решение Максвелла. Если N – число частиц газа, vx, vy, vz – компоненты скорости частиц по трем взаимно перпендикулярным направлениям, то число частиц, скорости которых принимают значения от vx до vx + dvx, будет равно, по Максвеллу, Nf(vx) dvx, где f(vx) – некоторая новая неизвестная функция, имеющая смысл распределения молекул по составляющим скорости. При ее расчете Максвелл делает допущение, что «существование скорости vx никак не должно влиять на существование скоростей vy и vz, так как все они находятся под прямыми углами друг к другу и не зависят друг от друга». Функция f(vx) была найдена им в следующем виде:
f(vz) = ехр(‑vx2/α2), (7)
где α – некоторая величина, зависящая от массы частиц газа и температуры, exp – обозначение основания натурального логарифма (е = 2,718…). Знание f(vz) позволило Максвеллу вычислить средние скорости частиц газа v и их средние квадратичные скорости v2:
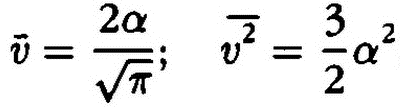
Однако величина α еще нуждалась в определении.
Предположение о независимости компонент скоростей и идею распределения молекул по группам в соответствии с их скоростью подверг резкой критике Клаузиус. Он считал, что движение молекул и их столкновения между собой будут выравнивать все скорости. Это побудило Максвелла предложить иной вывод распределения f(vx), основанный на предположении о существовании между молекулами отталкивающей силы, пропорциональной r‑n, где r – расстояние между молекулами, n – целое число. Распределение f(yx), полученное им при значении n = 5, было аналогичным предыдущему. И этот вывод Максвелла был подвергнут критике и отвергнут.
Значение идей Максвелла было исключительным. Распределение молекул на группы по их скоростям выявляло различие между механикой отдельных тел и механикой совокупности молекул, которую он предложил называть статистической механикой. Максвелл отчетливо видел перспективность этого метода, позволяющего глубже проникать в закономерности молекулярного движения.
Он видел и трудности, стоящие на пути признания этого метода, так как он «включает отказ от чисто динамических принципов и принятие математических выводов, относящихся к теории вероятностей. Возможно, что благодаря применению этих пока еще малоизвестных и непривычных для нашего сознания методов будут достигнуты значительные результаты». Одним из первых, кто понял и полностью оценил значение этих работ Максвелла, был молодой Людвиг Больцман. Восторженно и поэтично пишет он о них.
«Кто не знает динамической теории газов Максвелла? Сначала величественно развиваются вариации скоростей, затем, с одной стороны, выступают уравнения состояний, с другой – уравнения центрального движения, все выше и выше вздымается хаос формул; но вот разлаются известные четыре слова: “положим n = 5“. Злой демон v2 исчезает так же внезапно, как иногда в музыке неожиданно замолкает дикая, до сих пор все подавляющая партия басов; как бы по мановению волшебной палочки упорядочивается то, что раньше казалось неукротимым. Тогда не время объяснять, почему сделана та или иная постановка; кто этого не чувствует, пусть отложит книгу; Максвелл не сочинитель программной музыки, который поверх нот должен писать их объяснение. Стремительно раскрывают формулы результат за результатом, пока вас не ошеломит заключительный эффект – тепловое равновесие тяжелого газа, и занавес падает».
Новые методы начинали свой путь в физике. Идеи привлечения представлений теории вероятностей в физику не встретили поддержки у большинства ученых того времени. Казалось немыслимым, что допускающие известную неоднозначность вероятностные методы вообще применимы к науке о явлениях природы. На новом, несравненно более высоком научном уровне возрождается древнегреческий спор о движущих силах развития. Мировоззрение большинства физиков середины XIX в. полностью основывалось на ньютоновской механике, дающей решения строгие, вполне однозначные. Распределение Максвелла, дающее другую трактовку физических явлений, нуждалось еще в строгом теоретическом обосновании, расширении областей его применения, экспериментальной проверке. Перед теоретической физикой открывалось обширное поле деятельности по созданию физически строгой кинетической теории газов. Именно в этой области ярко проявил себя талант Людвига Больцмана.
Поход в область теплоты
С проблемами природы теплоты, ее передачи и превращения связана одна из крупных научных и философских проблем, решение которой является кульминацией научных поисков Людвига Больцмана, поэтому нам необходимо коротко познакомиться с предысторией этого вопроса.
Слово «температура» нам привычно. Вряд ли кто обращает внимание на то, что термометр является простейшим физическим измерительным прибором. Его первое практическое использование Г. Галилеем в 1592 г. сделало возможным систематические научные исследования тепловых явлений, которые сразу же поставили перед учеными вопрос о природе теплоты. Так же как и в учении о строении материи, были высказаны две противоположные точки зрения. Сторонники одной утверждали, что существует некое невесомое и неуничтожимое вещество – носитель теплоты, называемый теплородом. Чем больше теплорода содержится в теле, тем оно горячее. Гипотезе теплорода противостояла корпускулярная теория теплоты, связывающая теплоту с движением частиц, составляющих различные тела, – атомов или молекул.
Теория теплорода до середины XIX в. была общепринятой в науке. На ее основе были получены первые ценные научные результаты, объединены и объяснены с единой точки зрения различные тепловые явления. Ее сторонники считали, что теплород может переходить от одного тела к другому, подтверждение этого они видели при смешивании горячей и холодной воды. Общее количество теплорода при этом остается неизменным, существует, так сказать, закон сохранения количества теплорода. Теория теплорода настолько глубоко укоренилась в сознании ученых, что Лавуазье даже включил теплород в свою таблицу простых элементов. Особо отметим, что сторонников этой теории, в сущности, не интересовал вопрос о природе теплоты, он заранее объявлялся решенным. Есть теплотворная материя – теплород, и все.
И все же многие факты в этой теории не находили объяснения. Например, выделение теплоты при трении неубедительно связывалось с «выжиманием теплорода из пор трущихся тел». Трудно было найти объяснение явлению нагревания металла при обработке его молотом. Недаром М.В. Ломоносов задавал вопрос: «Каким образом, спрашивается, в самую холодную зиму… когда, согласно этой гипотезе, теплотворной материи почти совершенно нет, порох, зажженный малейшей внезапно зародившейся искрою, вспыхивает вдруг огромным пламенем? Откуда и в силу какой удивительной способности материя эта мгновенно стягивается в одно место?» Слабости теории теплорода побуждали ученых искать другие объяснения природы тепла. Корпускулярная теория, рассматривающая теплоту как форму движения атомов, объясняла многие экспериментальные факты, но и у нее были свои трудности. Основная из них заключалась в том, что существование атомов еще находилось под сомнением, и поэтому все выводы корпускулярной теории встречались с недоверием. Дополнительной трудностью было то, что специфику тепловых явлений можно было изучать, не строя на начальной стадии каких‑либо гипотез о строении вещества.
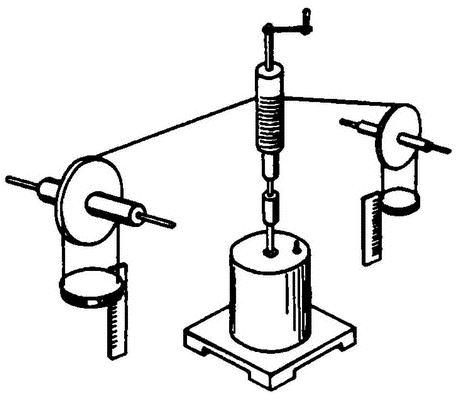
Рис. 5. Опыт Джоуля
Критерием правильности той или иной теории всегда является опыт. Так было и в исследованиях тепловых явлений. В 1798 г. эксперименты англичанина Б. Румфорда по сверлению орудийных стволов убедительно показали, что за счет трения можно получать практически неограниченные количества теплоты. Отсюда следовал логический вывод – если теплота возникает при затрате механической энергии (сверло вращали лошади), ее носитель – теплород – не может быть самостоятельным веществом, между механической энергией и теплотой существует связь. В исследованиях Ю.Р. Майера (1814‑1878) и Д.Джоуля (1818‑1899) была установлена полная эквивалентность теплоты и механической энергии. На рис. 5 показана схема классических опытов Джоуля, с помощью которых было четко показано, что падение грузов сопровождается нагреванием жидкости. Джоуль нашел и значение механического эквивалента теплоты – при затрате механической работы, равной 4,19 Дж, происходит такое же повышение температуры, как и при передаче телу количества теплоты, равного 1 кал.
Значение этих исследований было чрезвычайно велико. Они показали, что теплота не является особым видом материи, т. е. привели к окончательному поражению теории теплорода. Исследования показали, что в различных физических процессах сохраняется не количество теплорода, как особого вещества, а количество энергии. Именно исследования тепловых явлений привели ученых к открытию фундаментального, охватывающего буквально все области естествознания, закона сохранения и превращения энергии. Его сформулировал в 1847 г. немецкий ученый Г. Гельмгольц (1821‑1894). Наука получила новую и твердую почву для дальнейших исследований! В историю учения о теплоте этот закон вошел как первый закон (первое начало) термодинамики (термодинамика – наука о тепловых явлениях, в которой не учитывается внутреннее строение тел).
Крушение теории теплорода заставило ученых детализировать представления о тепловых процессах в рамках корпускулярной теории, которая связывает теплоту с механической энергией движения составляющих тело материальных частиц (атомов или молекул). В принципе она применима ко всем телам, независимо от их агрегатного состояния, – газам, жидкостям, твердым телам, но в применении к газам приложения корпускулярной теории наиболее просты. Молекулы газов в первом приближении можно рассматривать как материальные точки, так как их размеры много меньше расстояний между ними. Столкновения молекул друг с другом можно рассматривать происходящими по законам упругого удара, т. е. с сохранением полной кинетической энергии сталкивающихся молекул. При нагревании газов увеличивается энергия движения молекул. Однако для построения полной теории тепловых явлений на этой основе имелось пока очень мало данных, поскольку первые основополагающие работы по кинетической теории газов появились лишь в 1856 г. И все же именно исследования газов помогли ученым понять принципиальные особенности и закономерности тепловых явлений.
Очень важным для науки явилось введение Р. Клаузиусом понятия внутренней энергии тела U как суммарной энергии движения молекул и энергии их взаимодействия. Это позволило Клаузиусу дать простую формулировку первого начала термодинамики – энергия, подводимая к газам в форме теплоты Q, расходуется на совершение газом работы А над внешними телами и изменение внутренней энергии тела U:
Q = A + U. (8)
«Поход в область теории теплоты механика предприняла исходя из представления, что теплота есть движение мельчайших частиц тела, невидимое для глаза именно из‑за неощутимости этих мельчайших частиц, но познаваемое тем, что, когда оно сообщается молекулам нашего тела, мы испытываем чувство теплоты, а когда оно отнимается – чувство холода. Этот поход оказался победным, ибо описанная гипотеза лает очень полную картину повеления той действующей силы, которую мы называем теплотой».
Благодаря закону сохранения и превращения энергии исследования тепловых явлений стали развиваться по несколько неожиданному пути. Ученые обращают внимание на то, что между теплотой и механической энергией имеется принципиальное отличие. Например, все знают, что при торможении автомобиля нагреваются тормозные колодки, т. е. за счет трения выделяется теплота. Однако обратный процесс невозможен – сколько бы вы ни нагревали колодки, автомобиль останется на месте. Между тем закон сохранения и превращения энергии не запрещает получение механической энергии с помощью теплоты, и вам хорошо известны устройства, реализующие это, например классический паровоз или двигатель внутреннего сгорания автомобиля. Однако и тут теплота занимает особое место – превращение теплоты целиком в работу невозможно (за исключением изотермических процессов, о них см. ниже). Закон сохранения и превращения энергии оказался обманчиво прост. Раскрывая количественную сторону превращений энергии, он абсолютно ничего не говорил о принципиальных качественных отличиях между их различными формами.
Обратим внимание на то, что в наших примерах с паровозом и двигателем часть теплоты передается с выхлопом в окружающее пространство, рассеивается в воздухе. Это и является первым подтверждением вывода о невозможности полного превращения теплоты в работу. Мы постоянно наблюдаем, что при различных видах работы часть энергии выделяется в виде тепла. Обобщая наблюдения, мы можем сделать вывод о том, что в природе существует тенденция к необратимому превращению различных видов энергии в теплоту. На это впервые указал в 1852 г. английский ученый У. Томсон (1824‑1907) в работе «О проявляющейся в природе общей тенденции к рассеянию механической энергии».
Не менее важные следствия вытекают из также хорошо известного факта, что нагретые тела всегда стремятся прийти в состояние равновесия с окружающими телами, атмосферой. С течением времени остывает нагретый чайник или утюг, отдавая свое тепло. Но и в этих процессах передачи теплоты также существует односторонность, которую Р. Клаузиус сформулировал в качестве тепловой аксиомы: «теплота не может сама собой переходить от тела холодного к телу горячему». Ее значение оказалось настолько важным, что вскоре эту аксиому стали рассматривать как одну из формулировок второго закона термодинамики:
«Наряду с общим принципом (законом сохранения и превращения энергии. – О. С.) механическая теория тепла поставила второй, малоутешительным образом ограничивающий первый, так называемый второй закон механической теории тепла. Это положение формулируется следующим образом: работа может без всяких ограничений превращаться в теплоту; обратное превращение тепла в работу или совсем невозможно, или возможно лишь отчасти. Если и в этой формулировке второй принцип является неприятным дополнением к первому принципу, то благодаря своим последствиям он становится гораздо фатальнее».
Простые рассуждения убедят нас в справедливости этого неожиданного и, прямо скажем, малоприятного вывода. Тенденция к превращению различных видов энергии в теплоту, невозможность обратного полного превращения теплоты в полезную работу, установление теплового равновесия между нагретыми телами – все это приводит к представлению о том, что в некотором отдаленном будущем все виды полезной энергии превратятся в теплоту, которая равномерно распределится между всеми телами. Наступит состояние так называемой «тепловой смерти», когда, несмотря на обилие энергии, мы не сможем обратить ее в полезную работу. Поразительно, что изучение особенностей тепловых явлений привело нас к выводам, совпадающим с религиозными представлениями о «конце света». Выводы науки вновь самым теснейшим образом сомкнулись с жизнью.
Оставим до конца параграфа обсуждение философских выводов из второго закона термодинамики. Пока же обратим внимание на то, что необратимость тепловых явлений логически противоречила попыткам их объяснения на основе корпускулярной теории, поскольку законы механики полностью обратимы. Следовательно, или объяснение тепловых явлений на основе корпускулярной теории является неправильным, или не верен сам второй закон. В первом случае мы можем связать возникшее противоречие с гипотетичностью существования атомов или даже усматривать в нем доказательство несправедливости атомной гипотезы. Во втором случае можно оспаривать справедливость второго закона термодинамики, что также предпринималось некоторыми учеными. Но существует и третий путь – путь глубокого изучения сущности тепловых явлений, анализа различий между обратимыми и необратимыми процессами. Именно по этому пути пошли Р. Клаузиус и У. Томсон.
Анализ особенностей тепловых процессов, выполненный Р. Клаузиусом, был далеко не очевиден. Обратив внимание на то, что формулировка второго закона термодинамики носит качественный характер, Клаузиус задался целью найти его математическую форму. Он считал необходимым связать второй закон с некоторой характерной физической величиной, подобно тому как первый закон оказался связан с существованием энергии, явился законом ее сохранения и превращения. К чести Клаузиуса надо отметить, что поставленную перед собой задачу он выполнил, оставив следующим поколениям физиков проблемы понимания физической сущности введенного им нового научного понятия, строгого обоснования найденных им математических формулировок второго закона, логической увязки обратимости механических процессов с необратимостью тепловых.
Для того чтобы понять ход рассуждений Клаузиуса, необходимо внимательно проанализировать работу теплового двигателя. Пар двигателя паровоза, расширяясь, толкает поршень, соединенный с колесами, приводя таким образом весь состав в движение. Чтобы вновь получить полезную работу, необходимо снова сжать рабочее тело. Если бы мы стали сжимать пар при той же температуре, при которой он расширялся, то на сжатие мы затратили бы точно такую же работу, что была получена при расширении. Для того чтобы работа, затрачиваемая на сжатие пара, была меньше работы, получаемой при его расширении, необходимо производить процесс сжатия при более низкой температуре пара. Следовательно, для получения полезной механической работы принципиально необходимо вовлекать в процесс третье тело – «холодильник», отдавать в каждом цикле ему часть теплоты. В нашем случае роль такого холодильника выполняет атмосфера, куда происходит сброс отработанного пара. Но если часть энергии передается холодильнику, то 100%‑ное превращение теплоты в работу при работе тепловой машины принципиально невозможно. Максимальный коэффициент полезного действия (КПД) η идеальной тепловой машины, как впервые показал С. Карно, определяется соотношением
η = 1 ‑ T1/T2, (9)
где T1 – температура нагревателя, T1 – температура холодильника. КПД тепловой машины может быть представлен также в виде
η = 1 ‑ Q1/Q2, (10)
где Q1 – теплота, переданная от нагревателя к рабочему телу, Q2 – теплота, отданная холодильнику. Объединяя выражения (9) и (10), получим:
Q1/T1 = Q2/T2 (11)

Рис. 6. Цикл работы идеальной тепловой машины
Воспользуемся полученным результатом для графического анализа цикла работы идеальной тепловой машины (рис.6). На участке 1‑2 газ, находящийся в цилиндре машины, расширяется и производит при этом работу А. На этой стадии нагреватель отдает, а газ получает теплоту Q1, равную работе расширения газа. Сам газ при этом не нагревается и не остывает (такие процессы, происходящие при постоянной температуре, называются изотермическими). Расширение газа происходит и на стадии 2‑3, но работа при этом производится за счет уменьшения внутренней энергии газа, его охлаждения от температуры нагревателя T1до температуры холодильника Т2. Следующим этапом цикла является изотермическое сжатие газа (кривая 3‑4). На это сжатие должна быть затрачена работа, но вследствие изотермичности процесса она полностью переходит в теплоту Q2, передаваемую холодильнику. Цикл работы машины завершается сжатием газа до исходного объема V1 , затраченная при этом работа идет на нагревание газа до исходной температуры Т1 , т, е. на увеличение внутренней энергии газа.
Из (11) видно, что отношение Q/T одинаково для обеих изотерм процесса.

Рис.7. Произвольный циклический процесс
Рассмотрим теперь произвольный циклический процесс (рис.7), верхнюю и нижнюю половину которого можно рассматривать как два возможных, но различных пути перехода тела из состояния 1 в состояние 2. Рассечем наш произвольный цикл сетью адиабат (адиабатными называются процессы, при которых газ не отдает и не получает теплоту, их аналогом были стадии 2‑3 и 4‑1 цикла на рис. 6). Каждый малый отрезок цикла между адиабатами можно в первом приближении рассматривать как изотермический и применять к нему соотношение (11). Следовательно, мы можем записать:
ΔQ1/T1 = ΔQ’1/T’1; ΔQ2/T2 = ΔQ’2/ T’2и т.д.,
где ΔQ и T относятся к верхней половине процесса, а ΔQ’ и T’ – к нижней. Просуммируем эти равенства по всем отрезкам:

Очевидно, что
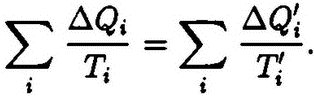
Получен интересный результат. Для произвольных, но обратимых процессов изменение величины
∑ΔQ/T
при возвращении тела в исходное состояние равно нулю:

На пути 1‑2 изменение ∑ΔQ/T равно по модулю и противоположно по знаку изменению ∑ΔQ/T пути 2‑1. Но тогда можно записать и такое равенство:
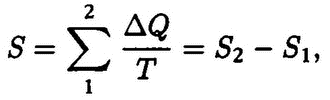
т. е. утверждать, что состояния 1, 2 или любое другое характеризуются некоторым значением величины S1, S2, подобно тому как они имеют определенные энергии E1, Е2 и т. д. Эту новую характеристику состояния Клаузиус предложил называть энтропией, от греч. «тропэ» – превращение.
Однако полностью обратимые процессы являются лишь физической идеализацией, так как в любых реально протекающих процессах всегда существуют, как мы это уже показали, необратимые потери энергии (при нагревании трущихся поверхностей, связанные с выхлопом части нагретого пара в окружающее пространство и т.д.). Естественно, что для необратимых процессов закон сохранения энтропии уже не имеет места, и изменение энтропии замкнутой системы можно рассматривать как меру необратимости совершившегося в ней процесса. В приведенных примерах окружающая среда может считаться бесконечно большой, т. е. ее температура при передаче ей теплоты не изменяется. Следовательно, в необратимых процессах изменение энтропии внешней среды ΔS > 0. Именно так выглядит в трактовке Клаузиуса второй закон термодинамики.
Удивительная судьба оказалась у новой физической величины – энтропии S, введенной Клаузиусом в 1854 г. Несмотря на то что с ее помощью Клаузиусу удалось придать математический вид второму закону термодинамики, физический смысл энтропии долгое время оставался непонятным. В отличие от других физических величин, например давления p и температуры T, энтропия не могла быть непосредственно измерена, она определялась лишь расчетным путем. Именно поэтому многие физики отказывались признавать за энтропией конкретное физическое содержание, она казалась им искусственной величиной, введенной лишь для математического анализа. С течением времени выяснилось, что это вовсе не так. После того как Людвигу Больцману удалось раскрыть ее физический смысл, вплоть до наших дней все больше раскрывается глубочайший смысл понятия энтропии.
Обобщая свои исследования тепловых процессов и применяя их ко всей Вселенной, Клаузиус сформулировал первый и второй законы термодинамики так
1) энергия Вселенной постоянна;
2) энтропия Вселенной стремится к максимуму.
Вслед за Томсоном он указал на возможность такого предельного состояния мира, когда вся полезная энергия будет превращена в теплоту, из которой мы уже не сможем получить работу. «Поход в область теплоты» привел физиков на данном этапе к печальному финалу – предсказанию «тепловой смерти». Религия тут же увидела в этом доказательство правоты своих устоев. Физические исследования сомкнулись с философией, вопрос о тепловой смерти перестал быть только физической проблемой, он стал ареной борьбы мировоззрений. Гипотеза Клаузиуса – Томсона сразу же была подхвачена представителями идеалистической философии, увидевшими в ней возможность опровержения основных идей материалистической философии, вплоть до «научного» доказательства существования бога. Были предприняты многочисленные попытки доказательства несправедливости второго закона термодинамики. Например, шотландский физик У. Ранкин утверждал, что межзвездная среда не уходит в бесконечность, а имеет сферическую границу. По сути дела, его гипотеза основана на догреческих представлениях об устройстве мира. Тепловые лучи, по Ранкину, отражаясь от границы, вновь повышают температуру в каких‑либо местах мира, приводя к возникновению новой жизни. Гипотезу Ранкина опроверг сам Клаузиус, доказав, что температура изображения излучающего источника не может быть больше температуры самого источника. Не будем анализировать другие неудачные попытки опровержения второго закона термодинамики, отметим лишь, что они еще более обострили проблему его строгого научного доказательства, превратили ее в одну из самых животрепещущих задач физики второй половины XI в.
Гипотеза «тепловой смерти» встретила энергичные возражения со стороны передовых физиков и философов‑материалистов. Ученые указывали, что Клаузиус и Томсон не обсуждали вопроса о границах применимости второго закона, а просто распространили его на всю Вселенную. Благодаря этому несомненные успехи науки были использованы в качестве опоры для религиозных предрассудков. Справедливо писал Ф. Энгельс: «…проблема не решена, а только поставлена, и это преподносится как решение»{5}. Не ограничиваясь только критикой проблемы, он указывает, что ее решение следует искать на пути более тонкого анализа существа вопроса.
Полное понимание сущности второго закона термодинамики и вместе с ним решение проблемы «тепловой смерти» пришло именно на пути глубокого проникновения в сущность понятия теплоты, на пути развития и уточнения основ молекулярно‑кинетической теории. Об этом мы расскажем читателям во второй части книги, посвященной жизни и творчеству Людвига Больцмана. Характеризуя его, советский историк физики Б.И. Спасский пишет: «В дальнейшем (вплоть до начала нашего столетия) наиболее важные результаты в развитии кинетической теории газов и кинетической теории теплоты вообще были получены австрийским физиком Людвигом Больцманом». Естественно, поэтому, что мы назвали вторую часть книги «Монолог».
Глава 2.
МОНОЛОГ
Юность
Людвиг Больцман родился 20 февраля 1844 г. в Вене в семье, которая по тем временам считалась вполне благополучной. Дед Людвига еще до переезда в Вену владел фабрикой часов в Германии, немалый доход приносила и служба отца – финансового чиновника. В семье было трое детей, и родители не жалели средств на то, чтобы дать детям разностороннее образование. Но беды рано обрушились на эту семью. Заболевает и умирает брат Людвига, гимназист Альберт, от тяжелой болезни скончалась в детстве сестра Хедвиг и, когда Людвигу было 15 лет, умер его отец. Тяжелые испытания выпали на долю совсем еще молодого человека. Все заботы его матери были сосредоточены теперь на единственном сыне, и она не жалела сил для его развития.
Мальчик оправдывал надежды матери. Все его увлечения в детстве отличались серьезностью, будь то коллекционирование бабочек или изучение жизни растений. Эти занятия развивали в нем тонкое понимание красоты окружающей природы, и через всю жизнь Л. Больцман пронес восторженное, поэтическое преклонение перед ее непостижимой гармонией. «Я плакал, глядя на цвет моря, как может один только цвет заставлять нас плакать? Или блеск луны и свечение моря среди черной, как смоль, темноты ночи», – напишет он много позже.

Л. Больцман в молодости
После переезда семьи в небольшой австрийский городок Линц Людвиг поступает в гимназию. Сказать, что он хорошо учился, было бы очень мало. В своих воспоминаниях Больцман пишет, что он был даже слишком усердным учеником. Этому не мешала развившаяся у него в детстве сильная близорукость.
«Поскольку я вследствие своей близорукости не видел даже того, что было написано и начерчено на классной доске, – писал он впоследствии, – то судьба моего образования всегда держалась на волоске, я чуть было не сказал: к моему счастью… В самом деле, хотя, быть может, сила моего воображения и выигрывала, но это происходило за счет объема приобретенных знаний».
Больцман много и охотно читает, причем его любимыми произведениями являются признанные шедевры мировой литературы. Прекрасная память позволяет ему цитировать наизусть отрывки из произведений Гомера, Шекспира, Гёте. Особенно большое влияние на формирование характера юноши оказали жизнь и творчество немецкого поэта Фридриха Шиллера (1759‑1805). В этом нет ничего удивительного, так как его произведения владели умами и сердцами молодого поколения Европы. «Свобода выращивает гигантов», – утверждает Шиллер и прославляет
Гордость пред лицом тирана
(Пусть то жизни стоит нам).
Смерть служителям обмана,
Слава праведным делам!
Эти пламенные призывы Шиллера пробуждали общественную мысль и находили отклик во всех странах Европы. «Другу человечества» было написано в патенте на право гражданства, посланном Шиллеру французским конвентом. Великий поэт‑романтик видел путь к решению проблем человечества в сотворении человеком самого себя, в эстетическом воспитании людей. Идеалы Шиллера стали основой мировоззрения Больцмана. «Я высоко ценю произведения Гёте, “Фауст” которого, возможно, величайшее из всех произведений искусства; Шекспира и других я ценю за величие духа; но Шиллера – за нечто другое. Тем, чем я стал, я обязан Шиллеру», – признается он.

Ф. Шиллер
Учебу в гимназии Людвиг сочетает с серьезными занятиями музыкой и увлечением литературой. Уроки игры на рояле в Линце ему дает на высоком профессиональном уровне австрийский композитор А. Брукнер (1824‑1896), который был, безусловно, личностью своеобразной, яркой, одаренной и целеустремленной. Он привил юному Больцману любовь к музыке и дал ему навыки игры профессионального пианиста, что впоследствии признавалось многими друзьями Больцмана. Серьезные занятия музыкой сопровождали всю его последующую жизнь. Уже в первой части книги вы могли почувствовать это, читая его неожиданное «музыкальное переложение» такой физической теории, как кинетическая теория газов Максвелла (с. 58). Музыкальные сравнения часто встречаются в его речах и статьях, придавая им живость и очарование. В серьезных физических работах приводятся точные и емкие характеристики любимых композиторов Больцмана. Например, Моцарт – «образец веселья и скромности», Бетховен – «мыслитель в звуках». Будущему ученому больше всего импонирует творчество Людвига ван Бетховена, мужественность, героизм и проникновенная возвышенная лирика сочинений которого оказали на Больцмана, как он сам подчеркивал, огромное воздействие.
Учеба в гимназии, серьезные занятия музыкой и литературой очень много значили для формирования характера Больцмана. «Художественный вкус» многих его научных работ отмечали современники ученого. Три грации – музыка, литература, наука – слились в одном человеке и образовали прекрасное и могучее единство, подтверждая строки любимого поэта Больцмана – Ф. Шиллера:
Чем больше ваши мысли, ваши чувства
Открыты для безбрежного искусства,
Для светлого потока красоты, –
Тем он яснее различает звенья
Единства мирозданья, – те черты,
Которых прежде он не знал значенья.
Венский университет
После окончания гимназии и переезда в Вену в 1863 г. девятнадцатилетний Людвиг поступает в Венский университет. В ту пору это было одно из наиболее передовых учебных заведений Европы. Интересы Больцмана сосредоточиваются на углубленном изучении физики и математики, для этого в университете имелись весьма благоприятные условия. Физику в нем преподавали известные ученые – Й. Стефан, Й. Лошмидт, К. Доплер и др. Серьезные научные исследования в различных областях физики велись в Физическом институте при университете. Учителями Больцмана были, в частности, профессор Й. Петцваль, известный своими исследованиями в области математики и физики, экспериментатор А. Эттингсхаузен, открывший явление возникновения поперечной разности температур при протекании тока по образцу, помещенному в магнитное поле (эффект Эттингсхаузена). Но, конечно, своим становлением как ученого Больцман в полной мере обязан учебе у двух замечательных физиков XIX в. – Й. Стефана и Й. Лошмидта, которые оказали большое влияние на формирование как личности вступающего в науку юноши, так и его научных интересов. На всю жизнь сохранил Больцман чувство глубокого уважения и любви к своим учителям.
Ученый, педагог и крупный организатор науки Й. Стефан (1835‑1893) заведовал в годы учебы Больцмана кафедрой физики университета. Среди исследований Стефана – труды по диффузии и теплопроводности газов, проводимости металлов, акустике, связи электрических и оптических явлений. В 1879 г. он устанавливает (экспериментально) закон излучения абсолютно черного тела (закон Стефана), доведя до полной ясности имеющиеся к тому времени противоречивые результаты исследований других ученых по данному вопросу. Й. Стефан чутко улавливал то новое, передовое, что появлялось в физике и на первых порах еще не получало должного признания. Так, он был одним из первых, кто в полной мере оценил значимость теории электромагнитных явлений Д.К. Максвелла и немало способствовал ее распространению и признанию. «Когда я, еще студентом, подружился со Стефаном, – вспоминал Больцман, – он мне первому передал сочинения Максвелла вместе с английской грамматикой, ибо я тогда совсем не знал английского языка». Влияние Й. Стефана было столь значительным, что теория Максвелла была сразу же прочно усвоена Больцманом. Его первой научной работой стала статья «О движении электричества на изогнутых поверхностях» (1865). В дальнейшем научные интересы Больцмана сосредоточиваются в основном на развитии теории газов, но и в последующие годы им выполнены интересные и глубокие работы в области электричества.
Йозеф Стефан был прекрасным педагогом. Уверенное владение как теоретическим, так и экспериментальным методом исследований давали ему глубокое понимание взаимосвязи явлений в природе, и это находило отражение в его лекциях. В одних случаях Стефан давал строгие математические выводы, в других предельно ясно излагал физическую сторону явлений, не прибегая к математике. Стиль педагогики Стефана был исключительным. «Совершенно олимпийское веселье и возвышенный юмор, превращающие для студентов самые трудные дискуссии в интересную игру, так вошли в меня, что до известной степени сделались моей собственной натурой», – писал Больцман.
Исследования австрийских ученых, выполненные в Физическом институте при Венском университете (размещенном в Эрдберге), приобретают широкую известность. «Для меня Эрдберг остался на всю жизнь символом серьезной, одухотворенной экспериментальной деятельности» – так характеризует Больцман научную обстановку в институте. Чувство нового, которое мы уже отмечали в Стефане, находит отражение и в его руководстве институтом. В 1865 г. появилась работа Й. Лошмидта «О размерах молекул воздуха», и Й. Стефан сразу же оценил ее значение для развития атомистической теории и пригласил ее автора на работу в Эрдберг. Это дает Лошмидту возможность активизировать свои исследования. В 1867 г. Лошмидт избирается членом‑корреспондентом Венской академии наук, а в 1870 г. – ее действительным членом.
Многое сближает Лошмидта и Больцмана, и во многих отношениях учитель является для ученика примером. Людвиг восхищается преданностью Лошмидта науке, учится у него глубокому проникновению в существо решаемой физической проблемы. Можно с уверенностью говорить о том, что именно Лошмидту удается заразить молодого ученого глубокой верой в атомистику. С гордостью отмечал впоследствии Больцман, что «одно из важнейших научных открытий, а именно, порядок величин, связанных с дискретностью внутреннего строения материи, сделано никем иным, как нашим Лошмидтом». Под влиянием учителя Людвиг выбирает свой путь в науке, который впоследствии принес ему всемирную известность. В этой связи уместно упомянуть о многочисленных попытках Лошмид‑та научно доказать второй закон термодинамики. Ему не удалось найти его решения, но, несомненно, под его влиянием двадцатидвухлетний Больцман выступает со своей второй научной работой – «О механическом смысле второго начала механической теории теплоты» (1866). Эта работа была его первой попыткой решения этой чрезвычайно трудной и актуальной проблемы физики. Дружба и научное сотрудничество с Лошмидтом продолжаются и после окончания Больцманом университета, причем первым ценителем и строгим судьей его научных достижений неизменно был Лошмидт, замечания которого во многом помогали Больцману в оценке сделанного, в выборе пути дальнейших исследований. «Величие души» отмечал Больцман в своем учителе.
Таковы были учителя и друзья Больцмана. Их жизнь была примером для Людвига, и спустя много лет он с глубокой благодарностью посвящает своим учителям взволнованные строки:
«Во многом они различались. Стефан был универсален и с одинаковой любовью занимался всеми разделами физики. Лошмидт был односторонним: когда он лень и ночь занимался каким‑либо вопросом, он терял почти всякий интерес ко всему остальному. Стефан был практичен, он охотно и успешно разрабатывал применения своей науки к техническим и промышленным задачам. Лошмидт, хотя когда‑то и подвизался на производстве, являл собой как бы прототип непрактичного ученого. Стефан достиг всеобщего признания. Его избирали деканом и ректором Венского университета, секретарем и позже вицe‑президентом Академии наук. Лошмидта же почти не знали. В одном они были совершенно равны: в бесконечной нетребовательности, простоте и скромности в личной жизни. Они никогда не стремились выразить свое духовное превосходство каким‑либо внешним образом».
В начале пути
В 1866 г. Людвиг Больцман закончил Венский университет, защитил диссертацию и получил докторскую степень. Свой трудовой путь он начинает ассистентом на кафедре Стефана. Через год ему присвоили звание приват‑доцента. Больцман читает студентам лекции по механической теории теплоты, математической теории упругости и капиллярности и интенсивно занимается научной работой. Одна за другой выходят его статьи: «О числе атомов в газовой молекуле и внутренней работе в газах» (1867), «Исследование равновесия живых сил движущихся материальных точек» (1868). Уже в этих юношеских работах талант Больцмана как крупного теоретика проявился настолько ярко, что в 1869 г. он получил приглашение на должность профессора математической физики в университет австрийского города Граца.
В 1869 и 1871 гг. Больцман выезжает на несколько месяцев в Гейдельберг и Берлин. В университетах этих немецких городов имелись прекрасно оборудованные физические лаборатории, в которых работали выдающиеся ученые.
В Гейдельберге Людвиг изучает исследования немецкого физика Г.Кирхгофа (1824‑1887), которые затрагивали самые различные области – электричество, механику, оптику. Одним из самых значительных научных достижений Кирхгофа было открытие им совместно с Р. Бунзеном спектрального анализа. С помощью спектрального анализа Кирхгоф открыл два новых химических элемента – цезий и рубидий. Им же был установлен один из основных законов теплового излучения – о независимости от природы тела отношения его испускательной и излучательной способностей. Больцман высоко ценил заслуги Кирхгофа как ученого:
«Его характеризует строгая формулировка гипотез, тонкость разработки, спокойное, почти эпическое развитие мысли с железной последовательностью, без замалчивания каких‑либо трудностей, с разъяснением малейших неясностей».
Больцман замечает, обращаясь к своим любимым музыкальным сравнениям, что Кирхгоф «может быть уподоблен мыслителю в звуках – Бетховену». В своем неподражаемом художественном стиле Больцман дает высочайшую оценку математическим работам Кирхгофа:
«Как раз среди этих последних работ Кирхгофа некоторые необыкновенно изящны. Изящны? – слышу я вопрос; разве не разбегутся грации отгула, где интегралы вытягивают шеи, да и может ли быть что‑нибудь изящное там, где автору не хватает времени даже на самые небольшие внешние украшения? И все‑таки простотой, необходимостью именно этого слова, каждой буквы, каждой черточки математик более всех художников подобен творцу миров; и на этом основано то величие, которое ни в одном искусстве не имеет себе равного, – разве лишь в симфонической музыке».
Весьма характерное и о многом говорящее признание! Гениальный теоретик и высокообразованный музыкант, Людвиг Больцман уравнивает в правах величие математических формул и глубинно‑космический мир музыки.
В Гейдельбергском университете Больцман продолжает изучение математики и знакомится с исследованиями профессора Л. Кенигсбергера, автора большого числа работ по теории функций, дифференциальным уравнениям в частных производных, теории потенциала. Математику Больцман знал настолько глубоко, что спустя некоторое время (1873‑1876) заведовал кафедрой математики в Венском университете.
В Берлине жил и работал уже знакомый читателям Г. Гельмгольц. Для своего времени это была уникальная личность. Он был одновременно выдающимся физиком и не менее крупным физиологом, вклад которого в развитие этих областей знания трудно переоценить. В физике ему принадлежат строгая формулировка закона сохранения и превращения энергии и идея об атомарном строении электричества. Он разработал теорию разрешающей способности оптических приборов и в то же время был широко известен как врач, успешно решивший многие вопросы физиологии слуха и зрения. Подчеркивая талант Гельмгольца, Больцман напишет впоследствии, что «о некоторых проблемах я вообще мог говорить только с одним‑единственным человеком, а именно с Гельмгольцем».
Научная работа и общение с этими выдающимися физиками, безусловно, способствовали быстрому вхождению Больцмана в круг современных физических проблем. В то же время эти поездки характеризуют его как ученого, не ограничивающегося только своими исследованиями, а стремящегося быть в курсе новейших достижений физики.
Пигмалион и Галатея
Появляющиеся одна за другой начиная с 1865 г. научные работы Больцмана были столь значительны, что без них невозможно представить развитие как физики второй половины XIX столетия, так и современной физики вообще. В течение многих десятилетий они определяли направление исследований и прокладывали пути новому, значительно более глубокому пониманию сущности физических процессов. Прежде чем начинать рассказ о научных работах Больцмана, необходимо подчеркнуть, что подавляющее большинство его исследований относится к области так называемой теоретической физики, поэтому необходимо, хотя бы коротко, сказать о сущности теоретического метода и о его значении в науке.
«Я не был бы настоящим теоретиком, – пишет Больцман, – если бы не спросил сначала: что такое теория? Профану бросается в глаза прежде всего то, что она мало понятна, что она окружена целой грудой формул, ничего не говорящих непосвященному». И в наши дни в многочисленных беседах с самыми различными людьми приходится слышать подобную реплику. Действительно, формул в математике и физике много, но это – язык науки, это способ записи ее достижений, средство общения ученых друг с другом. Отметим, что к подобному «кодированию» информации прибегают не только физики и математики. Разве нельзя адресовать, например, музыкантам вопрос аналогичного содержания: могут ли понять непосвященные символы музыки – нотные знаки, аккорды? Разве могут они по одному взгляду на партитуру отличить симфонию Чайковского от симфонии Бетховена? Всем известны возможности современных вычислительных машин, а ведь закладываемые в них программы понятны только специалистам. Формулы физики стали мощным оружием человека в познании им тайн природы. Примером этого является история открытия закона всемирного тяготения. От множества наблюдений типа: «такого‑то числа, такого‑то месяца, такого‑то года данная планета находилась в точке неба с такими‑то координатами» – до их обобщения в законы движения планет, открытые Кеплером, и далее к математической формулировке закона всемирного тяготения Ньютоном, запечатлевшим всего лишь в пяти буквах‑символах тайну движения планет, переставшую быть тайной. Разве это не доказательство полезности и могущества теории? Никакая словесная формулировка не в силах предсказать положение планеты спустя произвольное количество лет, это можно сделать с помощью формул и вычислений.
Больцман четко понимал практическое значение теоретических исследований:
«Разве не проникнуты теорией все дисциплины практики, разве они не следуют за этой путеводной звездой? Колоссальное сооружение – Бруклинский мост, необозримо простирающийся в длину, и Эйфелева башня, беспредельно возвышающаяся к небу, покоятся не только на твердом фундаменте из чугуна, но и еще на более твердом – на теории упругости… Теория, несмотря на ее интеллектуальную миссию, является максимально практической вещью».
С присущей ему глубиной анализа и четкостью мышления Больцман видит и подводные камни теоретических исследований. Вспомним легенду о древнегреческом скульпторе Пигмалионе, изваявшем прекрасную скульптуру Галатеи и влюбившемся в свое создание. Нечто подобное может произойти и с теоретиком.
«В сущности теории коренятся и ее недостатки. Как избежать того, чтобы при постоянном углублении в теорию ее образ не начал казаться собственно событием? Нечто подобное может случиться и с математиком, когда он, непрерывно занимаясь своими формулами, бывает ослеплен их внутренним совершенством, начинает считать собственно сущим их взаимоотношения друг к другу, отворачивается от внешнего мира».
В дальнейшем мы увидим, что эта опасность не обошла стороной и физиков и самым непосредственным и трагическим образом отразилась на судьбе Больцмана.
Первая попытка
Во второй научной работе – «О механическом смысле второго начала механической теории теплоты» – молодой ученый пытался получить теоретическое обоснование второго закона термодинамики, опираясь на принципы механики.
Больцман сразу же берется за решение крупнейшей научной проблемы своего времени. Следует отметить его смелость, понимание им актуальных задач физики, поскольку все предыдущие попытки решения проблемы другими учеными были безуспешны. Тема, выбранная ученым, определила проблематику большей части его исследований на протяжении всей жизни.
Само название работы говорит о многом. Больцман действует полностью в духе своего времени, так как к этому времени механика и механистическое мировоззрение достигли наибольшего развития. Однако второе основное положение, взятое им в основу исследования, еще не было общепринятым среди физиков. Поскольку анализ проблемы требовал построения механической модели нагретого тела, Больцман представил последнее в виде системы материальных частиц – атомов. Атомно‑молекулярная теория к этому времени опиралась на высказанную еще в глубокой древности и не доказанную экспериментально гипотезу о существовании атомов. Воспитанник Венской школы физиков, ученик Стефана и Лошмидта, Л. Больцман верит в существование атомов и видит доказательства их реальности во все возрастающем числе опытных фактов физики и химии, которые находят естественное объяснение на основе атомистических представлений. И все же гипотетичность одного из основных положений исследования, конечно, создала трудности с признанием полученных Больцманом результатов.
Характер теплового движения атомов ученый представил следующим образом. Атомы описывают замкнутые траектории, причем периоды их теплового движения по траекториям практически одинаковы. При медленном нагревании атомы переходят с одной орбиты на другую, близко к ней расположенную. Несмотря на то что эти предположения были весьма искусственными, в результате исследования Больцману удалось теоретическим путем получить соотношение Клаузиуса

для обратимых процессов. Однако попытки расширить исследование на необратимые процессы не увенчались успехом.
В этой же работе Больцман намечает пути усовершенствования доказательства второго закона термодинамики. Это программа более строгого рассмотрения процессов установления термодинамического равновесия в газах, включающая и анализ столкновений молекул газа между собой. Естественно, что этот путь приводит Больцмана к необходимости анализа и дальнейшей разработки впервые полученного Максвеллом распределения молекул газа по скоростям.
Для правильной оценки результатов, полученных Больцманом в этой работе, следует обратить внимание на следующее. В процессе исследования ученый значительно расширил и обобщил механические принципы, применив их к такому физическому объекту, как газ. Он постулировал, что для газов можно предположить существование некоторой функции, среднее значение которой не зависит от координат и скоростей частиц. Среднее значение этой функции вычислялось за время много большее, чем временные характеристики движения частиц, например период их обращения по траекториям. Строгое доказательство существования такой функции было получено лишь в 1884 г., поэтому следует отдать должное физической интуиции начинающего ученого. Однако, предположив существование такой функции, Больцман допустил логическую ошибку, так как в исследование, основанное на чисто механических принципах, он ввел, по существу, чуждые механике понятия. Он заменил рассмотрение мгновенных, строго определенных механическими законами состояний системы рассмотрением средних значений. Средними значениями оперирует, как известно, особая наука, называемая статистикой, и поэтому в этом пункте работа Больцмана была статистической.
Первая попытка решения проблемы была, как видно, небезупречной. Все же она раскрыла громадные потенциальные способности молодого теоретика, его способность к самоанализу, стремление, не удовлетворяясь достигнутыми результатами, намечать пути их расширения и усовершенствования.
Вариации на заданную тему
И вихря, и света быстрей мой полет.
Отважнее! В область хаоса! Вперед!
Ф. Шиллер
Неудача с распространением попытки обоснования второго закона термодинамики на необратимые процессы заставила Больцмана серьезно заняться изучением процессов установления равновесия в газах. В 1867‑1872 гг. он выполнил ряд классических исследований в этой области. Весь цикл работ примечателен тем, что в них последовательно решаются практически все проблемы, оставшиеся не решенными со времени вывода Максвеллом распределения частиц газа по скоростям, доводятся до полной ясности вопросы доказательства этого принципиально важного для науки результата и расширяется область его применения.
В 1867 г. Больцман опубликовал примечательную во многих отношениях работу «О числе атомов в газовых молекулах и внутренней работе в газах», в которой как бы вслух обдумывает усовершенствование доказательства второго начала. Он пишет, что для решения проблем теории газов принципиально необходимо учитывать столкновения частиц между собой. Молодой теоретик отмечает, что аналитическая механика еще не встречалась с задачами строгого анализа явлений такого рода, полностью отсутствует математический аппарат для описания этих процессов. Работы Максвелла по этому вопросу лаконичны, а местами и недостаточно строги. Больцман смело берется за дальнейшую разработку поставленной Максвеллом проблемы.

Рис. 8. Распределение молекул в пространстве: а) согласно распределению Максвелла; б) согласно распределению Больцмана (молекулы находятся в поле сил тяжести)
В этой же статье Больцман отмечает, что в работе «О механическом смысле второго начала механической теории теплоты» он использовал слишком расширенное предположение о том, что вся подводимая к газу энергия идет на увеличение кинетической энергии частиц. Так как в состав газов могут входить и молекулы, то часть подводимой энергии может пойти на увеличение энергии, запасенной во вращательных и колебательных степенях свободы молекул. Больцман сделал принципиально важный вывод – энергия распределяется равномерно между различными степенями свободы. Он показывал, что средняя кинетическая энергия частиц газа Е пропорциональна абсолютной температуре T: Е ~ Т. Установив это, Больцман ввел в физику представление о том, что макроскопический параметр газа – температура Т – является мерой энергии кинетического движения отдельных микрочастиц (молекул, атомов). Осязаемая и легко измеримая температура дает нам наглядное представление об энергии, с которой движутся мельчайшие невидимые частицы! В следующем, 1868 г. Больцман опубликовал статью «Исследование равновесия живых сил движущихся материальных точек». Полученный в этой работе результат, что многоатомные газы в равновесном состоянии будут также описываться распределением Максвелла, представляет собой первый больцмановский шаг к обобщению максвелловского закона. Отметим, что, несмотря на рассмотрение многоатомных (молекулярных) газов с помощью механических аналогий, Больцман отчетливо понимал справедливость привлечения вероятностных представлений к теории газов, подчеркивал заслуги Максвелла в этом вопросе и развивал эти представления в применении к многоатомным газам.
В 1871 г. после упорного труда Больцман опубликовал работу «О тепловом равновесии многоатомных молекул», в которой рассматривал газ, находящийся во внешнем потенциальном силовом поле. Примером такого поля может служить поле сил тяжести, т. е. задача, решаемая ученым, обусловлена физической реальностью. Приведем конечный результат, полученный Больцманом. Распределение молекул газа по скоростям при воздействии на газ потенциального поля имеет следующий вид:
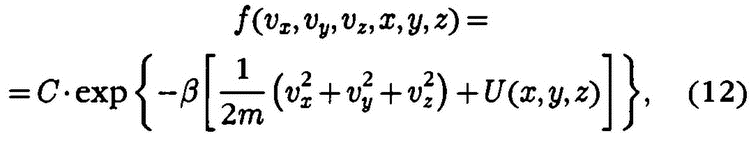
где U(x, y, z) – потенциальная энергия молекул газа в данном силовом поле, C и β – величины, зависящие от температуры газа.
Интересно сравнить полученное Больцманом распределение (12) с распределением Максвелла (7). Формулы отличаются лишь функцией U(x, y, z) в показателе экспоненты. При U(x, y, z) – 0 из распределения Больцмана получается распределение Максвелла, которое становится, таким образом, частным случаем полученного Больцманом более общего результата. Соотношение (12) получило в физике название распределения Максвелла – Больцмана.
Физические результаты, вытекающие из соотношений (7) и (12), принципиально различны. В отсутствие внешних сил разные положения молекул в пространстве равновероятны, и молекулы с одинаковой средней плотностью заполняют весь предоставленный им объем (рис. 8а). Больцман установил, что когда газ находится во внешнем поле U(x, y, z), то наряду с тепловым движением молекул следует учитывать их потенциальную энергию. Это приводит к тому, что молекулы будут распределяться в сосуде неравномерно (рис. 8б). Большая часть молекул будет сосредоточиваться в том месте, где их потенциальная энергия минимальна.
Результаты, полученные Больцманом, получили высокую оценку Максвелла: «Опубликованные мною в 1860 г. результаты подвергались затем более строгому исследованию доктора Л. Больцмана, применившего также свой метод к изучению движения сложных молекул».
Работа Больцмана допускала многочисленные физические применения. Так, если внешним полем является поле сил тяжести
U(h) = mgh,
где h – высота над поверхностью Земли, то из теории следует, что концентрация молекул будет уменьшаться с высотой по закону
nk = п0 ∙exp(‑βmgh), (13)
где n0 – концентрация молекул на уровне моря, β – зависящий от температуры коэффициент. Соотношение (13) получило в физике название барометрической формулы. О ее исключительной важности говорит хотя бы тот факт, что позднее с ее использованием были впервые получены экспериментальные доказательства реальности существования атомов (об этом будет рассказано в третьей части книги).
Другим следствием теории явился полученный Больцманом вывод о том, что в вертикальном столбе газа температура не изменяется с высотой. Этот результат вызвал возражения со стороны учителя и друга Больцмана Й. Лошмидта, который увидел в этом дополнительный аргумент в пользу «тепловой смерти» Вселенной. Рассуждения Лошмидта были довольно просты – если температура в вертикальном столбе не изменяется, то в масштабе Вселенной это и будет означать признание ее «тепловой смерти». Не признавая этой теории, Лошмидт утверждал, что температура в столбе не может быть постоянной, а второе начало термодинамики во Вселенной должно нарушаться. В результате острой, но дружеской дискуссии, направленной на глубокий анализ основ теории, Больцман доказал ошибочность утверждений своего оппонента.
Однако до полного признания распределения Максвелла, теперь уже распределения Максвелла – Больцмана, было еще далеко. Напомним, что вывод Максвелла был далеко не строгим. В таких случаях всегда возникают вопросы: «Единственно ли найденное распределение?» или «Не будет ли получен в результате более строгого вывода иной результат?» Конечно, можно было бы попытаться проверить найденное соотношение в эксперименте, но техника того времени еще не позволяла надеяться на подобную проверку.
Первую попытку доказательства единственности распределения выполнил сам Максвелл. Интересен ход его рассуждений. Если газ находится в состоянии термодинамического равновесия, то в нем установилось не меняющееся со временем – стационарное – распределение частиц по скоростям. Если v и v’ – скорости частиц до и после столкновения, то на первый взгляд возрастание числа частиц со скоростями v’ должно точно следовать за уменьшением числа частиц со скоростями v. Однако следует учитывать и то, что после столкновения частицы могут иметь и другую скорость. Процесс изменения скоростей, полагал Максвелл, будет продолжаться до тех пор, пока ряд скоростей v, v’ , v”,… снова не придет к скорости v. Обмен между частицами, имеющими различные скорости из этого ряда, приводит к тому, что число частиц, имеющих данную скорость, сохраняется постоянным, а из этого следует, что полученное распределение будет единственным.
Эти рассуждения не кажутся Больцману убедительными. В работе «Дальнейшее изучение теплового равновесия молекул газа» (1872) он приводит ряд возражений против доказательства Максвелла и дает строгий вывод распределения. Больцман видит принципиальные погрешности доказательства Максвелла в рассмотрении изменения скорости отдельной частицы, в то время как в процессе столкновений участвуют и одновременно изменяют свои скорости как минимум две молекулы. Стационарное распределение молекул по скоростям, отмечает Больцман, возникает и поддерживается именно в результате таких парных столкновений. Если же соударений нет, то однажды заданное распределение будет сохраняться сколь угодно долго, а значит, допускается возможность любого произвольного распределения. Больцман также не согласен с утверждением Максвелла о том, что ряд скоростей v, v’, v”,… , v имеет одностороннюю направленность, поскольку обратные переходы v,… , v”, v’ , v будут происходить так же часто, как и прямые.
Больцман дает строгий и изящный вывод закона распределения. Он рассматривает не переходы между скоростями одной частицы v → v’ , v → v”, а такие переходы, когда скорости двух молекул до столкновения v1 и v2 заменяется на их скорости после столкновения v1’ и v2’ . В условиях равновесия прямые переходы v1,v2 → v1’,v2’ происходят так же часто, как и обратные v1’,v2’ → v1,v2. Вывод Больцмана, занимающий всего одну страницу, можно встретить без изменений во многих современных учебниках физики.
В статьях 1872 и 1875 гг. Больцман еще более расширяет области применения полученного распределения, применяя его к многокомпонентным газам. Распределение Максвелла – Больцмана получает, таким образом, в этом цикле работ прочное теоретическое обоснование. Только сравнение с экспериментальными данными могло теперь заставить усомниться в справедливости формул. И все же строгий вывод закона распределения оставлял нерешенной проблему доказательства его единственности. Больцман решил и эту проблему, но на принципиально ином пути.
Новые идеи
Но дальше, ввысь, к пределам всех дерзаний,
Творящий гений над землей парит,
Созданье возникает из созданий,
Гармония гармонию творит.
Ф. Шиллер
Работа Больцмана «Дальнейшее изучение теплового равновесия молекул газа» по своему значению занимает исключительное место в его научном наследии. Принципиально новыми были пути творческих поисков, исключительно богаты и плодотворны идеи, впервые изложенные в ней. Работа примечательна еще и тем, что в ней отразилась эволюция взглядов самого автора, его продвижение по пути решения поставленных перед собой задач. Результаты статьи и в наши дни являются рабочим инструментом ученых, более того, они привели в последующем к возникновению новой, бурно развивающейся в наше время научной дисциплины – физической кинетики, изучающей неравновесные процессы в различных физических и химических системах. Результаты, полученные Больцманом в этой работе, давно вышли по своему значению за рамки теории газов.
Вы помните, сколько малообоснованных предположений содержала первая попытка Больцмана дать механическое обоснование второму закону термодинамики. Это понимал и сам автор, поэтому годы, прошедшие после выхода в свет работы «О механическом смысле второго начала механической теории теплоты» (1866), были для него годами все более глубокого проникновения в суть молекулярно‑кинетического механизма установления равновесия в газах. Можно сказать, что цикл работ Больцмана 1867‑1871 гг. – при всей их значимости для всестороннего обоснования и дальнейшего развития идей Максвелла! – был для него необходимым подготовительным этапом к решению сложнейшей проблемы термодинамики. Он привел ученого к глубокому пониманию существа процессов установления равновесия в газах, возникающего и поддерживающегося благодаря столкновениям молекул между собой. Математический анализ процесса столкновений оказывается принципиально необходимым для описания свойств газов, но именно этого и не было в работе 1866 г. Больцман не мог оставить нерешенной поставленную перед собой проблему. Шли годы, набирал силу талант Больцмана, все прочней становился тот фундамент, который позволил ему снова взяться за решение сложнейшей и принципиальной проблемы физики второй половины XIX в. Наконец, в 1872 г. все стали свидетелями новой блестящей попытки великого теоретика.
Больцман сознает трудности анализа процессов в газах. Вследствие огромного числа частиц, быстроты и беспорядочности их движения наблюдению доступны лишь средние значения параметров, характеризующих систему в целом. Например, давление газа есть сила, действующая на единицу поверхности стенки сосуда со стороны сталкивающихся с ней молекул. Так как число столкновений различно в разные моменты времени, наблюдаемое давление – усредненная характеристика. Не меньшие трудности возникают и при анализе процесса столкновения молекулы со стенкой. Стенки сосуда, как бы совершенно они ни были отполированы, представляют собой при большом увеличении состоящий из неровностей рельеф (рис. 9).

Рис.9. Микрорельеф стенок сосуда
Поскольку для анализа процессов в системе, состоящей из большого числа частиц, уравнения механики должны быть дополнены начальными координатами и скоростями молекул, а этих данных в силу непредсказуемости микрорельефа стенки мы принципиально не можем знать, становятся необходимыми иные – не механические! – методы исследований. Больцман устанавливает, что основные законы теории газов, в том числе и законы установления теплового равновесия, не могут опираться на одну лишь механику. «Проблемы механической теории тепла есть проблемы исчисления вероятностей», – со всей определенностью заявляет он. Необходимо привлечение в теорию статистических методов исследования, которые независимо от начальных условий позволяют находить общие закономерности, характеризующие систему в целом. Однако переход от строго динамических, описываемых уравнениями Ньютона, закономерностей к статистическим представляет собой качественный скачок, поскольку от рассчитываемых со всей определенностью однозначных характеристик мы переходим к вероятностному описанию. Этот переход позволяет выявить в совокупности молекул новые свойства, отсутствующие в каждой отдельно взятой частице. Например, уже упоминавшиеся понятия давления и температуры неприменимы к отдельной молекуле, а описывают свойства коллектива молекул как целого. Выдвигается задача установления связей между динамическими параметрами, являющимися характеристиками отдельных частиц (их скорость, энергия), и статистическими параметрами, характеризующими систему в целом (давление газа, температура).
Вспомним о существовании логических трудностей при объяснении необратимости тепловых явлений, опираясь на обратимые законы механики. И все же в 1872 г. Больцман еще верит в то, что все наблюдаемые свойства макроскопических тел, в том числе и одностороннее возрастание энтропии, могут быть получены из механического рассмотрения взаимодействия атомов. Но в отличие от работы «О механическом смысле второго начала механической теории теплоты» он вводит в свое решение принципы и методы, присущие статистическому методу.
При исследовании работы «Дальнейшее изучение теплового равновесия молекул газа» поражает еще одно обстоятельство. В период, когда понятие функции распределения, введенное Максвеллом чуть более десяти лет назад для описания свойств равновесного газа, еще было предметом обсуждения среди физиков, еще не вошло в привычный круг физических представлений, Больцман уверенно оперирует с этим новым понятием, широко обобщает и расширяет диапазон его применения. Он начинает рассматривать газы, далекие от состояния равновесия, с произвольным распределением молекул по координатам и скоростям и анализирует процесс установления в таких газах равновесного состояния. Естественно, что функция распределения неравновесного газа будет отлична от распределения Максвелла. Больцман ставит перед собой задачу найти законы изменения функции распределения при переходе газа к равновесному состоянию. Эти изменения, по мнению Больцмана, полностью обусловлены столкновениями молекул газа между собой, и он записывает это в виде короткого математического выражения:
df/dt = (Δf)ст.,
где df/dt – полное изменение функции распределения во времени, (Δf)ст. – изменение функции распределения при столкновениях частиц.
Наибольшие и принципиальные трудности возникли перед Больцманом при отыскании математического выражения для (Δf)ст. . Ученый исходит из того, что молекулы газа движутся по всем направлениям в пространстве и имеют разные скорости, и указывает, что «без такого предположения вообще нельзя доказать ни одной теоремы теории газов». Но из этого вытекает, что сталкивающиеся молекулы могут иметь какие угодно скорости и координаты, т. е. налицо статистическая независимость молекул. Только с использованием этого предположения Больцману удалось найти (Δf)ст. в виде сложного интегрального выражения. В то же время тезис о статистической независимости молекул находился в противоречии с законами механики. В полной мере это выяснилось в процессе дискуссии по поводу полученных Больцманом результатов, и мы обсудим это несколько позже.
Уравнение, полученное Больцманом для изменения функции распределения неравновесных газов во времени, получило в дальнейшем название кинетического уравнения Больцмана. Оно оказалось настолько сложным, что его решение в общем виде невозможно. Тем не менее идеи, заложенные теоретиком в вывод этого уравнения, оказались настолько плодотворны, что оно широко используется в современной физике при изучении неравновесных систем и процессов переноса в них. Так как конкретные свойства газовых молекул не фигурировали при составлении уравнения, результаты решения могли быть распространены на физические системы, свойства которых значительно отличаются от свойств газа. Так, кинетическое уравнение Больцмана применяется для описания процессов электропроводности в металлах и полупроводниках, процессов замедления нейтронов и в ряде других случаев. До сих пор не ослабевает поток публикаций, связанных с решением данного уравнения в самых различных случаях, выходят монографии, посвященные этим вопросам.
В 1972 г. в Вене, на родине физика, состоялась международная конференция, посвященная столетию создания Больцманом кинетического уравнения. Доклады более чем 20 крупных ученых мира были посвящены не столько истории создания этого замечательного уравнения, сколько современному состоянию проблем, так или иначе связанных с этим неиссякаемым источником идей и приложений.
Кинетическому уравнению, полученному Больцманом, должна удовлетворять функция распределения при произвольном состоянии газа и любых действующих на него полях. Больцман применил полученные им результаты для решения принципиальных вопросов, причем более общая постановка проблемы дала ему возможность получить в виде частных решений уже имеющиеся результаты. Проведенный им в этой работе анализ показал, что если на газ не действуют внешние силы, то в случае равновесия функция распределения частиц по скоростям будет неизменной во времени тогда, когда она совпадает с распределением Максвелла. Тем самым Больцман получил доказательство стационарности максвелловского распределения и указал, что его вывод «есть не что иное, как доказательство распределения Максвелла, выраженное нашим современным языком». В более сложном случае, когда газ находится в поле внешних сил, Больцман получил в виде решения кинетического уравнения распределение Максвелла – Больцмана (12).
Ученый исследует и более общий случай, когда функция распределения меняется во времени, и ставит перед собой задачу показать, что в газе, предоставленном самому себе, с течением времени произвольная функция распределения будет все больше и больше приближаться к функции, описывающей состояние термодинамического равновесия, т. е. к максвелловской. Способ, который он выбирает для доказательства этого предположения, ошеломляет как своей оригинальностью, так и плодотворностью полученных результатов.
Больцман вводит в рассмотрение новую функцию Е ~ f∙lnf и строго доказывает, что производная от этой функции по времени dE/dt ≤ 0, или, что то же самое, Е со временем может только уменьшаться или, достигнув предельного значения, оставаться постоянной. Этот последний случай соответствует установлению в газе равновесного распределения. Функция Е определяет, таким образом, меру отклонения газа от равновесного состояния. Тем самым Больцман доказал единственность распределения Максвелла и решил последнюю задачу, связанную с его теоретическим доказательством.
Однако и этот фундаментальный результат не исчерпывает всей широты анализа, выполненного Больцманом в работе «Дальнейшее изучение теплового равновесия молекул газа». Доказанное им свойство функции Е изменяться лишь в одном направлении наводило на мысль о существовании глубокой связи между ее односторонним изменением и односторонним возрастанием введенной Клаузиусом энтропии S. Для доказательства этого предположения Больцман выполнил прямые подсчеты значения Е для равновесного газа и показал, что с точностью до обратного знака функция Е численно равна энтропии S. Ученый получил право истолковать функцию Е (с обратным знаком) как аналог энтропии. Это был совершенно новый результат.
«Величина Е имеет прямое отношение ко второму началу термодинамики, – уверенно пишет Больцман. – Для атомных движений очень большого числа материальных точек всегда существует некая величина, которая вследствие движений атомов не может увеличиваться. Это есть аналитическое доказательство второго закона термодинамики, построенное на совсем ином пути, чем это до сих пор было».
Удивительна эволюция взглядов Больцмана на существо термодинамических проблем. От его первой попытки до рассматриваемой работы прошло всего 6 лет. Однако в 1866 г. Больцман – сторонник механических взглядов, полагающий, что решение проблемы доказательства второго начала термодинамики возможно путем сведения ее к определенному механическому принципу. В 1872 г. глубокое проникновение в суть молекулярной теории приводит его к пониманию того, что анализ необратимых процессов и обоснование второго закона следует искать на пути привлечения вероятностных, статистических представлений. Именно они определяют своеобразие тепловых явлений и их необратимость.
Подчеркнем и то, что в работе «Дальнейшее изучение теплового равновесия молекул газа» Больцман выходит за пределы классической термодинамики, которая описывает совокупность тепловых явлений с помощью небольшого числа фундаментальных принципов, не предлагая какой‑либо модели молекулярного движения. Отсюда собственно и произошло ее распространенное название – «феноменологическая термодинамика» (от слова «феномен» – явление). Классическая термодинамика определяет энтропию только для равновесных систем. Больцман, положив в основу своего исследования «более глубоко проникающую в сущность явлений» атомистическую гипотезу, указал путь вычисления Е для произвольных состояний газа. Атомистика вновь продемонстрировала свои преимущества при изучении механизма физических явлений перед описательной физикой. Значение этой работы Больцмана так оценил голландский физик X. Лоренц: «Будучи вынужденным ограничиться изложением только основных идей, я создал у вас впечатление, что результаты Больцмана очень просты. В действительности, они просты именно теперь, когда мы ими уже владеем, но при этом не следует забывать о том, сколько остроумия надо было приложить для того, чтобы открыть эти законы, и с каким огромным терпением Больцман годами добивался своей цели и боролся с трудностями, встреченными им на своем пути».
Жизнь в Граце
Прервем на некоторое время рассказ о научных работах Больцмана, для того чтобы познакомиться с его личной жизнью в эти годы. Это был исключительно плодотворный период в жизни молодого ученого. В 1869 г. он был приглашен в университет небольшого австрийского города Граца на должность профессора математической физики и прожил в этом городе почти 20 лет. Лишь небольшое время (1873‑1876) он заведовал кафедрой своего учителя математики профессора Мота в Венском университете. После возвращения в Грац он уже заведовал кафедрой экспериментальной физики и одновременно являлся директором Физического института в Граце. Годы жизни Больцмана в этом городе были годами расцвета его творческой деятельности, именно здесь он выполнил свои наиболее важные исследования.
С большой теплотой отзываются люди, знавшие Больцмана, о его человеческих и душевных качествах. Он отличался кипучей общительностью и находчивостью, в любом обществе быстро становился центральной фигурой. Он знакомится со студенткой математического факультета университета Генриеттой фон Айтленгер и к моменту своего второго приезда в Грац, в 1876 г., женится на ней. Семейная жизнь складывается счастливо. Одна за другой появляются на свет три дочери, с которыми отец много и охотно занимается, несмотря на свою загруженность.
Жизнь Больцмана в Граце полна внутренней гармонии. Интенсивные научные исследования сочетаются с занятиями музыкой, отдыхом в кругу семьи, занятиями спортом. Один из его друзей в Граце вспоминал, что Больцман относился к типу ученых, которые живут в мире своей науки и новаторских исследований, но между делом с увлечением занимаются также и музыкой.
Больцман в университете читает разные курсы. Он преподает студентам механическую теорию теплоты, над развитием которой много и плодотворно работает, читает математические курсы: дифференциальное и интегральное исчисление, избранные главы высшего анализа, учение о функциях. Глубокое проникновение в сущность физических явлений и свободное владение математикой явились теми слагаемыми, на которых основываются научные достижения Больцмана. В знак признания его научных заслуг в 1875 г. его избирают членом‑корреспондентом Венской академии наук.
Помимо преподавательской работы, Больцман много сил и времени отдает работе в Физическом институте города Граца. Для своего времени это был хорошо оборудованный институт, но его заботит другое. На всю жизнь запомнил Больцман обстановку серьезной, одухотворенной научной деятельности в руководимом Стефаном Физическом институте в Вене.
«Мне пришлось долго поработать, пока в нем (Физическом институте в Граце. – О. С.) воцарился дух Эрлберга. Когда ко мне приходили молодые докторанты, желающие работать, но не знающие нал чем, я думал: в Эрлберге люди были другими. Теперь везде самые лучшие приборы, а люди думают: с чего начать? Нам идей хватало. Мы думали лишь о том, где достать необходимые приборы. Но из того, что в Эрлберге удавалось малыми средствами достичь многого, я прошу только не делать вывода, что следует предоставлять усердным исследователям заведомо недостаточные средства».
Растущая известность Больцмана, авторитет возглавляемого им института приводят к тому, что в Грац приезжают многие видные ученые. Учились и работали в Граце такие впоследствии знаменитые ученые, как В. Нернст и С. Аррениус. Работавший в Граце с Больцманом Ф. Стрейнц вспоминал: «Общение между мастером и его учениками по исследовательским работам было исключительно живым и сердечным. Во всех работах Больцман принимал самое живое участие. Он находил выход из любого затруднительного положения; при этом он никогда не выражал неудовольствия, если его отрывали от собственной работы на дому и обращались с просьбой помочь выбраться из какого‑нибудь тупика, в котором кто‑то вдруг очутился. Не считаясь со временем, этот скромный большой человек отдавал себя в распоряжение любого слушателя, причем всегда с неиссякаемым терпением и мягким юмором».
Экспериментальные исследования
В 1872‑1874 гг. Л. Больцман выполнил ряд серьезных экспериментальных работ в области электричества. Несмотря на то что эти работы не являются основными для творчества великого теоретика, они тем не менее образуют единое целое с другими его исследованиями, характеризуют многогранность его таланта.
Отношение Больцмана к экспериментальной физике было однозначным. Он часто завидовал надежности и достоверности ее результатов, ее уверенному поступательному развитию. Ученый был убежден в том, что для получения полного удовлетворения от какой‑либо серьезной работы необходимо иметь непосредственное подтверждение ее результатов. Он писал:
«Если бы меня спросили – кто самый счастливый смертный, то я без колебаний назвал бы Колумба. И не потому, что другие открытия не идут в сравнение со сделанным им. Нет, потому что счастье должно обуславливаться чувственным воздействием, а именно это и имело место у Колумба в наивысшей степени».
Даже такое фундаментальное исследование Больцмана, как уже разобранная нами работа «Дальнейшее изучение теплового равновесия молекул газа», при всей исключительной важности полученных в ней результатов не могла принести ее автору полного удовлетворения до тех пор, пока идеи работы не найдут экспериментального подтверждения. К сожалению, время опытных проверок полученных выводов было еще очень далеко.
То, что эксперименты Больцмана касались области электричества, нельзя назвать случайным. Еще в студенческие годы он под влиянием Й. Стефана изучал появившуюся тогда теорию электромагнитных процессов Максвелла и был ее горячим сторонником, несмотря на то что теория шотландского физика не сразу была принята в Европе. Математическая сложность теории и новизна идей Максвелла затрудняли ее признание. Между тем из нее вытекали многочисленные следствия, которые можно было проверить экспериментально, получив тем самым доказательства ее справедливости или ошибочности. Больцман был первым, кто решился на выполнение подобных экспериментов.
Одним из результатов, полученных Максвеллом теоретически, была зависимость между диэлектрической постоянной среды ε и ее показателем преломления n:
ε = п2.
Больцман впервые выполнил измерения диэлектрической постоянной твердых тел и газов и сравнил их с оптическими данными для показателя преломления. Для этой цели он использовал различные экспериментальные методы. В одной серии экспериментов он измерил емкость плоского конденсатора с диэлектриком между пластинами и без него. Затем пластины конденсатора сдвигались, и измерения повторялись. Простые расчетные соотношения позволили вычислить ε.
Гораздо более оригинальным был второй метод Больцмана. К заряженному телу подносился шарик из испытуемого диэлектрика и с помощью крутильных весов определялась действующая на шарик сила притяжения. Затем шарик обертывался станиолем, и снова измерялась сила притяжения. Для устранения влияния поляризации Больцман дополнил методику измерениями при быстрой смене знака заряда притягивающего шара.
Значения ε, полученные при измерениях по различным методикам, совпадали друг с другом, что доказывало корректность эксперимента. Больцман сравнивал полученные данные с теми значениями ε, которые следовали из полученных независимыми оптическими методами значений показателя преломления n тех же веществ. Совпадение значений однозначно подтверждало правоту теории Максвелла и принесло большое удовлетворение Больцману.
Среди этих измерений следует особо выделить измерения диэлектрической постоянной серы. Кристаллы серы обладают анизотропией, т. е. имеют разные показатели преломления света по трем разным направлениям в пространстве. В соответствии с этим и е серы должна быть разной для различных направлений. Больцман провел эти эксперименты и выявил зависимость диэлектрической постоянной серы от направления, получая тем самым еще одно подтверждение справедливости максвелловской теории.
Л. Больцман впервые выполнил требующие большого экспериментального искусства измерения диэлектрической постоянной некоторых газов. Для этого под колокол воздушного насоса помещались две тщательно изолированные металлические пластины. Одна из пластин соединялась с источником напряжения. При смене газа потенциал пластин изменялся, что давало возможность рассчитать ε. Вновь экспериментальные результаты подтверждают предсказания теории. Так, для воздуха √(εэксп.) = 1,000295 при n = 1,000294, для водорода эти же данные были соответственно равны 1,000132 и 1,00038.
Другие экспериментальные исследования Больцмана мы лишь кратко перечислим. Это работы по влиянию магнитного поля на электрический разряд в газах, по термоэлектричеству и диамагнетизму. Особо выделяется работа Больцмана по изучению открытого американским физиком Э. Холлом эффекта возникновения поперечной разности потенциалов при помещении образца с током в магнитное поле. Больцман впервые показал, что по величине разности потенциалов можно судить о скорости движения носителей электричества. Экспериментальные работы Больцмана высоко оценивались современниками. Австрийский физик Э. Мах назвал Больцмана «экспериментатором, вряд ли имеющим себе равного».
И все же Больцман предельно скромен в оценке своих экспериментальных работ. В предисловии к своим двухтомным «Лекциям о максвелловской теории электричества и света» он так определил свою задачу:
«Таким вот чернорабочим, которому была поставлена задача расчистить дорогу к зданию, почистить фасад, может быть, даже добавить к фундаменту несколько камней, я бы хотел быть, и я горжусь этим; ведь если бы не было чернорабочих, как могли бы короли строить?»
О пользе парадоксов
Работы Больцмана по молекулярно‑кинетической теории газов и, в частности, трактовка энтропии с помощью введенной им E‑функции (в дальнейшем за ней укрепилось название H‑функция, а само доказательство стало называться H‑теоремой Больцмана), сначала не привлекли к себе внимания, в основном из‑за того, что эти работы опирались на гипотезу о существовании атомов. Исследования, посвященные развитию атомно‑молекулярной теории, встречались с недоверием или просто замалчивались, несмотря на то что атомистике уже к этому времени удалось найти убедительное объяснение целому ряду экспериментальных фактов.
Одним из самых строгих судей сделанного Больцманом был, как уже говорилось, Й. Лошмидт. Его острые критические замечания не имели своей целью подрыв атомистики и молекулярно‑кинетической теории. Они были направлены на скрупулезное выяснение характера основных положений теории и тем самым существенно помогали ее дальнейшему развитию. К тому же в лице Больцмана Лошмидт имел оппонента, способного чутко прислушиваться к критическим замечаниям, глубоко анализировать их, работать над устранением слабых мест исследования. Ярким примером плодотворного сотрудничества двух физиков явилась полемика (1876‑1877), когда Лошмидт выступил с возражениями против развитой Больцманом в 1872 г. теории об одностороннем изменении H‑функции. Это возражение получило в физике название парадокса Лошмидта.
Суть замечаний Лошмидта понять не трудно. Предположим, что имеется система, далекая от состояния термодинамического равновесия. С течением времени столкновения частиц между собой приведут к тому, что в системе установится равновесное максвелловское распределение по скоростям. В течение этого промежутка времени, по Больцману, H‑функция будет монотонно убывать. Если после достижения равновесия изменить направления скоростей всех частиц в системе на прямо противоположные, то эволюция системы будет происходить в обратную сторону, т. е. в сторону удаления от состояния термодинамического равновесия. Ранее сталкивающиеся молекулы будут разлетаться, но их движение будет все равно описываться все теми же уравнениями механики. Из развитой Больцманом теории следовало, что удаление системы от состояния термодинамического равновесия должно сопровождаться возрастанием H‑функции. Мысленный парадокс Лошмидта приводил к тому, что для H‑функции имеется столько же возможностей возрастать, как и убывать. Это противоречило результатам, полученным Больцманом.
Лошмидт обращает внимание Больцмана на существование внутреннего логического противоречия в доказательстве одностороннего изменения H‑функции. Механические уравнения описывают обратимые процессы, в то же время результаты, полученные Больцманом, дают объяснение термодинамической необратимости. Вопрос, поднятый Лошмидтом, стоял очень остро и требовал решения.
Можно наметить разные пути решения парадокса. Например, подвергнуть сомнению его справедливость, ибо изменение направлений скоростей частиц системы на противоположные требует, строго говоря, одновременного обращения вспять процессов во всей Вселенной. Конечно, можно представить себе обращение движения одной частицы, но обратная эволюция мировых процессов практически не осуществима. К тому же для одной частицы понятие энтропии вообще теряет смысл. И все же такие попытки устранения из рассмотрения парадокса Лошмидта нельзя считать правомерными, так как выводы кинетической теории газов получаются в предположении, что газ изолирован от окружающего мира.
Можно было обратить внимание также на то, что в основу доказательства H‑теоремы Больцман положил предположение о «молекулярном беспорядке», о статистической независимости сталкивающихся молекул. При изменении направления скоростей частиц ранее статистически независимые сталкивающиеся молекулы при разлете уже не будут независимыми. Это внутреннее противоречие требовало изменения доказательства.
Посмотрим, как решает возникшее затруднение сам Больцман. В феврале 1877 г. он публикует статью «Замечания об одной проблеме механической теории тепла». В ней он соглашается с Лошмидтом в том, что при изменении направлений скоростей на противоположные эволюция системы будет происходить в обратном порядке и значение H должно возрастать. Больцман видит выход из противоречия в том, что H‑теорема вовсе не утверждает того, что при любых изменениях в системе значение H должно убывать, ее уменьшение является наиболее вероятным. Он настойчиво проводит мысль о том, что вероятностная трактовка изменений, происходящих в системе, принципиально необходима, что «второе начало является законом вероятностным и поэтому его вывод посредством уравнений механики невозможен». Этот результат имел исключительное значение.
Второй закон термодинамики, утверждающий, что обратное превращение теплоты целиком в работу невозможно, не является абсолютным. В силу своего вероятностного характера он может нарушаться. Всесильная до сих пор механика не может объяснить все происходящие в системах изменения, для их описания необходимо применять вероятностные, статистические, допускающие исключения, законы. В это трудно было поверить, так как все экспериментальные факты, имеющиеся к этому времени, говорили обратное. Это была поистине революция в физическом мировоззрении, происходящая пока только у одного Л. Больцмана.
Вновь поражает эволюция взглядов Больцмана. От своей первой, целиком механической попытки объяснить второй закон термодинамики – к работе «Дальнейшее изучение теплового равновесия молекул газа», где объяснение дается уже с привлечением гипотезы о статистической независимости, являющейся, по существу, вероятностной, к намечаемому Больцманом новому пути доказательства, который должен быть полностью основан на теоретико‑вероятностных представлениях. Ученый демонстрирует свое исключительно глубокое понимание существа решаемой им проблемы, диалектичность своего метода исследования. Новый подход Больцмана заключался в расчете вероятности различных состояний системы материальных точек, образующих идеальный газ, и доказательстве того, что наиболее вероятным состоянием этой системы является состояние термодинамического равновесия. Но это доказательство еще нужно было найти.
Вершина творчества
Всего восемь месяцев понадобилось Больцману, чтобы полностью решить поставленную задачу. Интенсивность его творческого процесса впечатляет. В октябре 1877 г. он публикует работу «Об отношении второго начала механической теории теплоты и исчисления вероятностей в соответствии с теоремами о тепловом равновесии». Вывод Больцманом второго закона с помощью вероятностных представлений, изложенный в этой работе, прост и убедителен.
Генеральная идея больцмановского решения – определение наиболее вероятного с термодинамической точки зрения состояния системы материальных точек. В качестве подобной системы может быть выбран коллектив молекул, образующих газ. С точки зрения механики состояние такой системы полностью определено заданием координат x, y и z и составляющих скорости vx, vy, и vz. Для описания системы необходимо знать 6N переменных, где N – число частиц в системе. Отметим, что перестановки частиц между собой не меняют механического состояния системы. Число таких перестановок нетрудно подсчитать. Так, если система состоит из двух частиц а и b, то число возможных перестановок равно, очевидно, двум: ab и ba. В случае трех частиц число возможных перестановок равно 6: abc, acb, bac, bca, cab, cba, четырех частиц – 24 и т.д. Коротко число возможных перестановок можно записать с помощью математического символа N! (N факториал), который расшифровывается как произведение всех натуральных чисел от 1 до N, т. е. N! = 1∙2∙3∙…∙N.
Больцман вводит в рассмотрение принципиально новую для физики величину – термодинамическую вероятность состояния системы. При ее подсчете он обращает внимание на то, что перестановки частиц, имеющих одинаковую энергию, не меняют термодинамического состояния системы. Для подсчета числа таких перестановок Больцман распределяет все частицы по группам. В первой группе находятся n1 частиц, обладающих энергиями от 0 до ε , где ε – некоторая малая порция энергии. Во второй группе находятся п2 частиц с энергиями от ε до 2ε и т.д. Такое разбиение частиц по дискретным энергетическим интервалам противоречило полученному Максвеллом и самим Больцманом непрерывному распределению частиц по энергиям, но это его не смущало. Вводя малую порцию энергии ε, он не придавал ей какого‑либо физического смысла. Он рассматривал ее лишь как формальный математический прием, по его словам, «полезную функцию». К тому же в ходе дальнейшего исследования он устремлял ε к нулю, приходя, таким образом, к непрерывному распределению частиц по энергиям.
Разбиение частиц на определенные энергетические интервалы позволило Больцману подсчитать число перестановок частиц внутри каждого интервала. Очевидно, что внутри первого интервала их будет n1 !, второго – n2 ! и т. д. Так как такие перестановки не меняют термодинамического состояния системы, то для определения термодинамической вероятности состояния Больцман предлагает исключить их из полного числа перестановок N!. Таким образом, Больцман определяет термодинамическую вероятность состояния системы W как
W = N!/(n1!∙n2 ! ...).
Максимум значения W соответствует, очевидно, наиболее вероятному состоянию системы. При расчете этого максимума необходимо учитывать следующие очевидные условия:
n1 + n2 + … = ∑ini = N = const (*)
(сумма частиц, входящих в энергетические интервалы, равна полному числу частиц в системе) и
ε1n1 + ε2n2 + … = ∑iεini = E = const (**)
где Е – полная энергия системы, εi – энергия частицы, находящейся в i‑м энергетическом интервале.
Так как n1!, n2! велики, Больцман заменяет значения факториалов на их приближенные значения, пользуясь формулой Стирлинга:
где e – основание натуральных логарифмов (е = 2,718…). При этом термодинамическая вероятность состояния системы равна
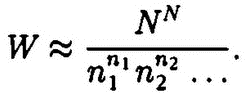
Максимум W Больцман ищет для ее логарифма:

Так как N∙lnN – величина постоянная для данной системы, то задача сводится к отысканию максимума выражения

Если учесть, что
ni ~ f(εi)
где f – функция распределения частиц по энергиям, то последнее выражение можно переписать в виде
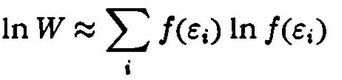
или (при ε → 0) в интегральной форме

Находя максимум этого выражения в сочетании с условиями (*) и (**), Больцман показал, что наиболее вероятному состоянию газа соответствует равновесная функция распределения (12). Выражение для lnW с точностью до постоянной равно ранее введенной величине H, взятой с обратным знаком. Поскольку H, как мы уже знаем, пропорциональна энтропии идеального газа, Больцман пришел к выводу, имеющему громадное физическое значение: энтропия системы S пропорциональна логарифму термодинамической вероятности данной системы:
S ~ ln W. (14)
Полученные Больцманом результаты имеют фундаментальное значение. Приближение газа к состоянию с максимальной энтропией есть не что иное, как переход газа из состояния с малой вероятностью в наиболее вероятное состояние. Энтропия имеет вероятностную, статистическую природу. Предельно четко и уверенно пишет об этом сам Больцман: «второе начало оказывается, таким образом, вероятностным законом».
Он предлагает новую редакцию второго закона термодинамики:
«…в большей части явлений природы, обнимающих огромное число материальных точек, всякое изменение системы, которое может произойти само собой (без компенсации), есть переход от менее вероятного состояния к более вероятному состоянию».
Так лестница поэзии ведет
Все вверх его, дорогой звуков ясных,
Дорогой форм, все более прекрасных,
К вершинам новым, по цветам, вперед.
И, наконец, последних поколений
Еще одно усилье, мощный взлет,
Последний взмах широких крыл – и вот
Пред Истиною пал он на колени.
Ф.Шиллер
Дата добавления: 2021-01-21; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
