Задачи для самостоятельного решения
Государственное бюджетное образовательное учреждение высшего
Профессионального образования
«Саратовский государственный медицинский университет
Имени В.И. Разумовского» Министерства здравоохранения и социального развития Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздравсоцразвития России)
«УТВЕРЖДАЮ»
Зав. кафедрой общей и биоорганической
химии профессор _____________ П.В. Решетов
«______» _____________________20 ____ г.
Методическая разработка
практического (семинарского, лабораторного) занятия для преподавателей
Специальность, курс: 060103 Педиатрия;; курс I
Дисциплина: химия
Тема: Поверхностные явления. Адсорбция.
Студент должен Знать:
· сущность поверхностного натяжения, почему оно возникает;
· условия самопроизвольного протекания процессов в поверхностном слое;
· понятия «поверхностно-активные» и «поверхностно-инактивные» вещества, «поверхностная активность»;
|
|
|
· сущность процесса адсорбции;
· особенности физической и химической адсорбции;
· понятия «избыточная», «абсолютная» и «удельная» адсорбция
Студент должен уметь:
· строить изотерму поверхностного натяжения и определять графически поверхностную активность;
· рассчитывать поверхностную активность по уравнению Гиббса;
· строить изотерму гиббсовой адсорбции и определять предельную адсорбцию ПАВ;
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
(по теме «Поверхностная энергия. Адсорбция»)
1. Какова причина возникновения избыточной поверхностной энергии?
2. Что называется поверхностным натяжением? От чего зависит величина поверхностного натяжения?
3. В чём заключаются причины самопроизвольных поверхностных явлений?
4. Какие поверхностные явления связаны с уменьшением величины межфазной поверхности?
5. Что называется адсорбцией? Чем она обусловлена?
6. Чем можно объяснить, что деревянную палочку диаметром 1 см сломать легко, а стальной стержень такого же диаметра – практически невозможно?
7. Какие вещества называются поверхностно-активными, поверхностно-инактивными?
8. В чём состоят особенности строения молекул ПАВ и ПИВ и их адсорбции?
|
|
|
9. Как зависит поверхностное натяжение от концентрации ПАВ в растворе?
10. Уравнение Гиббса, его анализ. Ориентация молекул в поверхностном слое; структура липидного биослоя.
11. Чем отличается физическая адсорбция от хемосорбции?
12. Что называется поверхностной активностью? Как её можно определить графически и аналитически?
13. В чём заключается правило Дюкло-Траубе?
14. Как графически можно определить предельную адсорбцию?
15. В чём состоят особенности газов и паров на твёрдых поверхностях?
16. Какие участки есть на изотерме Ленгмюра? Какие математические уравнения характеризуют каждый участок?
17. Перечислите основные положения теории Ленгмюра.
18. Как с помощью теории Ленгмюра можно объяснить ступенчатую адсорбцию?
19. От каких факторов зависит адсорбция на пористых адсорбентах?
20. Какие свойства газов влияют на их адсорбцию.
21. Что является причиной адсорбции растворённых веществ на поверхности твёрдых тел?
22. Какая адсорбция является молекулярной, от каких факторов она зависит?
23. Как зависит молекулярная адсорбция от природы растворённого вещества, растворителя и адсорбента?
24. Перечислите особенности ионной адсорбции. Как она зависит от размеров и зарядов ионов?
|
|
|
25. Сформулируйте правило Панета –Фаянса.
26. В чём сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует?
27. Какие поверхности называются гидрофильными, гидрофобными?
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ЗАДАНИЕ № 1
Определение зависимости поверхностного натяжения растворов от длины углеводородной цепи ПАВ сталагмометрическим методом
Цель работы. Изучить влияние длины углеводородной цепи и концентрации ПАВ на величину поверхностного натяжения растворов.
Сущность работы сводится к подсчёту числа капель исследуемых растворов ПАВ и воды, вытекающих из одного и того же объёма сталагмометра. Жидкость засасывается выше верхней метки, и когда её уровень опустится до верхней метки, начинают считать число капель, вытекающей жидкости, до тех пор, пока уровень жидкости достигнет нижней метки.
Капля, вытекающей жидкости, отрывается от трубки сталагмометра под действием силы тяжести собственной массы. Поверхностное натяжение стремится противодействовать вытеканию капли, поскольку образование капли связано с увеличением поверхности жидкости.
|
|
|
Чем больше поверхностное натяжение, тем больше должна быть масса капли, способной преодолеть поверхностное натяжение и оторваться.
Практическая часть
1. Определяют число капель воды, выливающейся из сталагмометра.
2. Затем подсчитывают число капель 0,1 М водных растворов следующих спиртов в указанном порядке: С2Н5ОН, С3Н7ОН, С4Н9ОН, С5Н11ОН.
3. Рассчитывают поверхностное натяжение этих спиртов по формуле σх = σводы ∙ nводы / nx.
4. Строят кривую зависимости σ от числа углеродных атомов в молекулах спиртов (n атомов углерода).
5. Делают вывод о зависимости поверхностного натяжения водных растворов спиртов от длины углеводородной цепи молекул спирта.
ЗАДАНИЕ № 2
Определение зависимости поверхностного натяжения раствора от концентрации ПАВ сталагмометрическим методом
Цель работы. Изучить зависимость величины поверхностного натяжения раствора от концентрации ПАВ
Работа выполняется аналогично действиям в работе № 1.
1. Как и в задании 1, вначале подсчитывают число капель воды.
2. Затем подсчитывают число капель водных растворов амилового спирта следующих концентраций: 0,01 М; 0,025 М; 0,05 М; 0,1 М; 0,2М. Подсчёт капель нужно начинать производить, начиная с растворов низшей концентрации.
3. Рассчитывают поверхностное натяжение водных растворов амилового спирта по формуле, приведённой в задании 1.
4. Графически представляют зависимость поверхностного натяжения водных растворов амилового спирта от его концентрации.
5. Делают вывод о зависимости σ от концентрации растворов амилового спирта.
ЗАДАНИЕ № 3
Изучение адсорбции вещества из раствора на твёрдом адсорбенте
Цель работы. Экспериментально определить величину адсорбции уксусной кислоты из раствора на активированном угле.
Сущность работы сводится к приведению растворов известной концентрации в контакт с адсорбентом. Затем через некоторое время после установления адсорбционного равновесия находят концентрацию равновесного раствора. Количество адсорбированного вещества из раствора вычисляют по разности между концентрацией раствора до и после адсорбции. Определяя эту разность для растворов различной концентрации и зная массу адсорбента, получают данные об удельной адсорбции вещества при разных значениях равновесных концентраций. По этим данным строят изотерму адсорбции. Изотерма описывается с помощью уравнения Лэнгмюра.
Ход работы
Начертите таблицу по форме, указанной ниже:
| № колбы | Концентрация СН3СООН в исходном растворе, моль/л | Концентрация NaOH в растворе для титрования, моль/л | Объём раствора NaOH, мл | Равновесная концентрация СН3СООН в фильтрате, моль/л | Адсорбция СН3СООН, моль/г |
| 1 | 0,1 | ||||
| 2 | 0,2 | ||||
| 3 | 0,3 | ||||
| 4 | 0,4 |
С помощью мерного цилиндра в четыре сухие пронумерованные колбы наливают по 25 мл раствора уксусной кислоты, концентрации указаны в таблице. Затем в каждую колбу вносят одновременно по 0,5 г предварительно измельчённого активированного угля. Содержимое колб перемешивают круговыми движениями в течение 10 минут. После этого растворы фильтруют через сухие складчатые фильтры в отдельные колбочки. Из каждого фильтрата с помощью пипетки отбирают по 10 мл и переносят в колбочки для титрования, добавляют по 2 капли индикатора фенолфталеина и титруют каждую пробу раствором гидроксида натрия (до устойчивой слабо-розовоой окраски). Результаты титрования записывают в таблицу. Далее рассчитывают равновесную концентрацию уксусной кислоты по формуле
Сравн (CH3COOH) = 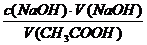
где V(СН3СООН) – объём, взятый для титрования.
Адсорбцию уксусной кислоты рассчитывают по формуле
 (моль/г)
(моль/г)
где Сисх – концентрация раствора уксусной кислоты до адсорбции, моль/л; Сравн – концентрация раствора уксусной кислоты после адсорбции или равновесная концентрация, моль/л; Vисх – объём раствора кислоты, взятый для адсорбции (в нашем опыте – это 0,025 л); m – масса адсорбента (в нашем случае это 0,5 г).
Чтобы построить изотерму адсорбции, по оси абсцисс откладывают равновесные концентрации Сравн, а по оси ординат – соответствующие им значения адсорбции Г.
Исходя из полученных данных, делают вывод о том, как зависит величина адсорбции уксусной кислоты из раствора на угле от её равновесной концентрации.
ЗАДАНИЕ 4
Адсорбция на активированном угле
К воде прилить несколько капель чернил для авторучки. Полученный раствор пропустить 1 – 2 раза через колонку, заполненную активированным углем. Отметить, что при этом наблюдается.
Повторить опыт с растворами окрашенных веществ, например с растворами лакмуса или фуксина.
ЗАДАНИЕ 5
Адсорбционные свойства силикагеля
К раствору сульфата меди (II) добавить раствор аммиака. При этом образуется комплексное соединение ярко синего цвета (написать реакцию образования комплекса). Затем в раствор всыпать 0,5 – 1 г измельчённого силикагеля и раствор взбалтывают. Бесцветный порошок силикагеля принимает тёмно-синюю окраску, а раствор бледнеет. Раствор слить с силикагеля, промыть водой (2 – 3 раза) и после этого добавить соляную кислоту. Темно-синяя окраска силикагеля исчезает, так как кислота разрушает медно-аммиачный комплекс и вымывает из силикагеля ионы меди.
Образцы решения типовых задач
Задача № 1
К 60 мл раствора уксусной кислоты с концентрацией раствора 0,1 моль/л добавили 2 г адсорбента и взболтали. После достижения равновесия пробу раствора объёмом 10 мл оттитровали раствором гидроксида натрия с концентрацией 0,05 моль/л. На титрование затрачено 15 мл титранта. Рассчитайте величину адсорбции уксусной кислоты.
Решение
1. Найдём равновесную концентрация раствора уксусной кислоты по результатам титрования:
Сравн(СН3СООН) = 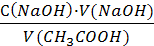
Сравн(СН3СООН) = 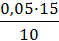 = 0,075 моль/л
= 0,075 моль/л
2. Рассчитываем величину адсорбции уксусной кислоты по формуле:
Г(СН3СООН) =  =
= 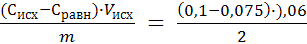
Г(СН3СООН) = 7,5 ∙ 10-4 моль/г = 0,75 ммоль/ г
Задача № 2
Определите величину адсорбции кислоты С8Н17СООН на поверхности водного раствора при 10 0С, если массовая доля кислоты в растворе 0,005%. Поверхностное натяжение чистой воды и раствора при этой температуре равны соответственно 74,22 ∙ 10-3 и 57,0 ∙ 10-3 Дж/м2.
Решение
1. Для расчёта адсорбции Г на поверхности раствора воспользуемся уравнением Гиббса:
Г = - 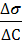 ∙
∙  = -
= -  ∙
∙ 
В уравнении Гиббса величина С2 означает молярную концентрацию кислоты, С1 = 0 (чистая вода).
2. Считая, что плотность разбавленного раствора кислоты около 1 г/мл (т.е. такая же, как и воды), используя ω% кислоты, находим, что в 100 мл раствора содержится 0,005 г кислоты. Молярная масса кислоты равна 158 г/моль, поэтому молярная концентрация раствора будет:
СМ = 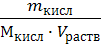 =
= 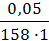 = 3,16 ∙ 10 -4 моль/л.
= 3,16 ∙ 10 -4 моль/л.
3. В уравнение Гиббса подставляем необходимые данные:
Г = -  ∙
∙  = 7,3 ∙ 10-6 моль/м2
= 7,3 ∙ 10-6 моль/м2
Ответ: 7,3 ∙ 10-6 моль/м2
3адача № 3
Экспериментально установлено, что максимальная величина адсорбции ПАВ (М = 60 гмоль) некоторым адсорбентом составляет 5,0 ∙ 103 мольг. Величина К равна 0,06 моль/л. Какая масса (в граммах) вещества адсорбировалась двумя граммами данного адсорбента из раствора, если равновесная концентрация ПАВ стала равна 0,1 моль/л?
Решение
1. Рассчитываем величину адсорбции ПАВ по уравнению Лэнгмюра:
Г = Г∞ 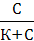
Г = 5,0 ∙ 10 -3 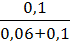 = 3,125 ∙ 10-3 (моль/г)
= 3,125 ∙ 10-3 (моль/г)
2. Количество адсорбированного вещества на адсорбенте массой 2 г будет в 2 раза больше:
nПАВ = 3,125 ∙ 10-3 моль/г ∙ 2г = 6,25 ∙ 10-3 моль
3. Масса адсорбированного вещества будет равна:
mПАВ = т∙М = 6,25 ∙ 10-3 ∙ 60 = 0,375 г
Ответ: m адсорбированного ПАВравна 0,375 г.
Задачи для самостоятельного решения
Задача 1.
Чему равно поверхностное натяжение водного раствора амилового спирта, если число капель этого раствора, вытекающего из сталагмометра, равно 72, а число капель воды – 60? Поверхностное натяжение воды при 293 К равно72,8 ∙ 10 -3 Дж/м2 (плотность раствора принять равной 1 г/см3). (Перед решением задачи ознакомьтесь с лабораторной работой «определение зависимости поверхностного натяжения растворов от длины углеводородной цепи и концентрации ПАВ».
Ответ: 60,6 ∙ 10-3 Дж/м2
Задача 2.
При 200С поверхностное натяжение 0,2 М водного раствора ПАВ равно 55 ∙ 10-3 Дж/м2. Вычислите величину адсорбции ПАВ (поверхностное натяжение воды при 200С равно 75,75 ∙ 10 -3 Дж/м2).
Задача 3.
Экспериментально установлено, что величина максимальной адсорбции пропионовой кислоты на угле 3,0∙10-3 моль/г; коэффициент К равен 6,0 10-3 моль/л. Какая масса пропионовой кислоты адсорбировалась из раствора, если равновесная концентрация кислоты равна 0,1 моль/л? Масса адсорбента равна 1 г.
Ответ: 0,139 г.
Тесты для самоконтроля
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 1
1. Выберите верное утверждение: 1) атомы или молекулы на границе раздела фаз обладают большой энергией по сравнению с атомами или молекулами в глубине фазы; 2) атомы или молекулы на границе раздела фаз обладают меньшей энергией по сравнению с атомами или молекулами в глубине фазы; 3) атомы или молекулы на границе раздела фаз и в глубине фазы обладают одинаковой энергией; 4) верное утверждение отсутствует.
2. Укажите, какие вещества, формулы которых указаны ниже, обладают отрицательной адсорбцией на поверхности водного раствора? 1) NH4OH; 2) C3H7NH2 ; 3) C3H13SO3; 4) Na2SO3
3. При увеличении температуры значение поверхностного натяжения: 1) уменьшается; 2) увеличивается; 3) не изменяется.
4. Поглощение вещества всей массой адсорбента называется: 1) адсорбцией; 2) абсорбцией; 3) сорбцией; 4) десорбцией.
5. Укажите, в каком ряду возрастает адсорбция веществ из водных растворов на активированном угле? 1) СН3СООН, СН3СООNa; С2Н5ОН; С3Н7ОН; 2) С3Н7ОН, С2Н5ОН, СН3СООН, СН3СООNa; 3) СН3СООNa, СН3СООН, С2Н5ОН, С3Н7ОН; 4) СН3СООNa, С3Н7ОН, СН3СООН, С2Н5ОН.
6. Чем лучше адсорбат растворяется в данном растворителе, тем он адсорбируется из этого растворителя: 1) хуже; 2) лучше; 3) растворимость адсорбата не влияет на адсорбцию.
7. Адсорбция газов на твёрдом адсорбенте зависит от: 1) от давления; 2) температуры; 3) природы адсорбента и адсорбата; 4) от удельной поверхности адсорбента.
8. Если число капель водного раствора, вытекающего из сталагмометра, больше числа капель воды, то растворённое вещество: 1) ПНВ; 2) ПИВ; 3) ПАВ.
9. Молекулярная адсорбция зависит от: а) природы адсорбента; б) природы растворителя; в) природы адсорбата; г) концентрации раствора; д) температуры? 1) а,б,в; 2) а,в, г, д; 3) а, б, в, г, д; 4) а,б,г,д.
10. Укажите единицы измерения поверхностного натяжения в системе СИ: 1) Н∙м2∙моль -1; 2) Дж∙м∙моль-1; 3) Дж ∙ м2; 4) Н∙ м.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 2
1. Адсорбция нелетучего растворённого вещества на поверхности его раствора зависит: 1) от природы растворённого вещества; 2) температуры; 3) давления; 4) концентрации растворённого вещества.
2. Величина поверхностной энергии уменьшается при: а) увеличении поверхности; б) уменьшения поверхности; в) увеличения поверхностного натяжения; г) уменьшения поверхностного натяжения. 1) б, г; 2) б, в; 3) а,в; 4) а,г.
3. Краситель фуксин будет лучше адсорбироваться углём из: 1) водных растворов; 2) спиртовых растворов; 3) природа растворителя значения не имеет; 4) в одинаковой степени.
4. Согласно теории БЭТ адсорбция завершается образованием: 1) мономолекулярного слоя; 2) цепей молекул, первая из которых связана с поверхностью адсорбента.
5. Укажите, какие утверждения верны: 1) химическая адсорбция может быть необратимой; 2) физическая адсорбция происходит за счёт сил Ван-дер-Ваальса; 3) адсорбция не зависит от температуры.
6. Из неполярных растворителей с ростом длины гидрофобного радикала величина адсорбции: 1) увеличивается; 2) уменьшается; 3) не меняется; 4) одинакова.
7. Среди перечисленных веществ выберите ПИВ: а) NaNO3; б) NaOH; в) пальмитат калия; г) H2SO4; д) бутановая кислота: 1) все; 2) а, б, г; 3) а, б, г, д; 4) в,д.
8. Какие факторы влияют на поверхностное натяжение жидкости? 1) природа жидкости; 2) природа граничащей фазы; 3) объём жидкости (р, Т – константы); 4) температура.
9. Выберите правильные утверждения: а) иониты – адсорбенты, способные к ионному обмену; б) иониты используются для смягчения и очистки воды, консервации крови; в) иониты нельзя использовать для детоксикации организма; г) иониты нельзя использовать для беззондовой диагностики желудочного сока. 1) а,б; 2) а,в; 3) б,в; 4) а,г.
10. Труднее адсорбируемые вещества в хроматографической колонке двигаются: 1) быстрее; 2) медленнее
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 3
1. Гемо- и лимфосорбция основаны на: 1) адсорбции ионов из растворов на твёрдом адсорбенте; 2) молекулярной адсорбции на твёрдом адсорбенте; 3) адсорбции белков и форменных элементов крови; 4) адсорбции газов на твёрдом адсорбенте.
2. Ионы лучше адсорбируются на: 1) полярных адсорбентах; 2) природа адсорбента значения не имеет; 3) неполярных адсорбентах.
3. Укажите, какие утверждения верны: 1) состояние молекул в поверхностном слое жидкости не отличается от состояния молекул в объёме жидкости; 2) поверхностное натяжение – это поверхностная энергия единицы площади поверхности; 3) адсорбция – это способ изменения свободной поверхностной энергии.
4. К ПИВ относятся вещества, обладающие: 1) положительной поверхностной активностью, при этом адсорбция отрицательная; 2) отрицательной поверхностной активностью, при этом адсорбция положительная; 3) положительной поверхностной активностью, при этом адсорбция положительная; 4) отрицательной поверхностной активностью, при этом адсорбция отрицательная.
5. Величина адсорбции жирных кислот из бензольного раствора силикагелем по мере увеличения молярной массы кислоты: 1) не изменяется; 2) увеличивается; 3) уменьшается.
6. Нитробензол из раствора в бензоле будет лучше адсорбироваться: 1) на угле; 2) на силикагеле; 3) в одинаковой степени; 4) природа адсорбента не имеет значения.
7. Укажите единицы измерения поверхностного натяжения в системе СИ: 1) Н∙м2∙моль -1; 2) Дж∙м∙моль-1; 3) Дж ∙ м2; 4) Н∙ м.
8. Укажите, какой катион из водного раствора лучше всего адсорбируется на отрицательно заряженных участках поверхности адсорбента: 1) К+; 2) Na+; 3) Li+; 4) Cs+
9. При увеличении температуры значение поверхностного натяжения: 1) уменьшается; 2) увеличивается; 3) не изменяется.
10. Согласно теории БЭТ адсорбция завершается образованием: 1) мономолекулярного слоя; 2) цепей молекул, первая из которых связана с поверхностью адсорбента.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 4
1. Уменьшение поверхностной энергии Гиббса происходит за счёт самопризвольного: 1) изменение межфазной поверхности не влияет на поверхностную энергию; 2) увеличения межфазной поверхности; 3) уменьшения межфазной поверхности; 4) нет верного ответа.
2. Из перечисленных веществ: вода, муравьиная кислота – максимальным поверхностным натяжением обладает: 1) вода; 2) муравьиная кислота.
3. Укажите, какие ионы из водного раствора преимущественно могут адсорбироваться на поверхности кристаллического йодида серебра: 1) K+; 2) Ag+; 3) I1-; 4) NO31-
4. Притяжение атомов, молекул, ионов внутри отдельной фазы называется: 1) смачиванием; 2) адсорбцией; 3) когезией; 4) адгезией.
5. Адсорбция – экзотермический процесс, поэтому при увеличении температуры величина адсорбции: 1) не меняется; 2) увеличивается; 3) уменьшается; 4) одинакова.
6. Многослойная адсорбция характеризуется:
1) теорией Ленгмюра; 2) теорией БЭТ; 3) теорией Фрейндлиха; 4) теорией Генри.
7. Силикагель лучше адсорбирует вещества из растворов с: 1) полярным растворителем; 2) неполярным растворителем; 3) в одинаковой степени; 4) полярность растворителя роли не влияет на адсорбцию.
8. Согласно правилу Дюкло-Траубе, поверхностная активность с увеличением длины углеродного радикала на одну СН2-группу: 1) не изменяется; 2) увеличивается в 3 – 3,5 раза; 3) уменьшается в 3 – 3,5 раза; 4) изменяется незакономерно.
9. Среди перечисленных веществ выберите ПАВ: а) NaCl; б) желчные кислоты; в) стеарат натрия; г) Na2SO4; д) фосфолипиды 1) все; 2) б,в, д; 3) а,г; 4) б,в
10. Уравнение Гиббса применимо: 1) только для подвижных границ раздела; 2) только для неподвижных границ раздела; 3) как для подвижных, так и для неподвижных границ раздела фаз.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 5
1. Адсорбция растворённого вещества из раствора на поверхности твёрдого адсорбента зависит: 1) от природы адсорбента и растворённого вещества; 2) температуры; 3) природы растворителя; 4) концентрации растворённого вещества
2. К ПИВ относятся: а) КОН; б) Na3PO4; в) H2SO4; г) СН3СООН; д) С17Н35СООNa. 1) г, д; 2) а, б, в; 3) а,б, в, г; 4) а,б.
3. На молекулярную адсорбцию влияют факторы: 1) природа растворителя; 2) природа адсорбента; 3) равновесная концентрация растворённого вещества; 4) природа растворённого вещества; 5) температура и время адсорбции
4. Укажите формулы ПАВ: 1) С3Н7СООNa; 2) NaHCO3; 3) С2Н5ОН; 4) С2Н5NH2; 5) Н2N – CH2 – COOH
5. При адсорбции ПИВ на границе раздела фаз величина поверхностной активности (g) и величина адсорбции (Г) имеют следующие значения: 1) g < 0, Г < 0; 2) g > 0, Г > 0; 3) g < 0, Г > 0; 4) g > 0, Г < 0;
6. Из ионов одинакового заряда максимальную адсорбционную способность проявляют ионы: 1) наименьшего радиуса; 2) величина радиуса иона значения не имеет; 3) наименьшего радиуса
7. Чаще всего удельную адсорбцию выражают: 1) в г/моль; 2) в моль/г; 3) г/кг;
8. Энергия взаимодействия при хемосорбции составляет: 1) 20 – 30 кДж/моль; 2) 10 – 40 кДж/моль; 3) 40 – 400 кДж/моль.
9. Величина адсорбции углём карбоновых кислот из их водных растворов по мере увеличения длины гидрофобного радикала: 1) не меняется; 2) уменьшается; 3) возрастает
10. Избирательная адсорбция сильных электролитов подчиняется правилу: 1) Ребиндера; 2) Шилова; 3) Фаянса; 4) Гиббса
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 6
1. Адсорбенты, способные к обмену ионами называются: 1) силикагелями; 2) алюмосиликатами; 3) ионитами; 4) кварцитами
2. Из полярных растворителей с ростом длины гидрофобного радикала величина адсорбции: 1) уменьшается; 2) не меняется; 3) одинакова; 4) увеличивается
3. Если число капель водного раствора, вытекающего из сталагмометра, больше числа капель воды, то растворённое вещество является: 1) ПИВ; 2) ПАВ; 3) ПНВ
4. Нитробензол из водных растворов будет лучше адсорбироваться: 1) на угле; 2) на силикагеле; 3) в одинаковой степени; 4) природа адсорбента не имеет значения
5. Притяжение атомов, молекул, ионов внутри отдельной фазы называется: 1) когезией; 2) смачиванием; 3) адгезией; 4) адсорбцией
6. При физической адсорбции частицы удерживаются на поверхности адсорбента за счёт: а) химического взаимодействия; б) межмолекулярных сил Ван-дер-Ваальса; в) проникновения в поры адсорбента; г) водородной связи. 1) а; 2) а,г; 3) б,в; 4) б,г
7. Поглощение вещества всей массой адсорбента называется: 1) адсорбцией; 2) смачиванием; 3) абсорбцией; 4) десорбцией
8. Твёрдое тело на поверхности которого происходит адсорбция принято называть: 1) адсорбтивом; 2) адсорбатом; 3) адсорбентом; 4) микропором.
9. Зависимость адсорбции от равновесного давления при постоянной температуре и выражаемой кривыми Г = f(р) называемыми: 1) изобарами; 2) изохорами; 3) изотермами; 4) гиперболами
10. Поверхностное натяжение повышают вещества: 1) сахароза; 2) щелочи; 3) этанол; 4) амины
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 7
1. Основными факторами, обусловливающими специфичность адсорбции сильных электролитов являются: 1) знак заряда поверхности адсорбента; 2) величина и знак заряда иона электролита; 3) радиус иона; 4) сольватация иона
2. Активированный уголь – гидрофобный сорбент и лучше адсорбирует 1) полярные вещества из неполярных растворителей; 2) неполярные вещества из полярных растворителей; 3) полярные вещества из полярных растворителей; 4) неполярные вещества из неполярных растворителей
3. Чем легче конденсируются газы, тем: 1) труднее они сорбируются на твёрдых адсорбентах; 2) легче они сорбируются на твёрдых адсорбентах; 3) процесс адсорбции не зависит от температуры конденсации газов; 4) нет верного утверждения
4. Молекулярное притяжение между поверхностями двух соприкасающихся разнородных фаз называется: 1) когезией; 2) смачиванием; 3) адгезией; 4) адсорбцией
5. Из перечисленных веществ: вода, муравьиная кислота – максимальным поверхностным натяжением обладает: 1) вода; 2) муравьиная кислота
6. При адсорбции из водных растворов на угле молекулы соли стеарата натрия ориентируются в сторону угля: а) гидрофобным концом; б) ориентация молекул может быть любой; в) карбоксильной группой; г) гидрофильным концом. 1) а; 2) б; 3) а,в; 4) б,г
7. Чем больше заряд и меньше радиус сольватированного иона, тем его адсорбционная способность: 1) выше; 2) ниже; 3) одинакова
8. Принцип независимости поверхностного действия сформулировал: 1) Ребиндер; 2) Гиббс; 3) Смолуховский; 4) Ленгмюр.
9. Укажите, какой катион из водного раствора лучше адсорбируется на отрицательно заряженных участках поверхности адсорбента: 1) К+; 2) Na+; 3) Li+; 4) Cs+
10. К числу молекул ПАВ, которые меняют поверхностное натяжение, относятся молекулы состоящие из полярной группы и неполярного радикала. Эти молекулы называют: 1) фуллеренами; 2) пастереллами; 3) дифильными; 4) хелатами.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 8
1. Из перечисленных веществ: вода, муравьиная кислота – минимальным поверхностным натяжением обладает: 1) вода; 2) муравьиная кислота.
2. Какую зависимость отражает изотерма поверхностного натяжения: а) коэффициента поверхностного натяжения от концентрации вещества в экспериментально найденном интервале температур; б) коэффициента поверхностного натяжения от концентрации вещества в заданном интервале температур; в) коэффициента поверхностного натяжения от концентрации вещества при постоянной температуре; г) коэффициента поверхностного натяжения от величины адсорбции вещества при постоянной температуре? 1) а; 2) б; 3) в; 4) г.
3. Укажите единицу измерения поверхностного натяжения: 1) н/м; 2) н/м2; 3) Дж/м; 4) Дж/моль∙К.
4. Поглощение вещества всей массой адсорбента называется: 1) сорбцией; 2) адсорбцией; 3) абсорбцией; 4) десорбцией,
5. Если число капель, вытекающих из сталагмометра, больше числа капель воды, то растворённое вещество: 1) ПАВ; 2) ПИВ; 3) ПНВ.
6. Из полярных растворителей с ростом длины гидрофобного радикала величина адсорбции: 1) увеличивается; 2) уменьшается; 3) не меняется; 4) одинакова.
7. При молекулярной адсорбции из растворов неэлектролитов растворённое вещество адсорбируется в виде: 1) ионов; 2) коллоидных частиц; 3) молекул; 4) комплексов.
8. Чем лучше растворитель растворяет вещество, тем: 1) вещество лучше адсорбируется на адсорбенте; 2) вещество хуже адсорбируется на адсорбенте; 3) растворимость роли не играет.
9. При ионной адсорбции чем больше заряд иона, тем: 1) слабее ион притягивается к противоположно заряженной поверхности адсорбента; 2) сильнее ион притягивается к противоположно заряженной поверхности адсорбента; 3) заряд не влияет на адсорбции.
10. При адсорбции из бензольных растворов на силикагеле стеарат натрия ориентируется в сторону силикагеля: а) гидрофобным концом; б) ориентация может быть любой; в) карбоксильной группой; г) гидрофильным концом. 1) а; 2) б; 3) а,в; 4) б, г.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, АДСОРБЦИЯ ТЕСТ № 9
1. Олеат натрия из водного раствора будет лучше адсорбтроваться: 1) на угле; 2) на силикагеле; 3) в равной степени и на угле и на силикагеле; 4) адсорбция не происходит.
2. Выберите верное утверждение: 1) чем меньше длина углеводородного радикала и больше полярность, тем больше поверхностная активность; 2) чем больше длина углеводородного радикала и меньше полярность, тем больше поверхностная активность; 3) чем меньше длина углеводородного радикала и меньше полярность, тем больше поверхностная активность; 4) нет верного утверждения.
3. К ПАВ относятся: а) NaCl; б) K2SO4; в) олеат натрия; г) желчные кислоты; д) липиды. 1) а,б; 2) в, г, д; 3) в, г; 4) все.
4. Из предложенных ионов: К+, Са2+, Al3+ - минимальной адсорбционной способностью обладает: 1) Al3+; 2) K+; 3) Ca2+.
5. Ионы электролитов лучше адсорбируются на: 1) полярных электролитах; 2) неполярных электролитах; 3) в одинаковой степени; 4) природа адсорбента значения не имеет.
6. Из ионов одинакового заряда минимальную адсорбционную способность проявляют ионы: 1) наибольшего радиуса; 2) величина радиуса иона не имеет значения; 3) наименьшего радиуса.
7. Хроматография – это физико-химический метод разделения и анализа смесей, основанный на: 1) разделении веществ между подвижной и неподвижной фазами; 2) измерении ЭДС гальванической цепи; 3) определении электрической проводимости жидких сред; 4) измерении вязкости растворов полимеров.
8. Адсорбция газов на твёрдом адсорбенте зависит: 1) от давления; 2) температуры; 3) природы адсорбента и адсорбата; 4) от удельной поверхности адсорбента.
9. Укажите, какие ионы из водного раствора преимущественно могут адсорбироваться на поверхности кристаллического йодида серебра: 1) K+; 2) Ag+; 3) I1-; 4) NO31-.
10. Адсорбция нелетучего растворённого вещества на поверхности его раствора зависит: 1) от природы растворённого вещества и растворителя; 2) температуры; 3) давления; 4) концентрации растворённого вещества.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ ТЕСТ № 10
1. Укажите уравнение Гиббса:
А) Г =  ; б) Г = Кф∙С1/ n; в) Г =
; б) Г = Кф∙С1/ n; в) Г = 
2. Хроматография применяется для: а) определения наличия алкоголя, наркотиков, допинга в крови и моче; б) выделении и очистки белков, гормонов, нуклеиновых кислот; в) определения вязкости растворов полимеров; г) измерения биопотенциалов. 1) а,б; 2) а,в; 3) б,в; 4) а,г.
3. Для регенерации анионита его промывают: 1) раствором кислоты; 2) раствором щелочи; 3) раствором хлорида натрия; 4) водой.
4. К ПАВ относятся: а) сахароза; б) фосфолипиды; в) желчные кислоты; г) белки. 1) все; 2) б,в,г; 3) в,г; 4) а,в,г.
5. К ПИВ относятся: а) KOH; б) Na3PO4; в) H2SO4; г) СН3СООН; д) С17Н35СООNa. 1) г,д; 2) а,б,в; 3) а,б,в,г; 4) а,б.
6. Анилин из раствора в бензоле будет лучше адсорбироваться: 1) на угле; 2) на силикагеле; 3) природа адсорбента значения не имеет; 4) в одинаковой степени.
7. Из неполярных растворителей с ростом длины гидрофобного радикала величина адсорбции: 1) увеличивается; 2) уменьшается; 3) не меняется; 4) одинакова.
8. Чем хуже адсорбат растворяется в данном растворителе, тем он: 1) хуже адсорбируется; 2) величина адсорбции не зависит от растворимости адсорбата; 3) лучше адсорбируется.
9. Выберите верное утверждение: 1) величина адсорбции прямо пропорциональна давлению газа; 2) величина адсорбции обратно пропорциональна давлению газа; 3) величина адсорбции прямо пропорциональна давлению газа только в области малых значений давления; 4) величина адсорбции не зависит от давления газов.
10. Адсорбция – экзотермический процесс, поэтому при увеличении температуры величина адсорбции: 1) уменьшается; 2) увеличивается; 3) не меняется; 4) одинакова.
ОТВЕТЫ НА ТЕСТЫ
(ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ)
ИЛЕТ 1
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 1 | 1, 4 | 1 | 2 | 3 | 1 | 1,2,3,4 | 3 | 3 | 3,4 |
БИЛЕТ 2
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 1,2,4 | 1 | 1 | 2 | 1,3,4 | 2 | 2 | 1,2,4 | 1 | 2 |
БИЛЕТ 3
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 2 | 1 | 2,3 | 4 | 3 | 2 | 3,4 | 4 | 1 | 2 |
БИЛЕТ 4
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 3 | 2 | 2,3 | 3 | 3 | 2 | 2 | 2 | 2 | 3 |
БИЛЕТ 5
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 1,2,3,4 | 2 | 1,2,3,4,5 | 1,2 | 3 | 1 | 2 | 3 | 3 | 3 |
БИЛЕТ 6
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 3 | 4 | 2 | 1 | 1 | 4 | 3 | 3 | 3 | 2 |
БИЛЕТ 7
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 1,2,3,4 | 2 | 2 | 3 | 1 | 1 | 1 | 4 | 4 | 3 |
БИЛЕТ 8
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 1 | 3 | 1 | 3 | 1 | 1 | 3 | 2 | 2 | 4 |
БИЛЕТ 9
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 1 | 2 | 2 | 2 | 1 | 3 | 1 | 1,2,3,4 | 2, 3 | 1,2,4 |
БИЛЕТ 10
| № ВОПРОСА | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № ОТВЕТА | 3 | 1 | 2 | 2 | 2 | 2 | 2 | 3 | 3 | 1 |
ЛИТЕРАТУРА ОСНОВНАЯ
(общая химия)
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для медицинских вузов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и другие. Под ред. Ю.А. Ершова, 8 изд.,560 с. – М.: Высш. Шк., 2010.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов медицинских вузов. (Ред. В.А. Попков).- М., Высшая школа, 4 изд., 239 с., 2008 г.
3. Сборник задач и упражнений по общей химии. Учебное пособие. (С.А.Пузаков, В.А. Попков, А.А. Филиппова). М: Высшая школа, 4 изд., 255с., 2010г.
ДОПОЛНИТЕЛЬНАЯ
1. Слесарев В.И. Химия: Основы химии живого: Учебник для вузов. – СПб: Химиздат, 2000.
2. Барковский Е.В., Ткачёв С.В., Пансевич Л.И., Латушко Т.В., Болбас О.П. Основы биофизической и коллоидной химии. «Вышэйшая школа», Минск, 2009.
3. Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия. СПб.: Издательство «Лань», 2003.
4. Глинка, Н.Л. Общая химия: учебник /под ред. В.А. Попковав, А.В. Бвбкова. – 18 изд., перераб. и доп. – М.: Издательство Юрайт; ИД Юрайт, 2011. (Учебник ориентирован на студентов медицинских вузов).
5. Хмельницкий Р.А. Физическая и коллоидная химия: Учеб. для с.-х спец. Вузов. – М.: Высш. шк., 1988.
6. Воюцкий С.С. Курс коллоидной химии. М.: «Химия», любой год издания. (Классический курс коллоидной химии)
Дата добавления: 2021-01-20; просмотров: 137; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
