Понятия и термины, используемые в работе
Экстракция (определение); экстрагент - органический растворитель, несмешивающийся с водой, который используется для извлечения вещества А; экстракт - раствор вещества А в органическом растворителе (органическая фаза, содержащая извлеченное вещество А); рафинат - водная фаза, содержащая остаток вещества А. Экстракцию проводят в делительных воронках, позволяющих разделить контактирующие фазы после установления равновесия и полного расслаивания жидкостей. Если плотность органического растворителя меньше плотности воды, то экстракт образует верхний слой в делительной воронке; если наоборот - нижний:
Если растворенное вещество А находится в одинаковом состоянии в обеих контактирующих фазах, не ассоциирует и не диссоциирует, то коэффициент распределения приобретает свойства константы распределения (закон распределения Нернста), которая при данной температуре не зависит от концентрации исходного водного раствора.
Экстракция может быть однократной, когда экстрагент добавляется в один прием, и дробной - добавление экстрагента проводится порциями в несколько приемов. При этом, чем больше число последовательных стадий извлечения, тем больше полнота (эффективность) извлечения при одном и том же количестве взятого экстрагента.
После добавления экстрагента, встряхивания и отстаивания (расслаивание) проводят отделение водной фазы (рафината) от органической (экстракта), аккуратно сливая ее в сухую чистую колбу или стакан. Определение количества извлеченного вещества и все другие расчеты выполняют на основе результатов анализа физико - химическим или объемным методом исходного водного раствора вещества А и рафината. Для оценки степени извлечения необходимо сравнить массу извлеченного вещества с теоретически возможной (исходной) массой вещества.
|
|
|
Допустим, что в водном растворе объемом V1 содержится масса вещества m0, извлекаемого однократно органическим экстрагентом, объем которого Vэ. После перехода в экстрагент некоторой массы вещества А устанавливается равновесие с соответствующими равновесными концентрациями вещества А в водной (рафинат) и органической (экстракт) жидкостях:
 (2);
(2);  (3),
(3),
где m1 - масса вещества, оставшаяся не извлеченной в результате однократной экстракции, т.е., масса вещества в рафинате.
По закону распределения:
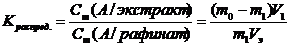 (4),
(4),
откуда 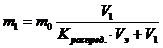 (5)
(5)
Для дробной экстракции:
 (6),
(6),
где mn - масса не извлеченного вещества после n экстракций; 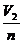 - объем порции экстрагента; n - число экстракций.
- объем порции экстрагента; n - число экстракций.
Степень извлечения b(%) (эффективность экстракции) рассчитывают при однократной экстракции:
|
|
|
 (7), при дробной экстракции:
(7), при дробной экстракции:  (8).
(8).
Порядок выполнения работы
В делительную воронку вносят водный раствор объемом V1, содержащий экстрагируемое вещество А; к нему добавляют экстрагент объемом Vэ. Содержимое делительной воронки встряхивают примерно 5 минут до образования эмульсии, после чего позволяют системе расслоиться. Массу вещества А в рафинате при однократной экстракции рассчитывают по формуле:
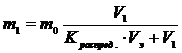 (9);
(9);
при этом эффективность экстракции b1 находят соответственно:

Если экстракт отделить от рафината, а к рафинату добавить новую порцию экстрагента Vэ, встряхивать до образования эмульсии, дать расслоиться, то можно рассчитать массу вещества А в рафинате при двукратной экстракции:
 (10);
(10);
Сравнивая значения b1 и b2, рассчитанное по формуле:
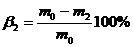 ,
,
убеждаются в большей эффективности двухкратной экстракции.
Экстракцию можно выполнить дробно, разделив используемый объем экстрагента Vэ на несколько порций (n порций) и последовательно, n-кратно экстрагируя вещество А из аликвоты исследуемого раствора. Масса оставшегося в рафинате вещества А при n-кратной экстракции:

Эффективность экстракции bn, рассчитанное согласно 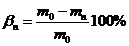 , при этом заметно возрастает.
, при этом заметно возрастает.
|
|
|
Цель работы
Определить m(J2) в выданной задаче (m0) и коэффициент распределения Краспред йода между водной и органической (CHCl3) жидкостями на основе анализа исходного водного раствора (задача) и рафината методом йодометрического титрования. Титрант - стандартный раствор Na2S2O3.
Йодометрическое титрование или иодометрия - это метод объемного анализа, в основе которого лежат окислительно - восстановительные реакции, связанные с превращением J2 в 2J- и обратно:
J2 + 2е « 2J-,
и поэтому могут использоваться для определения, как окислителей, так и восстановителей.
В качестве стандартных растворов в иодометрии используются растворы J2 (окислитель) или Na2S2O3 (восстановитель).
Определение йода тиосульфатом натрия является классическим примером йодометрического анализа. В основе определения лежит реакция:
J2 + 2Na2S2O3 ® 2NaJ + Na2S4O6
тиосульфат тетратионат
натрия натрия
J2 + 2e ® 2J- Þ Э(J2) = 1/2J2
2S2O32- - 2e ® S4O62- Þ Э(Na2S2O3) = 1/1Na2S2O3
|
|
|
n(1/2J2) = n(1/1Na2S2O3)
Титрование выполняют в присутствии индикатора - свежеприготовленного раствора крахмала, который добавляют в конце титрования, когда исследуемый раствор приобретает светло - желтое окрашивание. Заканчивают титрование при полном обесцвечивании синего раствора от одной избыточной капли стандартного раствора тиосульфата натрия.
Практическая часть
1. В мерную колбу вместимостью 200 мл получить задачу - исследуемый водный раствор йода, разбавить водой до метки, тщательно перемешать.
2. Пипеткой отобрать 50,0 мл разбавленного раствора (V1) в колбу для экстракции, добавить пипеткой 10,0 мл (Vэ) экстрагента, хорошо перемешать (5-7 мин.) до образования эмульсии. При этом экстракт приобретает бурое окрашивание. Оставить систему до полного расслоения.
3. Бюретку заполнить стандартным 0,01 н раствором тиосульфата натрия.
4. Определить концентрацию йода в исходном растворе (задача). Для этого в коническую колбу для титрования отобрать аликвоту водного раствора J2 (Vал= 10,0 мл), разбавить дистиллированной водой (» 20 мл) и титровать стандартным раствором тиосульфата натрия до светло-желтой окраски, после чего добавить 10 капель свежеприготовленного раствора крахмала (раствор приобретает синее окрашивание) и продолжить титрование до полного обесцвечивания раствора от одной избыточной капли титранта. Титрование повторить не менее трех раз.
5. Рафинат, полученный согласно п.2 слить в небольшую сухую колбу и определить концентрацию J2 в рафинате аналогично п.4.
Экстракт слить в специальную бутыль для сбора органических отходов.
6. Полученные в результате эксперимента данные свести в таблицу 1:
Таблица 1
Дата добавления: 2021-01-20; просмотров: 130; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
