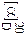ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ И ОПТИЧЕСКАЯ ИЗОМЕРИЯ.
Кафедра органической, физической и коллоидной химии
Дистанционное
Обучение
Хим.орг. – 1.22.2701.очн.плн. Хим.орг. – 1.22.2701.вчр.плн. Хим.орг. – 1.22.2701.зчн.скр. Хим.орг. – 1.22.2701.зчн.плн.
Хим.орг. – 1.22.2703.очн.плн. Хим.орг. – 1.22.2703.вчр.плн. Хим.орг. – 1.22.2703.зчн.скр. Хим.орг. – 1.22.2703.зчн.плн.
Хим.орг. – 1.22.2704.очн.плн. Хим.орг. – 1.22.2704.вчр.плн. Хим.орг. – 1.22.2704.зчн.скр. Хим.орг. – 1.22.2704.зчн.плн.
Хим.орг. – 1.22.2705.очн.плн. Хим.орг. – 1.22.2705.вчр.плн. Хим.орг. – 1.22.2705.зчн.скр .Хим.орг. – 1.22.2705.зчн.плн.
Хим.орг. – 1.22.2707.очн.плн. Хим.орг. – 1.22.2707.вчр.плн. Хим.орг. – 1.22.2707.зчн.скр. Хим.орг. – 1.22.2707.зчн.плн.
Хим.орг. – 1.22.2708.очн.плн. Хим.орг. – 1.22.2708.вчр.плн. Хим.орг. – 1.22.2708.зчн.скр. Хим.орг. – 1.22.2708.зчн.плн.
Хим.орг. – 1.22.2710.очн.плн. Хим.орг. – 1.22.2710.вчр.плн. Хим.орг. – 1.22.2710.зчн.скр. Хим.орг. – 1.22.2710.зчн.плн.
Хим.орг. – 1.22.2712.очн.плн. Хим.орг. – 1.22.2712.вчр.плн. Хим.орг. – 1.22.2712.зчн.скр. Хим.орг. – 1.22.2712.зчн.плн.
Хим.орг. – 1.22.0135.очн.плн. Хим.орг. – 1.22.0135.вчр.плн. Хим.орг. – 1.22.0135.зчн.скр. Хим.орг. – 1.22.0135.зчн.плн.
Хим.орг. – 1.22.3117.очн.плн. Хим.орг. – 1.22.3117.вчр.плн. Хим.орг. – 1.22.3117.зчн.скр. Хим.орг. – 1.22.3117.зчн.плн.
В.А. Домбровский, В.С. Падалкина,
А.М. Евтушенко, И.Г. Крашенинникова
|
|
|
ОРГАНИЧЕСКАЯ ХИМИЯ
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ
Учебно-практическое пособие для студентов технологических
специальностей всех
форм обучения

www.msta . ru
Москва - 2004 4131
УДК: 547
© Домбровский В.А., Падалкина В.С., Евтушенко А.М., Крашенинникова И.Г. Учебно-практическое пособие – М., МГУТУ, 2004.
Учебно – практическое пособие предназначено для более глубокого изучения раздела «Гидроксикарбоновые кислоты» в органической химии. Материал данного раздела изложен на современном научном уровне.
Пособие предназначено для студентов технологических специальностей 2 и 3 курса всех форм обучения.
Авторы: Домбровский Владимир Андреевич, Падалкина Валентина Стефановна, Евтушенко Анатолий Михайлович, Крашенинникова Ирина Геннадьевна.
Рецензенты: Профессор, д.х.н. «Синтез полимеров» МГАТХТ ми. М.В. Ломоносова Грицкова И.А.
Доцент, к.х.н. каф. «Органической химии» МГУПБ Фонский Д.Ю.
Редактор: Свешникова Н.И.
© Московский государственный университет технологий и управления, 2004
109004, Москва, Земляной вал, 73.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ. 4
|
|
|
1.ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ И ОПТИЧЕСКАЯ ИЗОМЕРИЯ.. 5
2. ОДНООСНОВНЫЕ ГИДРОКСИКИСЛОТЫ. 7
2.1.Физические свойства. 9
2.2. Химические свойства. 9
2.3.Специфические реакции. 12
2.4.Важнейшие представители. 13
2.5.Оптическая изомерия гидроксикислот. 14
2.6.Конфигурация и знак вращения.D- и L- ряды. 18
3. МНОГООСНОВНЫЕ И МНОГОАТОМНЫЕ ГИДРОКСИКИСЛОТЫ. 19
3.1.Методы расщепления рацематов на антиподы. 24
3.2.Стереохимия реакций замещения. 25
4. АРОМАТИЧЕСКИЕ ГИДРОКСИКИСЛОТЫ (ФЕНОЛОКИСЛОТЫ). 27
4.1.Реакции с участием карбоксильной группы. 29
4.2.Реакции с участием фенольного гидроксила. 29
4.3.Реакции в бензольное кольцо. 30
5. АРОМАТИЧЕСКИЕ ТРИГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ. 31
6. НЕПРЕДЕЛЬНЫЕ ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ. 32
7. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ. 32
8. ТЕСТЫ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ, 33
8.1.Примеры с ответами. 33
8.2. Для самостоятельного решения. 335
ЛИТЕРАТУРА.. 37
ВВЕДЕНИЕ
Гидроксикислоты важны для современной науки, сельского хозяйства, медицины, пищевой промышленности и др. Соединения этого класса распространены в растительном и животном мире, где они выполняют ответственные функции жизнедеятельности организмов.
|
|
|
В природе встречаются разнообразные гидрокси- и алкоксикарбоновые кислоты. Гидроксиалкановые кислоты были выделены из ланолина, пчелиного воска, коры корней воскообразного слоя листьев, семян, бактерий и грибов. Наиболее широко встречаются α-гидроксиалкановые кислоты, а комбинации со сфингозинами тканей животных или фитоофингазинами растений и микроорганизмов они, очевидно, входят в состав всего живого. Кроме того, α-гидрокси- кислоты были обнаружены в цереброзирах, выделенных из тканей мозга. β-ги-дроксикислоты играют важную роль в биосинтезе и катаболизме ( процесс распада веществ в организме) жирных кислот, а в процессе метаболизма воска насекомых или растений синтезируются из ненасыщенных кислот.
о-Гидроксибензойная (салициловая) кислота присутствует в виде метилового эфира во многих эфирных маслах и является основным компонентом масла гаултерии. Известное лекарство аспирин – это о-ацетилпроизводное салициловой кислоты. Салициловая кислота применяется в пищевой промышленности, при консервировании фруктов.
2-Гидроксипропановая кислота (молочная кислота) находит широкое применение в пищевой промышленности при изготовлении конфет, безалкогольных напитков. Эфиры молочной кислоты употребляются в качестве улучшающих добавок в хлебопечении, при производстве кондитерских изделий, мороженного.
|
|
|
Гидроксибутандиеновая кислота (яблочная) и 2-гидроксипропан-1,2,3-три-карбоновая (лимонная) кислоты находят во многих плодах. Кроме того, обе кислоты принимают участие в цикле трикарбоновых кислот (цикл Кребса). 2,3 -D-(+)-Дигидроксибутандионовая (винная) кислота присутствует в виноградном соке.
Большинство природных гидроксикислот оптически активны.
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ И ОПТИЧЕСКАЯ ИЗОМЕРИЯ.
Гидроксикарбоновые кислоты *(гидроксикислоты) или (спиртокислоты) – это органические соединения, молекулы которых содержат одновременно карбоксильную и гидроксильную группы. Таким образом, гидроксикислоты являются бифункциональными органическими соединениями. Количество функциональных групп в гидроксикислотах может быть разным: одна гидроксильная и одна карбонильная, две гидроксильных и одна карбоксильная, две гидроксильных и две карбоксильных и т.д.
Гидроксикислоты можно рассматривать как производные соответствующих органических кислот:
| Органическая кислота | Гидроксикислота |
| Н3С-СООН** уксусная | НО-СН2-СООН гидроксиуксусная или гликолевая |
| Н3С-СН2-СООН пропионовая |  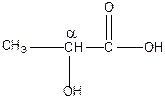
 α-гироксипропионовая α-гироксипропионовая
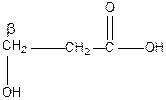 β-гидроксипропионовая
β-гидроксипропионовая
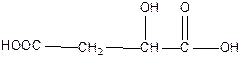 гидроксиянтарная или яблочная
гидроксиянтарная или яблочная
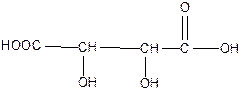 дигидроксиянтарная, или винная
дигидроксиянтарная, или винная
|
Гидрокислоты классифицируют по основности и по атомности. Количество карбоксильных групп указывает на основность кислоты, а количество гидроксильных групп, учитывая и гидроксил карбоксила – на её атомность. Например, гидроксиуксусная кислота, α – и β - гидроксипропионовые кислоты являются односновными двухатомными гидроксикислотами, а яблочная кислота – двухосновной трехатомной гидроксикислотой, винная – двухосновной четырех атомной гидроксикислотой и т. д. Для гидроксикислот используют преимущественно исторические названия, которые происходят от названий природных источников нахождения этих гидроксикислот. Так, α –гидроксипропионовая кислота впервые была найдена в кислом молоке и потому называется молочной кислотой, гидроксиянтарная кислота впервые была найдена в яблоках и её называют яблочной, дигидроксиянтарная содержится в винограде и потому её называют виноградной и т.д. Часто гидроксикислоты называют по названию соответствующих карбоновых кислот, обозначая греческими буквами положение спиртовой группы в молекуле относительно карбоксильной например: α – гидроксипропионовая кислота, β – оксипропионовая кислота и т.д. По систематической номенклатуре название гидроксикислоты образуют из названия соответствующей карбоновой кислоты, перед которой ставят приставку гидрокси-(окси-), что указывает на присутствие ОН – группы в молекулах этих кислот. Положение гидроксильной группы в цепи указывают номером углеродного атома, с которым она соединена, причем нумерацию углеродных атомов в цепи начинают с углеродного атома карбоксильной группы. Например: 2 – гидроксипропановая кислота, 3 – гидроксипропановая кислота. В табл.1 приведены названия наиболее распространенных гидроксикислот. Изомерия в ряду гидроксикислот зависит от структуры углеводородной цепи и положения спиртового гидроксила. Гликолевая кислота изомеров не имеет. Следующий гомолог ряда гидроксикислот существует в виде двух изомеров - α – гидроксипропионой и β – гидроксипропионой кислот, которые отличаются положением спиртового гидроксила. Одноосновная гидроксикислота с четырьмя углеродными атомами может существовать в виде пяти структурных изомеров:
 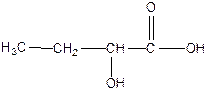
 2- гидроксибутановая кислота 2- гидроксибутановая кислота
 α – гидроксимасляная кислота α – гидроксимасляная кислота
| 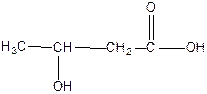 3 – гидроксибутановая, или β – гидроксимасляная кислота
3 – гидроксибутановая, или β – гидроксимасляная кислота
|
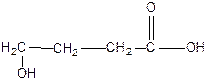 4-гидроксибутановая кислота
или
γ – гидроксимасляная кислота (ГОМК)
4-гидроксибутановая кислота
или
γ – гидроксимасляная кислота (ГОМК)
| 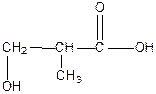 2-метил-3-гидроксипропановая кислота
2-метил-3-гидроксипропановая кислота
|
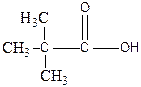 2-метил-2-гидроксипропановая кислота
2-метил-2-гидроксипропановая кислота
|
Первые три из приведённых гидроксикислот являются изомерами, которые отличаются положением спиртового гидроксила, изомерия остальных обусловлена еще и разветвлением углеводородной цепи. Кроме того, гидроксикислоты, молекулы которых содержат асимметрические атомы углерода существуют в виде оптических изомеров.
2. ОДНООСНОВНЫЕ ГИДРОКСИКИСЛОТЫ.
Ряд гидроксикислот, как, например, молочная, винная, лимонная и др., являются продуктами жизнедеятельности организмов. Поэтому некоторые гидроксикислоты и в промышленных масштабах получают путем биосинтеза - синтеза с помощью живых организмов. Так, молочную кислоту получают молочнокислым брожением углеводородов. Кроме того, существуют синтетические методы получения гидрокислот. Из этих методов для получения α – гидроксикислот чаще всего используют следующие:
1. Кислотный гидролиз циангидридов (осксинитрилов), которые получают из альдегидов или кетонов и синильной кислоты:
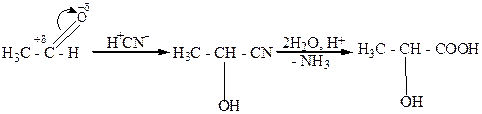
молочная кислота.
2.Щелочной гидролиз α – галогенкарбоновых кислот:
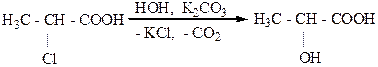
β – гидроксикислоты получают одним из таких методов:
1. Кислотно-каталитической гидратацией непредельных кислот:
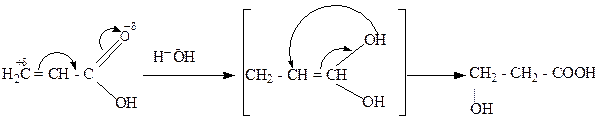 акриловая кислота β-гидроксипропионовая кислота.
акриловая кислота β-гидроксипропионовая кислота.
Присоединение воды происходит по правилам Марковникова.
2. Реакцией Реформаторского (1889 г.), который установил, что сложные эфиры α – галогенкарбоновых кислот в присутствии цинка взаимодействуют с карбонильными соединениями и образуют сложные эфиры β –гидроксикислот. Последние омылением можно легко превратить в β –гидроксикислоты. В реакции Реформаторского как промежуточные продукты сначала образуются цинкорганические соединения, которые потом реагируют с карбонильными соединениями. Так, β – гидроксимасляную кислоту можно получить с помощью этой реакции из этилового эфира бромуксусной кислоты и уксусного альдегида:
| * Растворы, которые содержат меньше, чес 33% яблочной кислоты, 20оС вращают плоскость поляризации света влево, более концентрированные – вправо. В ацетоновом растворе левое вращение левое вращение постоянно [α]Д= -5,7о
| 
| 
| 
| НО-СН2-СН2-СООН | 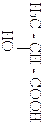
| НО – СН2 - СООН | Формула | Номенклатура и физические свойства некоторых гидроксикислот. | Таблица 1 | ||
| 2-Гидрокси- пропан-1,2,3-трио-вая | 2,3-Дигидро- ксибутандиовая | 2-Гидрокси-бутандиовая | 3-Гидрокси-пропановая | 2-Гидрокси-пропановая | Гидроксиэтановая | систематическая | Название в соответствии с номенклатурой. | ||||
| Лимонная | (±)-Винная, виноградная, (+)-Винная (-)-Винная Мезовинная | (±)-Яблочная гидроксиянтарная (+)-Яблочная (-)-Яблочная | Гидракриловая, β-гидроксипропионовая | (±)- Молочная кислота, α-гидроксипропановая, (+)- Молочная кислота, (-)- Молочная кислота | Гликолевая, гидроксиуксусная | историческая, по названию карбоновой кислоты | |||||
| 153 | 205 170 170 140 | 130 131 100 100 | 18 26 26 | 63 |
tпл оС | ||||||
| неактивная | неактивная +12,0 - 12,0 неактивная | неактивная * | неактивная | неактивная +3,82 - 3,82 | неактивная | Угол вращения градусы. | |||||
| 8,4 при 18оС | 10,2 13,0 6,0 | 3,9 | 31,1 | 1,38 | 1,48 | КD1ּ10-4 | Константа диссоциации в воде при 25оС | ||||
| 1,7 при 18оС | 4,0 6,9 1,4 | 0,9 | - | - | - | КD2ּ10-5 | |||||
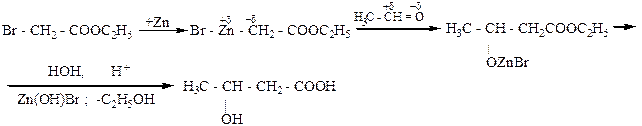 Восстановление оксокарбоновых кислот приводит к образованию гидроксикарбоновых кислот:
Восстановление оксокарбоновых кислот приводит к образованию гидроксикарбоновых кислот:
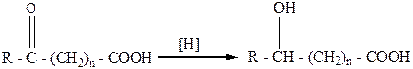 ,
,
где n =0, 1, 2, 3 и т.д., R = H, AIr, Ar.
Окисление спиртовой или альдегидной группы в карбоксильную используется обычно только для получения гидроксикислот, например:
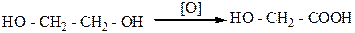
этиленгликоль гликолевая кислота
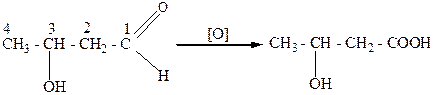
3 – гидроксибутаналь (альдоль) β – гидроксимасляная кислота.
Физические свойства.
Одноосновные гидроксикислоты с небольшой молекулярной массой это сиропообразные жидкости или твердые вещества (табл.1). Двухосновные гидроксикислоты – кристаллические вещества. Гидроксикислоты лучше растворяются в воде, чем соответствующие им карбоновые кислоты, но ограниченно растворяются в эфире и других органических растворителях. Гидроксикислоты имеют значительно более высокие температуры плавления и кипения, чем карбоновые кислоты с тем же самым количеством углеродных атомов. Многие гидрокислоты проявляют оптическую активность.
Химические свойства.
Гидрокислоты содержат две функциональные группы, и их химические свойства определяются присутствием как карбоксильной, так и гидроксильной групп. Поэтому гидроксикислоты одновременно проявляют свойства карбоновых кислот и спиртов. Причем карбоксильная и гироксильная группы могут участвовать в химических реакциях отдельно, независимо одна от другой, или обе вместе. Так, гидроксикислоты, как карбоновые кислоты, в водных растворах диссоциируют:

Однако гидроксикислоты, и в первую очередь  α – гидроксикислоты, имеют более сильные кислотные свойства, чем соответствующие им карбоновые кислоты. Например, константы диссоциации гликолевой (KD=1,48ּ10-4) и α – гидроксипропановой (КD=1,38ּ10-4) кислот приблизительно в 8 – 10 раз больше, чем соответственно уксусной (КD=1,75ּ10-5) и пропановой (КD=1,34ּ10-5) кислот. Причиной усиления кислотных свойств гидроксикислот являетя (–) I – эффект спиртовой ОН-группы, которая обуславливает смещение электронов по системе σ – связей НО ← СН2 ← С ← О ← Н.
α – гидроксикислоты, имеют более сильные кислотные свойства, чем соответствующие им карбоновые кислоты. Например, константы диссоциации гликолевой (KD=1,48ּ10-4) и α – гидроксипропановой (КD=1,38ּ10-4) кислот приблизительно в 8 – 10 раз больше, чем соответственно уксусной (КD=1,75ּ10-5) и пропановой (КD=1,34ּ10-5) кислот. Причиной усиления кислотных свойств гидроксикислот являетя (–) I – эффект спиртовой ОН-группы, которая обуславливает смещение электронов по системе σ – связей НО ← СН2 ← С ← О ← Н.
||
O
Поэтому атом водорода карбоксильной группы легче протонизируется, чем в карбоновых кислотах, и сила гидроксикислот увеличивается. Чем ближе спиртовый гидроксил расположен к карбоксильной группе, тем сильнее будет гидроксикислота, поскольку по мере удаления ОН-группы от СООН-группы влияние (–) I-эффекта постепенно “затухает,,. Поэтому β-, γ -, δ -гидроксикислоты проявляют значительно меньшую кислотность. Чем соответствующие им  α –гидроксикислоты.
α –гидроксикислоты.
1. Кислотные свойства.
Гидроксикислоты, как и карбоновые кислоты. Образуют соли, сложные эфиры, амиды и т.д. Например:
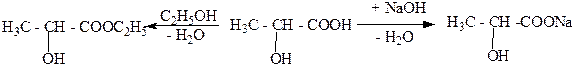
этиловый эфир молочная молочнокислый
молочной кислоты кислота натрий
(этиллактат) (лактат натрия)
2. Спиртовые свойства.
Гидроксикислоты, вступая в реакции как спирты. Образуют алкоголяты, простые эфиры, замещают гидроксил на галоген. Так, при взаимодействии гидроксикислот с щелочными металлами сначала образуются соли этих кислот. Которые далее реагируют с этими же веществами и образуют алкоголяты:
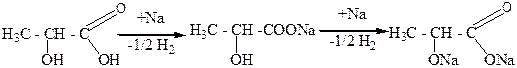
молочная Nа-соль алкоголят молочной
кислота молочной кислоты (и одновре-
кислоты менно соль)
При действии на гидроксикислоты галогенводородов спиртовый гидроксил их молекул замещается на галоген и образуются соответствующие галогенкислоты:

α –гидроксипропионовая α-хлорпропионовая
кислота ( молочная ) кислота
Пятихлористый фосфор замещает на галоген одновременно как спиртовый гидроксил, так и гидроксил карбоксила молекулы гидроксикислот и превращает их таким образом в хлорангидриды хлорорганических кислот:
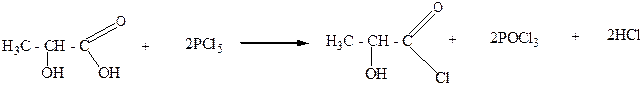 α –гидроксипропионовая хлорангидрид
α –гидроксипропионовая хлорангидрид
кислота α –хлорпропионовой
кислоты
При взаимодействии гидроксикислот с диметилсульфатом образуются простые эфиры :
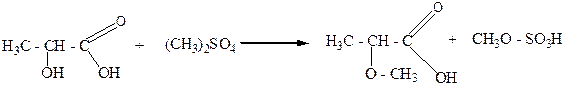
молочная α-метиловый
кислота эфир молочной
кислоты
Гидроксикислоты, как и спирты, могут окисляться. Это свойство гидроксикислот отличает их от карбоновых кислот, которые, как правило, устойчивы к окислению. Гидроксикислоты,которые содержат первичную ОН-группу, при окислении превращаются в альдегидокислоты. А гидроксикислоты с вторичной ОН-группой - в кетокислоты:
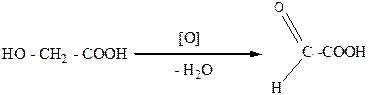
гликолевая глиоксалевая
кислота кислота
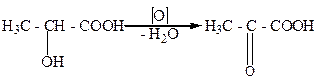
молочная пировиноградная
кислота кислота
Аналогичное окисление молочной кислоты в пировиноградную осуществляется и в живых организмах.
Специфические реакции.
Кроме реакций, которые осуществляются с участием карбоксильной и спиртовой групп, гидроксикислотам свойственны также специфические реакции, обусловленные взаимным влиянием двух функциональных групп в их молекулах. Так, α-, β -,γ-,δ-, и ε -гидроксикислоты по-разному превращаются при нагревании. Гидроксикислоты при повышенных температурах дегидратируются, но в зависимости от взаимного расположения спиртовой и карбоксильной групп дегидратация их происходит по-разному и с образованием разных продуктов реакции.
α-Гидроксикислоты при нагревании отщепляют воду межмолекулярно за счет гидроксила карбоксильной группы одной молекулы гидроксикислоты и атома водорода спиртовой группы другой молекулы гидроксикислоты. Продуктами такой дегидратации являются циклические межмолекулярные сложные эфиры, которые называют лактидами. Так, гликолевая кислота в таких условиях дает кристаллический лактид (2,5-диоксо-1,4-диоксан, или гликолид):
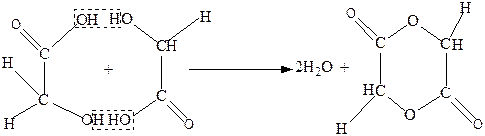
Молочная кислота при дегидратации также образует лактид ( 3,6-диметил-2,5-диоксо-1,4-диоксан):
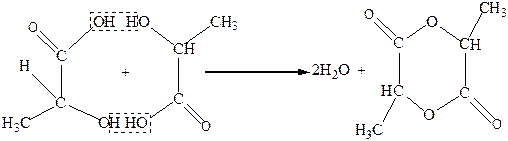
β-Гидроксикислоты при нагревании дегидратируются внутримолекулярно. Вода при этом отщепляется за счет спиртового гидроксила и весьма подвижного α-водородного атома метиленовой группы. В результате образуются α-, β - нередельные кислоты. Так, β-гидроксипропионовая кислота при этом превращается в акриловую кислоту:
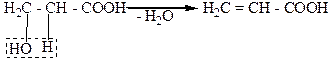
γ - и δ-гидроксикислоты при нагревании вступают во внутримолекулярную этерификацию между спиртовым гидроксилом и карбоксильной группой, образуя внутримолекулярные циклические сложные эфиры, которые называют лактонами. Так, γ-гидроксимасляная кислота при дегидратации превращается в бутиролактон (tкип.=204оС ):

Реакцию лактонизации гидроксикислот открыл в 1873 г. А.М. Зайцев. Лактоны являются биологически активными веществами и используются для синтеза кровезаменителей. Некоторые лактоны имеют приятный запах и их используют в парфюмерии.
ε -Гидроксикислоты и гидроксикислоты с еще более удаленной спиртовой группой при нагревании вступают в реакции конденсации и образуют при этом линейные полимеры.
Важнейшие представители.
Гликоливая кислота (tпл.=79оС) содержится во многих растениях, например в соке недозрелого винограда, свекле, а также сахарном тростнике. Гликоливую кислоту можно получить окислением этиленгликоля или восстановлением щавелевой кислоты:
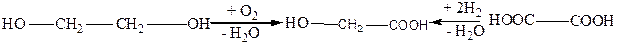
этиленгликоль гликолевая щавелевая
кислота кислота
Гликоливую кислоту применяют при дублении кож.
Молочная кислота ( tпл.=18оС) впервые была открыта в 1780 г. К. Шееле в кислом молоке ( в связи с чем и получила свое название ). Молочная кислота является продуктом жизнедеятельности молочнокислых бактерий Bacillus acidi laevolactici , которые превращают углеводы молока ( преимущественно лактозу).
Кислое молоко, кефир, ряженка, кислая капуста, моченые яблоки,соленые огурцы, помидоры и т.д. содержат в значительном количестве молочную кислоту.
В промышленности молочную кислоту получают молочнокислым брожением углеводов в щелочном водном растворе. Этот процесс описывается общей схемой:
|
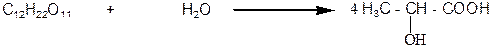
Cоли и сложные эфиры молочной кислоты, называют лактатами. Молочная кислота довольно давно используются как консервирующее средство, предохраняя от гниения, при засолке капусты, огурцов, помидоров и других овощей и фруктов, при силосовании кормов. Молочная кислота применяется также для протравного крашения тканей, в кожевенной промышленности, медицине. Так, лактаты алюминия и аммония предотвращают кровотечение десен, лактат железа назначается больным гипохромной анемией.
В организме L-(+)-молочная кислота, называемая также мясомолочной кислотой, является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мышцах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты – недостаток кислорода,что вызывает восстановление пировиноградной кислоты в молочную под действием НАDּН:
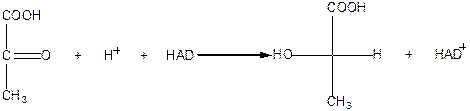
пировиноградная кислота L-(+)-молочная кислота
Во время отдыха запасы кислорода возобновляются и молочная кислота превращается в пировиноградную.
g -Гидроксимасляная кислота (ГОМК) НО-СН –СН –СН –СООН обладает наркотическим действием, практически нетоксична. Применяется в виде натриевой соли НО-СН –СН –СН –СООNa ( g -гидроксибутират натрия ) как снотворное средство, а также в анестезиологии в качестве неингаляционного наркотического средства при операциях.
Оптическая изомерия гидроксикислот.
Известно большое количество веществ, которые способны вращать плоскость поляризованного света, т.е. отклонять ее вправо ( по часовой стрелке) или влево ( против часовой стрелки). Эта способность веществ была названа оптической активностью, а сами вещества – оптически активными, или оптически деятельными. Оптически активные вещества существуют в виде оптических изомеров. Явление оптической активности особенно распространено среди органических веществ природного происхождения ( гидроксикислоты, аминокислоты, углеводы, белки, нуклеиновые кислоты, алкалоиды и др.). Это явление имеет большое биологическое значение, поскольку оно связано с асимметрией веществ, которые входят в состав живых организмов, и с явлением жизнедеятельности.
В 1848 г. французский ученый Л. Пастер установил, что оптическую активность имеют соли винной кислоты, которые существуют в виде ,,правого,, и ,,левого,, оптических изомеров , в 1860 г. он же высказал предположение, что оптическая активность является результатом пространственного асимметричного строения этих веществ. Существование оптически активных изомеров, которые отклоняют плоскость поляризованного света влево и вправо, объяснили в 1874 г. Я. Вант-Гофф и Ле Бель. Эти ученые почти одновременно независимо друг от друга опубликовали работы, в которых сформулировали стереохимическую гипотезу, которая потом стала теорией. Основные положения стереохимической теории оптической изомерии органических веществ можно сформулировать следующим образом:
1.Оптически активные вещества, как правило, содержат асимметрические атомы углерода, которые обозначаются звездочкой: С*. Асимметрическим называется атом углерода, связанный с четырьмя разными атомами или группами атомов (лигандами). Например, глицериновый альдегид и молочная кислота содержат один асимметрический атом углерода:
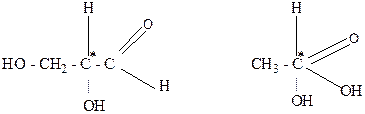
Существуют органические вещества, которые содержат два, три и большее количество асимметрических углеродных атомов. Оптическая активность может быть обусловлена присутствием в молекуле и других асимметрических атомов (азота, фосфора).
2.Четыре лиганда расположены в пространстве по вершинам тетраэдра, в центре которого находится асимметрический атом С*. Пространственная форма молекулы, которая при этом образуется, называется конфигурацией. Конфигурация тетраэдра асимметрического атома углерода всегда неправильная, поскольку лиганды, которые соединены с этим атомом, разные.
3.Молекулы, которые содержат асимметрические атомы углерода, несимметричны, потому что у них нет таких элементов, как центр и плоскость симметрии. Несимметричные молекулы нельзя совместить с их зеркальным изображением, как нельзя совместить правую и левую руки. Поэтому такие молекулы называют еще хиральными ( от греческого “хирос,, - рука). В последнее время вместо терминов “асимметрический атом,, , “асимметрическая молекула,, используют более точные термины “хиральный атом,, , “хиральная молекула,, , поскольку термин “асимметрический,, говорит об отсутствии в молекуле вообще любых элементов симметрии, что является неточным. Хиральность – это свойство молекулы (объекта) не совмещаться со своим зеркальным изображением.
4.Молекулы с асимметрическим атомом углерода существуют в виде правых (+)-форм ( конфигураций) и левых (-)-форм ( конфигураций), т.е. в виде стереоизомеров, которые отличаются разным расположением лигандов в пространтстве вокруг асимметрического атома С*. Правый и левый стереоизомеры, зеркально подобные между собой, но не совместимые (хиральные), или энантиоморфные ( от греческого “энантиос” - противоположный ). Таким образом, оптическая ( зеркальная ) изомерия – это вид пространственной изомерии, при которой стереоизомеры отличаются расположением в пространстве лигандов вокруг асимметрического атома углерода, но подобны между собой как предмет и его зеркальное изображение, т.е. являются энантиоморфными.
Право (+) – и лево (-) – вращающие изомеры имеют одинаковую структуру ( одинаковую последовательность химических связей в молекуле ), одинаковые температуры кипения и плавления, растворимость, теплопроводность и т.д. , но отличаются между собой следующими свойствами:
1) в жидком, газообразном состояниях и в растворах они отклоняют плоскость поляризованного света на одинаковый угол, но в противоположных направлениях;
2) оба изомера кристаллизуются в энантиоморфных (зеркально противоположных ) формах один относительно другого, т.е. являются оптическими антиподами;
3) право (+)- и лево (-)- вращающие изомеры отличаются реакционной способностью относительно других оптически активных реагентов;
4) эти изомеры проявляют разное физиологическое действие на живые организмы;
5) 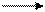 при смешении равномолекулярных количеств (+)- и (-)- изомерных форм образуются оптически неактивные ( недеятельные или инактивные ) соединения, которые называются рацематами и обозначают знаком r(i) (от французского acide racemique – виноградная кислота, на примере которой Л. Пастер наблюдал это явление): (+)-изомер+(-)-изомер r((i) (рацемат, i – инактивный).
при смешении равномолекулярных количеств (+)- и (-)- изомерных форм образуются оптически неактивные ( недеятельные или инактивные ) соединения, которые называются рацематами и обозначают знаком r(i) (от французского acide racemique – виноградная кислота, на примере которой Л. Пастер наблюдал это явление): (+)-изомер+(-)-изомер r((i) (рацемат, i – инактивный).
Рацематы отличаются от (+)- и (-) –изомеров по физическим и другим свойствам.
Оптическую активность веществ определяют с помощью поляриметра. Оптическая активность веществ характеризуется углом удельного вращения 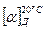 (Д – желтая линия натрия ) – устойчивой величиной угла вращения плоскости поляризации света раствором вещества при его концентрации С, которая равняется 1 г вещества в 1 мл раствора, при толщине слоя l дм :
(Д – желтая линия натрия ) – устойчивой величиной угла вращения плоскости поляризации света раствором вещества при его концентрации С, которая равняется 1 г вещества в 1 мл раствора, при толщине слоя l дм :
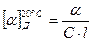
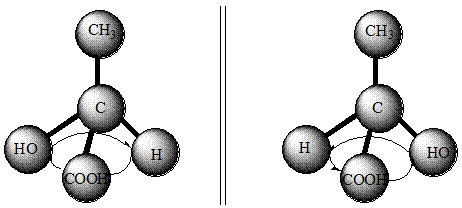
При наличии в молекуле органического вещества n асимметрических углеродных атомов количество пространственных изомеров выражается формулой 2n . В молекуле молочной кислоты содержится один асимметрический атом С*. Поэтому должны существовать (и существуют) два (21 =2) пространственных изомера этой кислоты. Действительно, еще в 1847 г. Ю. Либих выделил из мышц ( мясного экстракта ) молочную кислоту, которая отклоняет плоскость поляризации света вправо. Поэтому (+) – молочную кислоту назвали мясомолочной. Она образуется в мышцах в процессе анаэробного расщепления углеводов. Левовращающая (-) – молочная кислота была получена во время брожения сахаристых веществ под влиянием микроорганизмов Bacillus acidi laevofactici .
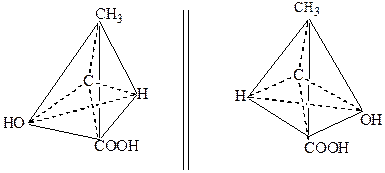
Зеркало
 Зеркало
Зеркало 
Рис.1. Модели (+) – молочной кислоты (а) и (-) - молочной кислоты (б)
Тетраэдрические и шаростержневые модели молекул этих кислот изображены на рис.1. Молочная кислота, которая образуется в процессе скисания молока, является практически неактивной и представляет собой рацемическое соединение равномолекулярных количеств (+)- и (-) – молочных кислот: (+)- +(-) – молочная кислота = r – молочная кислота. Обе (+)- и (-) – молочные кислоты имеют одинаковую температуру плавления (26оС), что отличается от температуры плавления рацемической молочной кислоты, которая плавится при 18оС.
Э.Фишер в 1891 г. предложил для удобства и простоты изображать стереоизомеры не в виде рисунков их молекул, а проекционными формулами, которые представляют собой проекции тетраэдрических моделей соответствующих моделей на плоскость. Для написания проекционных формул тетраэдр размещают относительно наблюдателя так, чтобы линия горизонтального ребра связи Н-С-ОН проходила через центр тетраэдра ( через ядро атома С* ). При проектировании связей Н-С-ОН и Н3С-С-СООН на плоскость получают проекционную формулу в виде двух линий, которые пересекаются под прямым углом. В точке пересечения этих линий находится атом С*, а на концах линий – лиганды.
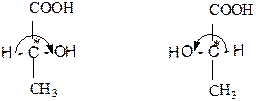
(-) – молочная кислота (+) – молочная кислота
Одно из главнейших правил применения проекционных формул состоит в том, что эти формулы можно вращать только в плоскости рисунка на 180о, но их нельзя вращать на 90о или выводить из плоскости рисунка. Поэтому проекционную формулу правой формы молочной кислоты нельзя совместить с формулой левой ее формы. В несовместимости этих двух форм можно убедиться, переходя от атома Н к группе ОН через карбоксил. Для (+) – формы такой переход осуществляется по часовой стрелке, а для (-) – формы - против часовой стрелки.
Конфигурация и знак вращения.D- и L- ряды.
В стереохимии различают понятия абсолютной конфигурации, т.е. действительного пространственного расположения лигандов в оптически активном стереоизомере, и относительной конфигурации, в которой расположение лигандов сравнивают со стандартным или так называемым опорным стереоизомером. В большинстве случаев исходят из относительных, а не абсолютных конфигураций. Для установления относительной конфигурации стереоизомера Э.фишер (1891 г.) и М.К.Розанов (1906 г.) предложили в качестве опорного соединения правовращающий глицериновый альдегид, которому произвольно была приписана конфигурация D (от латинского Dextrasyris-правовращающий). Соответственно левовращающий глицериновый альдегид (антипод) обозначают буквой L ( от латинского Leavoqyrus-левовращающий):
зеркало
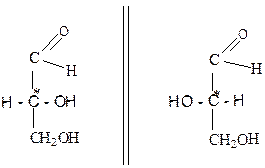
(+) - D - глицериновый альдегид (-) -L - глицериновый альдегид
Ж. Бийво в 1951 г. методом рентгеноструктурного анализа установил абсолютную конфигурацию (+) - D - глицеринового альдегида и подтвердил правильность приписанной ранее ему конфигурации. (+) - D - глицериновый альдегид является одним из простейших оксикарбоновых соединений, содержащих один асимметрический атом С*, и, как следствие этого, проявляет оптическую активность и существует в виде двух оптических изомеров. Поскольку этот альдегид содержит высокореакционные группы, то его можно, не разрушая связи с асимметрическим атомом углерода, превратить во многие другие оптически активные соединения и тем самым установить их относительную конфигурацию. Оптически активные вещества, которые были получены из (+) - D - глицеринового альдегида , отнесли к D - ряду стереоизомеров независимо от знака вращения плоскости поляризации света, а оптически активные вещества, полученные из (-) -L - глицеринового альдегида, -L - ряду стереоизомеров. Поэтому левовращающая (-) – молочная кислота относится к D - ряду, поскольку ее относительная конфигурация может быть выведена из (+) - D - глицеринового альдегида следующими последовательными превращениями:
|
|
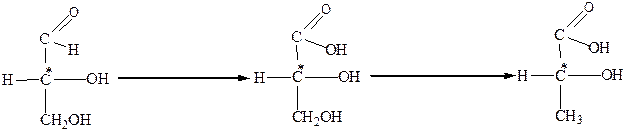
(+) - D - глицериновый (-) - D - глицериновая (-) - D - молочная
альдегид кислота кислота
Таким образом, (-) – молочная кислота относится к стереоизомерам D - ряда. Обозначения D и L указывают на конфигурацию оптически активного вещества, а знаки (+) и (-) – на направление вращения плоскости поляризации света оптически активным веществом.
Вращение плоскости поляризации света зависит в основном от природы тех атомов и групп атомов, которые входят в состав оптически активного вещества. Поэтому направление и величина вращения плоскости поляризации света не зависит от конфигурации данного соединения. Например, соли, эфиры (+) – молочной кислоты отклоняют плоскость поляризации света влево, тогда как сама (+) – молочная кислота – вправо:
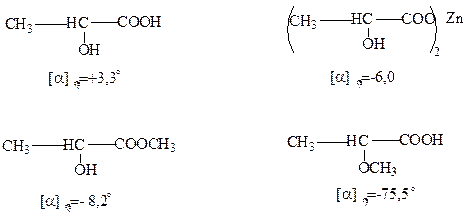
МНОГООСНОВНЫЕ И МНОГОАТОМНЫЕ ГИДРОКСИКИСЛОТЫ.
Многоосновные гидроксикислоты содержат в молекуле две, три и больше карбоксильных групп. Представителями дикарбоновых гидроксикислот являются гидроксиянтарные кислоты. Гидроксиянтарная кислота, или яблочная кислота впервые была выделена еще в 1785 г. К. Шееле из недозрелых яблок. Она широко распространена в природе и содержится в кислых яблоках, рябине, барбарисе, крыжовнике, махорке и т.д. Яблочная кислота имеет один асимметрический атом С*, проявляет оптическую активность и существует в виде (+) - D - и (-) -L - стереоизомеров ( tпл.=1000С):
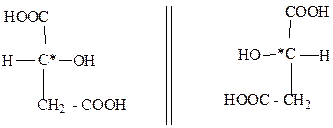
зеркало
(+) - D - яблочная кислота (-) -L - яблочная кислота
В природе распространена (-) -L - яблочная кислота. Рацемическую яблочную кислоту (tпл.=1300С) можно получить гидратацией малеиновой кислоты или действием гидроксида серебра на рацемическую бромянтарную кислоту:
|
|
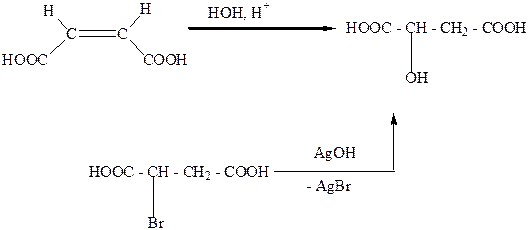
|
Соли и сложные эфиры яблочной кислоты называются малатами.
Дигидроксиянтарные кислоты называют винными. Они содержат два асимметрических атома С*:
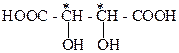
Количество оптических изомеров, как уже говорилось, вычисляют по формуле 2n, где n – число асимметрических атомов С*. Таким образом, стереоизомерных дигидроксиянтарных кислот должно быть четыре ( два изомера D - ряда, два -L - ряда). Каждая пара этих оптических изомеров должна давать по одному рацемату. В природе существуют, а также получены синтетически такие винные кислоты: (+) –винная ( I), ее антипод (-)-винная (II). Мезовинная (III) и рацемат – (±)-винная кислота, которая называется виноградной. В молекуле мезовинной кислоты оба асимметрических атома С* соединены с одинаковыми лигандами, и она имеет внутреннюю симметрию. Кроме того, в мезовинной кислоте осуществляется внутренняя компенсация вращения плоскости поляризации света противоположно построенными асимметрическими центрами с одинаковыми лигандами. Поэтому мезовинная кислота является оптически неактивной и у нее нет антипода:
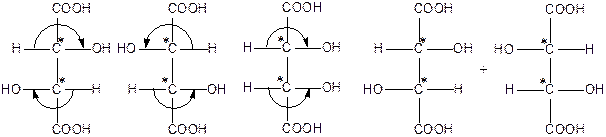
(+)-винная (-)-винная мезовинная виноградная
кислота кислота кислота кислота
Причину оптической не активности мезовинной кислоты можно объяснить следующим образом. Допустим, что расположение Н, СООН и ОН возле асимметрического атома С* в таком порядке – от атома водорода через карбоксил к гидроксилу по часовой стрелке – обуславливает вращение плоскости поляризации света вправо, а расположение этих групп в противоположном порядке (против часовой стрелки) – вращение плоскости поляризации света влево. После такого предположения легко заметить, что в мезовинной кислоте Н, СООН и ОН возле верхнего атома С* расположены по часовой стрелке и должны обуславливать правое вращение, а возле нижнего атома С* эти же самые группы расположены против часовой стрелки и должны обуславливать левое вращение. Поскольку группы возле верхнего и нижнего атомов С* одинаковые, то правое вращение верхней части молекулы должно полностью компенсироваться левым вращением левой части молекулы. В результате такая винная кислота, хотя и имеет асимметрические атомы С*, оптическую активность не проявляет.
(+)-, (-) –винные кислоты являются оптическими антиподами. Мезовинная кислота относительно этих винных кислот уже не является их антиподом. Такие стереоизомеры, которые не являются антиподами, называют диастереоизомерами. Таким образом. (-)-винная и мезовинная кислоты диастереоизомеры. Диастереоизомеры отличаются друг от друга не только оптическим вращением,но и другими физико-химическими свойствами. тогда как у антиподов физико-химические свойства одинаковые, но отличающиеся направлением вращения плоскости поляризации света ( см. табл.1). Диастереоизомеры образуют также различающиеся по свойствам производные. Так, соли диастереоизомерных винных кислот в значительной степени отличаются по растворимости в воде. Это свойство имеет важное практическое значение и используется для разделения данных диастереоизомеров.
|
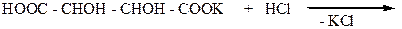
При нейтрализации этой соли гидроксидом натрия образуется смешанная калиево-натриевая соль винной кислоты – известная под названием сегнетова соль. При действии на сегнетову соль гидроксида меди (II) в щелочной среде получают жидкость Фелинга – реактив для обнаружения альдегидов. Сегнетова соль используется также в радиотехнике ( пьезокристаллы).
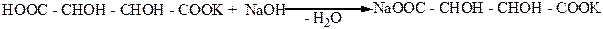
сегнетова соль
Двойная соль калия и сурьмы 2С4Н4О6К×(SbO)2×Н2О под названием “рвотного камня,, используется в медицине, а также при протравном крашении.
Винную кислоту применяют в пищевой промышленности, например при изготовлении напитков.
Антипод виннокаменной кислоты – (-)-винная кислота в природе не встречается. Ее можно получить из рацемической (±)-винной виноградной кислоты разделением кристаллов на лево-и правовращающие изомеры.
Виноградная, или (±)-винная кислота является рацематом. Она представляет собой химическое соединение равномолекулярных количеств (+)-винной кислоты и поэтому не является оптически активной. В водном растворе виноградная кислота имеет мономерную, а не удвоенную молекулярную массу. Это свидетельствует о том, что при растворении рацемат диссоциирует на (+)- и (-)-винные кислоты. Виноградную кислоту можно получить при длительном нагревании (+)- или (-)-винной кислоты, а также при окислении фумаровой кислоты водным раствором KМnO4:
|
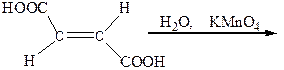
Во время кипячения (+)-, (-)-винных или виноградной кислот со щелочами, а также при окислении малеиновой кислоты водным раствором KМnO4 образуется мезовинная кислота:
|
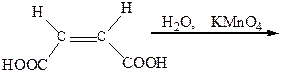
Представителем трехосновных гидрокислот является лимонная кислота (2-гидроксипропан-1,2,3-трикарбоновая кислота):
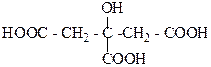
В молекуле лимонной кислоты нет асимметрического атома С*, и поэтому она является оптически неактивной. Лимонную кислоту впервые получил в 1784 г. К. Шееле из лимонного сока, в котором ее содержание 6-10%. Эта кислота найдена также в смородине, малине, крыжовнике, апельсинах, свекловичном и виноградном соках, а также в виде солей – в махорке, и в небольших количествах в молоке и крови. В промышленности лимонную кислоту получают лимонно-кислым брожением глюкозы и патоки, а также из махорки после удаления из нее никотина. Лимонная кислота используется в пищевой промышленности при изготовлении кондитерских изделий (конфет, кремов, безалкогольных напитков), в текстильной промышленности при крашении тканей и медицине.
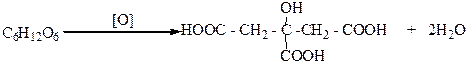
Соли лимонной кислоты называются цитратами. Лимонная кислота, как и яблочная, играет важную роль в процессах обмена веществ в живых организмах. Она принимает участие в цикле трикарбоновых кислот. Называемом циклом лимонной кислоты или циклом Кребса – универсальном этапе окислительного катаболизма ( процесс распада веществ в организме ) углеводов, липидов и других соединений в присутствии кислорода.
При дегидратации лимонной кислоты как β-гидроксикарбоновой кислоты получается цис-акотиновая кислота, которая при последующей гидратации образует изолимонную кислоту:
|
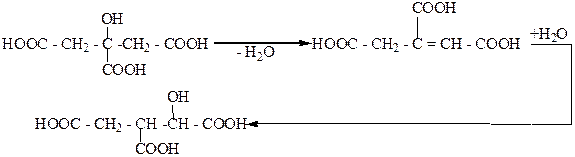
изолимонная кислота
Разложение лимонной кислоты при нагревании в присутствии серной кислоты происходит по типу разложения a-гидроксикарбоновых кислот. Образующиеся при этом муравьиная и ацетондикарбоновая кислоты в результате последующих превращений дают конечные продукты – воду, оксид углерода, диоксид углерода и ацетон.
|
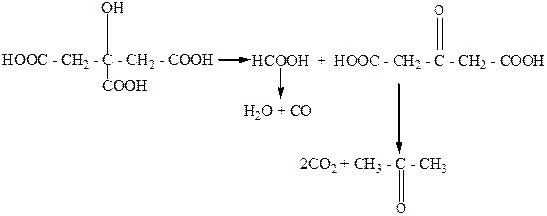
Хлоряблочные или гидроксихлорянтарные кислоты относятся к дикарбрновым гидроксикислотам с двумя асимметрическими атомами углерода:
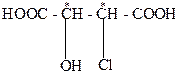
Поэтому для хлорянтарных кислот существует (22=4) оптических изомера, которые изображаются проекционными формулами I-IV:
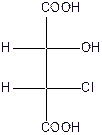
| 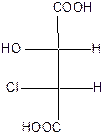
| 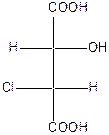
| 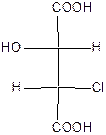
|
| эрито (-) – tпл.=173оС | эрито (+) – tпл.=173оС | трео (+) – tпл.=167оС | трео(-) – хлоряблочная кислота tпл.=167оС |
Вещества, в молекулах которых одинаковые заместители расположены у асимметрических атомов С* с одной стороны, называют эритро-изомерами. Если же эти заместители расположены с разных сторон, то их называют трео-изомерами. Кроме стереоизомеров I-IV, существуют две рацемические хлоряблочные кислоты: рацемат ( tпл.=146оС),который состоит из (+)- и (-)-эритро-форм, и рацемат (tпл.=153оС), который состоит из (+)- и (-)-трео-форм.
Смесь стереоизомерных хлоряблочных кислот можно получить присоединением хлорноватистой кислоты к малеиновой или фумаровой кислоте:
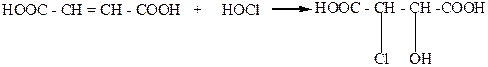
Методы расщепления рацематов на антиподы.
Классические методы разделения рацематов на антиподы разработал Л. Пастер еще в середине прошлого века. Наиболее важными из них являются следующие:
1. Метод кристаллизации.
При кристаллизации рацематов в определенном температурном режиме осуществляется самопроизвольное их расщепление на антиподы, причем их кристаллы по форме относятся друг к другу как предмет к зеркальному изображению. Они энантиоморфны .Так, Л. Пастер в 1848 г. впервые получил оптически активные изомеры из рацемата натрийаммониевой соли виноградной кислоты, которую он кристаллизовал из раствора при 27оС, а затем механически, с помощью лупы и пинцета разделил их на право- и левовращающие изомеры.
2. Биохимический метод.
Суть этого метода состоит в том, что некоторые микроорганизмы в процессе жизнедеятельности потребляют только один из оптических изомеров.Так чернильная плесень Penicillium glaucum в растворе виноградной кислоты “поедает,, (+)-винную и оставляет в растворе (-)-винную.
3. Химический метод.
Этот метод базируется на переводе рацематов в диастереоизомеры. Для этого рацемат вводят во взаимодействие с каким-нибудь оптически активным реагентом. В результате образуются два диастереоизомерных продукта. Которые отличаются растворимостью или другими свойствами, что позволяет выделить отдельно антиподы. Например, раствор рацемата, который содержит (+)- и (-)-кислоту, по этому методу обрабатывают активным (-)-основанием. Такими основаниями являются преимущественно сложные гетероциклические соединения: бруцин, цинхонин, стрихнин и др. В результате образуются диастереоизомеры: хорошо растворимая соль (+)-кислоты с (-)-основанием и труднорастворимая соль (-)-кислоты с (-)-основанием, которая выпадает в осадок. Действуя далее минеральной кислотой на полученные соли, получают (+)- и (-)-изомеры соответствующей оптически активной кислоты:
(±)-кислота
 (-)-основание
(-)-основание
 |
соль (+)-кислоты с (-)-основанием соль (-)-кислоты с (-)-основанием
 |  | ||
НCl HCl
(+)-кислота (-)-кислота
4. Хроматографический метод.
С помощью этого метода рацематы также переводят в диастереоизомеры. С этой целью раствор рацемата подвергают хроматографированию на оптически активном адсорбенте. При этом один из оптически активных изомеров образует с таким адсорбентом диастереоизомер, который прочно удерживается поверхностью адсорбента, а другой оптический изомер при этом легко вымывается с адсорбционной колонки соответствующим растворителем.
Стереохимия реакций замещения.
Большое теоретическое и практическое значение имеют реакции, которые осуществляются с участием связей асимметрического С*, в частности реакции замещения. Достаточно подробно изучены реакции нуклеофильного замещения возле асимметрического атома С* (SN- реакции). Такого типа реакции впервые наблюдал и изучал Л. Вальден в 1896 г. Он установил, что реакции возле асимметрического атома С* во многих случаях сопровождаются инверсией (обращением) знака вращения плоскости поляризации света. Это явление было названо вальденовским обращением, т. е. изменением конфигурации молекулы в процессе реакции без рацемизации ее продукта.
Изменение или сохранение знака вращения, а соответственно и конфигурации молекул, существенно зависит от условий и механизма реакции замещения. Так, (-)-хлорянтарная кислота в процессе щелочного гидролиза превращается в (+)-яблочную. А при действии на (-)-хлорянтарную кислоту влажного оксида серебра, который трудно растворяется в воде и поэтому создает в растворе низкую концентрацию ионов ОН-, образуется (-)-яблочная кислота. Таким образом, в первом случае осуществляется не только замена атома хлора на гидроксильную группу, но и перегруппирование (обращение) групп атомов, соединенных с асимметрическим атомом С*. Изменение конфигурации осуществляется также при действии PCl5 на оптические изомеры яблочной кислоты, которые при этом превращаются в хлорянтарные кислоты с противоположными знаками вращения. Вышесказанное можно изобразить такой схемой:
|
|

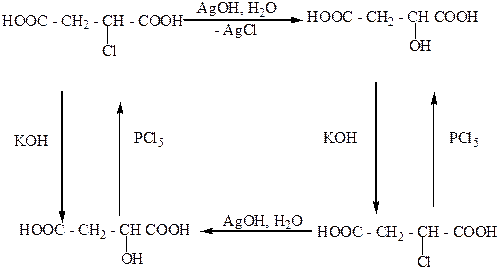
|
|
Таким образом, замена возле асимметрического атома С* галогена на гидроксильную группу во время гидролиза водным раствором щелочи и замена возле асимметрическогоС* ОН-группы на галоген под действием PCl5 осуществляется с изменением конфигурации. Установлено, что причиной такого обращения конфигурации является механизм реакции замещения. Вальденовское обращение наблюдается в реакциях нуклеофильного замещения, которые осуществляются по бимолекулярному механизму (SN2-реакции). При таком механизме замещения анион ОН- атакует асимметрический атом С8 с противоположной относительно атома галогена стороны – с “тыла,,. В результате конечным продуктом реакции является молекула с противоположной конфигурацией соответственно с противоположным знаком вращения:
|
| ||
| (-)-хлорянтарная кислота | переходное состояние | (+)-яблочная кислота |
Таким образом, если в процессе химического взаимодействия наблюдается обращение конфигурации (изменение знака вращения), то можно сделать вывод, что эта реакция вероятно протекает по SN2-механизму. В тех случаях, когда нуклеофильные реакции замещения возле асимметрического атома С* протекает по мономолекулярному механизму (SN1), осуществляется рацемизация, которая сопровождается частичным вальденовским обращением. Реакции этого типа проходят через стадию предварительной диссоциации исходного вещества с образованием карбониевого иона, который имеет плоскую конфигурацию, и анион ОН- может его атаковать как справа, так и слева. Частичное вальденовское обращение объясняется тем, что карбониевый ион не успевает приобрести полностью плоскую конфигурацию.
В тех случаях, когда молекула содержит группу, которая препятствует карбониевому иону приобрести плоскую конфигурацию, например карбоксил, реакции SN1 осуществляются с сохранением конфигурации:
|
|

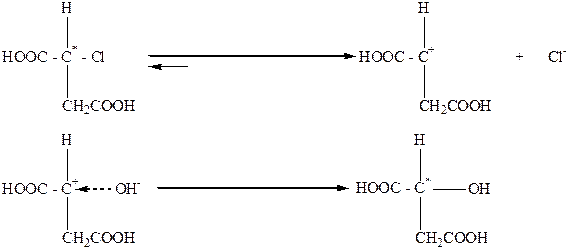
АРОМАТИЧЕСКИЕ ГИДРОКСИКИСЛОТЫ (ФЕНОЛОКИСЛОТЫ).
Из трех изомерных моногидроксибензойных кислот, относящихся к группе фенолокислот – наиболее важное значение имеет салициловая (орто-гидроксибензойная) кислота, которая встречается в некоторых растениях в виде гликозидов, например в коре вербы (от латинского слова salix- ,,верба” происходит название кислоты), в эфирных маслах цветов.



Салициловая кислота производится в промышленности методом прямого карбоксилирования фенола диоксидом углерода. Эта реакция открыта Г. Кольбе в 1859 г., усовершенствована в 1885 г. Р. Шмиттом и называется реакцией Кольбе-Шмитта. Диоксид углерода представляет собой слабый электрофильный реагент, поэтому для осуществления реакции необходимо усиление нуклеофильных свойств субстрата. В связи с этим реакцию проводят не с самим фенолом, а с его натриевой солью, так как феноксид-ион более сильный нуклеофил, чем фенол. Реакцию осуществляют в автоклавах при нагревании под давлением. Затем реакционную смесь подкисляют и выделяют салициловую кислоту. Реакция Кольбе-Шмитта осуществляется по механизму нуклеофильного замещения:
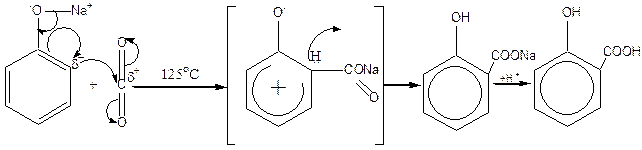
| ||||
| фенолят натрия | салициат натрия | салициловая кислота | ||
Салициловая кислота при нагревании легко декарбоксилируется с образованием фенола:

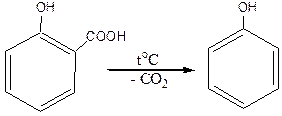
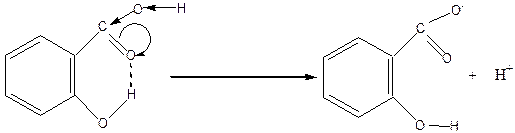
Салициловая кислота (КD=1,07×10-3) в 17 раз сильнее, чем бензойная (КD=6,5×10-5). Объясняется это образованием внутримолекулярной водородной связи между функциональными группами, что приводит к увеличению величины d+-заряда на карбоксильном атоме углерода и более сильному смещению к нему электронных пар ОН-группы карбоксила, что в свою очередь, облегчает протонизацию атома водорода карбоксила (орто-эффект):

Химические свойства салициловой кислоты определяются присутствием в ее молекуле фенольного гидроксила, крабоксильной группы и бензольнлго ядра. Как и фенол, салициловая кислота образует с раствором FeCl3 комплексное соединение с характерным фиолетовым окрашиванием (качественное обнаружение фенольной гидроксильной группы).
Салициловая кислота способна давать производные по каждой функциональной группе.
Реакции с участием карбоксильной группы.
Так, с карбонатами щелочных металлов в реакцию вступает только карбоксильная группа молекулы салициловой кислоты. При этом образуются соли – салицилаты:
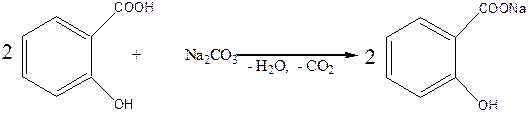

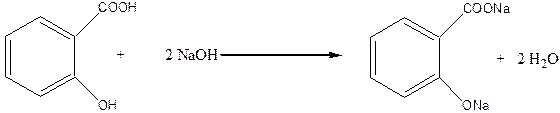
Со щелочью, в присутствии ее достаточного количества, в реакцию вступает как карбоксильная, так и гидроксильная группа салициловой кислоты:
При действии на салициловую кислоту спиртов в присутствии минеральных кислот, например, метилового спирта, образуются сложные эфиры по СООН-группе:

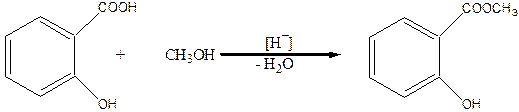
Реакции с участием фенольного гидроксила.
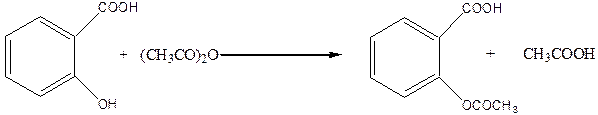
При взаимодействии салициловой кислоты с галогенангидридами или ангидридами кислот в реакцию вступает фенольный гидроксил. В случае ее взаимодействия с ангидридом или хлорангидридом уксусной кислоты образуется ацетилсалициловая кислота (аспирин, tпл.=137оС), который широко используется как жаропонижающий медицинский препарат:
С хлороксидом фосфора салициловая кислота образует хлорангидрид салициловой кислоты:
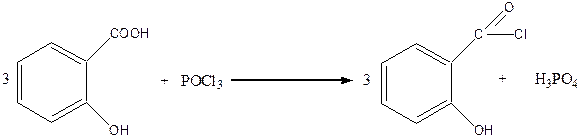
При взаимодействии этого хлорангидрида с фенолом образуется фениловый эфир салициловой кислоты (фенилсалицилат, tпл.=43оС), который под названием салол используется в медицине как дезинфицирующий препарат при кишечных заболеваниях и примечателен тем, что в кислой среде желудка не гидролизуется, а распадается только в кишечнике:
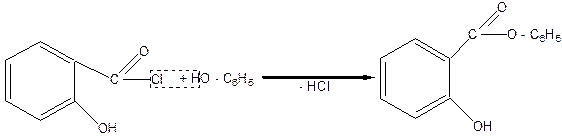
фенилсалицилат (салол)
В промышленности салол получают нагреванием салициловой кислоты и фенола в среде хлороксида фосфора.
Реакции в бензольное кольцо.
Бензольное ядро салициловой кислоты может вступать в реакции электрофильного замещения с галогенами, азотной, серной кислотами и другими электрофильными реагентами. За счет влияния ОН-группы ароматическое ядро салициловой кислоты значительно активнее к этим реакциям, чем бензольное ядро молекулы бензойной кислоты. Так, салициловая кислота легко взаимодействует с бромной водой, тогда как бензойная кислота в этих условиях бромную воду не обесцвечивает:
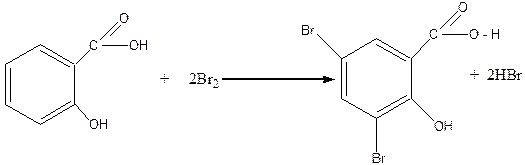
3,5-дибромсалициловая кислота
Из других производных салициловой кислоты большое значение имеет n-аминосалициловая кислота (4-амино-2-гидроксибензойная), которая сокращенно называется ПАСК. Исходным веществом для получения этой кислоты служит резорцин, который сначала действием аммиака превращает в мета-аминофенол, и потом уже карбоксилированием последнего по реакции Кольбе-Шмитта – в ПАСК:
|
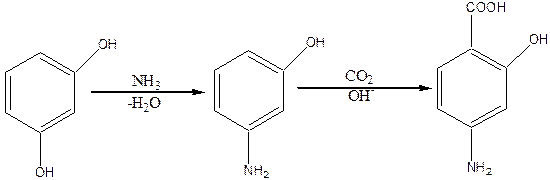
ПАСК – кристаллическое вещество (tпл.=147оС), растворяется в большинстве органических растворителей, трудно растворяется в воде, легко декарбоксилируется и превращается при этом в мета-аминофенол.
ПАСК обладает противотуберкулезным действием и применяется в виде натриевой соли. Другие изомеры этой кислоты таким действием не обладают, а м-аминосалициловая кислота, напротив, является высокотоксичным веществом.
Салициловая кислота обладает антиревматическим, жаропонижающим и антигрибковым действием, но, как сильная кислота, вызывает раздражение пищеварительного тракта и поэтому применяется только наружно. Применяется в аналитической химии, медицине, анилинокрасочной и пищевой промышленности, при консервировании фруктов.
АРОМАТИЧЕСКИЕ ТРИГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ.
Из этой группы кислот наибольшее значение имеет 3,4,5-тригидроксибензойная, или галловая кислота (tпл.=253оС). Кристаллическое вещество, хорошо растворимое в кипящей воде. В природе галловая кислота встречается как свободном, так и в связанном состояниях, обычно в растениях, содержащих дубящие вещества (чернильные орешки дуба, дубовая кора, листья чая). В промышленности галовую кислоту получают гидролизом природного дубильного вещества танина или щелочным плавлением 5-бромпротокатеховой кислоты:
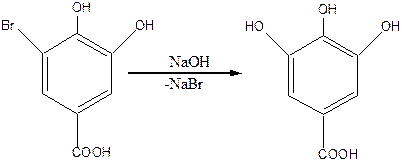
5-бромпротокатеховая кислота галловая кислота
Галловая кислота при нагревании декарбоксилируется и превращается в трехатомный фенол пирогаллол:
|
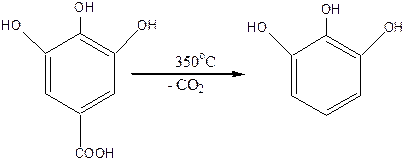
Галловая кислота проявляет сильные восстановительные свойства. Её используют как краситель для приготовления чернила, производные галловой кислоты используются при дублении шкур, в аналитической химии.
НЕПРЕДЕЛЬНЫЕ ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ.
Наиболее важной из этого класса кислот является рицинолевая кислота – мононенасыщенная, одноосновная, двухатомная гидроксикислота:
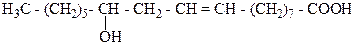
Является основной кислотой касторового масла (80 –95%). Касторовое масло широко используется в технике в качестве смазывающего вещества, а в медицине как слабительное.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ.
1. Получите молочную кислоту: 1) из пировиноградной кислоты; 2) брожением глюкозы. Что такое асимметрический атом углерода?
2. По какой формуле высчитывают количество оптических изомеров? Напишите оптические изомеры молочной кислоты.
3. Получите винную кислоту. Определите количество асимметрических атомов С*. Напишите все оптические изомеры винной кислоты, назовите их?
4. Получите яблочную кислоту, назовите её по систематической номенклатуре. Напишите её оптические изомеры. Что такое рацемат?
5. Получите двумя способами γ – гидроксимасляную кислоту. Приведите реакции по спиртовой группе.
6. Сравните кислотные свойства молочной и пропионовой кислот; α – гидроксипропионовой и β – гидроксипропионовой кислот.
7. Напишите структурную формулу лимонной кислоты, назовите её по систематической номенклатуре. Обладает ли она оптической изомерией?
8. Сравните отношение α - ,β- и γ – гидроксимаслянных кислот к нагреванию. Назовите полученные соединения.
9. Какие вещества образуются при взаимодействии молочной кислоты с уксусным ангидридом, хлористым водородом?
10. Напишите схемы реакций молочной кислоты с PCl5, этанолом (в присутствии небольшого количества Н3РО4).
11. Какие вещества образуются при взаимодействии α – гидроксимасляной кислоты с: а) NaOH; б) этанолом (в присутствии концентрированной H2SO4). Назовите образующиеся соединения.
12. Получите молочную кислоту из уксусного альдегида и HCN.
13. Напишите все структурные изомеры одноосновной гидроксикислоты общей формулы С4Н8О3. Назовите их.
14. Получите β – гидроксипропионовую кислоту, подействуйте на нее PCl5 (2 моля).
15. Какое соединение образуется при окислении молочной кислоты? Напишите схему реакции.
16. Синтезируйте салициловую кислоту несколькими способами.
17. Напишите формулу галловой кислоты. В состав, каких природных соединений она входит? Что получится при нагревании галловой кислоты?
18. Напишите формулу салициловой кислоты. Получите из нее салол.
ТЕСТЫ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ,
ПРИМЕРЫ С ОТВЕТАМИ
1. Какая из этих кислот является гидроксикислотой? Назовите её по систематической номенклатуре?
а) СН3 – СН2 – СООН
б) С6Н5 – СН2 – СООН
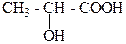 в)
в)

2.Какая из этих кислот является оптически активной? Что определяет оптическую активность?
а) СН3 – СН2 – СН2 – СООН
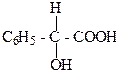
б) 
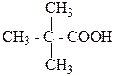
В)
3. Какая из этих кислот является оптически активной? Почему? Напишите ее формулу.
а) Салициловая кислота;
б) молочная кислота;
в) бензойная кислота.
4. Какая из этих кислот образует аспирин? Напишите ее формулу.
а) Винная кислота;
б) салициловая кислота;
в) яблочная кислота.
5. Какая из этих кислот является хорошим консервантом? Напишите ее формулу.
а) Салициловая кислота;
б) пропионовая кислота;
в) яблочная кислота.
6. Какая из этих кислот при окислении образует пировиноградную кислоту? Напишите ее формулу.
а) Молочная кислота;
б) винная кислота;
в) салициловая кислота.
1. Какая из этих кислот является оптически активной? Почему? Напишите ее формулу.
а) Лимонная кислота;
б) галловая кислота;
в) яблочная кислота.
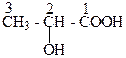 Ответы на тестовые задачи.
Ответы на тестовые задачи.
В) молочная кислота, 2-гидроксипропановая кислота
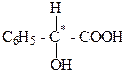 2. б) 2-гидрокси-2-фенилуксусная кислота, оптическую активность в соединении определяет наличие асимметрического атома углерода, который обозначается С*.
2. б) 2-гидрокси-2-фенилуксусная кислота, оптическую активность в соединении определяет наличие асимметрического атома углерода, который обозначается С*.
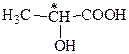
3.б) молочная кислота: 
Потому, что имеется асимметрический атом углерода.
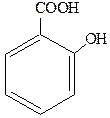
4. б) салициловая кислота:
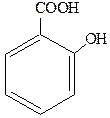
5. а) салициловая кислота:
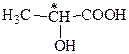 6. а) молочная кислота:
6. а) молочная кислота:
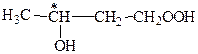 7. в) яблочная кислота:
7. в) яблочная кислота:
Содержит асимметрический атом С.
ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ.
1. Напишите формулы молочной, лимонной и масляной кислот. Какая из этих кислот является оптически активной? Почему?
2. Напишите структурные формулы яблочной, пропионовой и бензойной кислот. Какая из этих кислот обладает оптической изомерией? Почему?
3. Какая из следующих кислот входит в состав касторового масла? Назовите её?
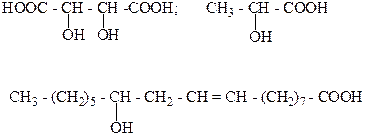
4. Какая из следующих кислот используется в пищевой промышленности? Назовите ее?
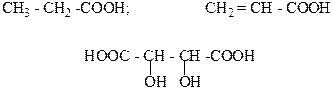
5. Какая из следующих кислот используется в пищевой промышленности как консервант? Назовите её?
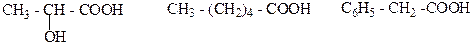
6. Какая из этих кислот является оптически активной? Почему? Напишите ее формулу.
а) Галловая кислота;
б) молочная кислота;
в) лимонная кислота.
7. Из какой кислоты можно получить аспирин? Приведите уравнение реакции.
а) Бензойная кислота;
б) салициловая кислота;
в) яблочная кислота.
8. Какая из этих кислот при нагревании образует лактозу? Напишите уравнение реакции.
а) Винная кислота;
б) яблочная кислота;
в) молочная кислота.
ЛИТЕРАТУРА
1. Петров А.А., Бальян Х.Б., Трощенко А.Г. Органическая химия. – Санкт-Петербург.: “Иван Федоров”, 2002.
2. Перекалин В.В., Зонис С.А. Органическая химия, - М.: Просвещение, 1982.
3. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. – М. Химия, 1970, т.1.
4. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. – М.: Медицина, 1985.
Для замечаний
Для замечаний
Владимир Андреевич Домбровский, проф., д.х.н.,
Валентина Стефановна Падалкина, доц., к.х.н.,
Анатолий Михайлович Евтушенко, доц., к.х.н.,
Ирина Геннадьевна Крашенинникова, доц., к.х.н.
Гидроксикарбоновые кислоты
Учебно-практическое пособие
Подписано к печати:
Тираж:
Заказ №
* Устаревшее название гидроксикислот – оксикислоты.
** Гомологический ряд предельных алифатических гидрокислот начинается с гидроксимуравьиной кислоты НО-СООН, которая называется угольной кислотой. Эта кислота неустойчива и легко распадается на СО2 и Н2О.
Дата добавления: 2020-12-12; просмотров: 952; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!