Реакции нейтрализации и оценка возможности
Самопроизвольного протекания процесса
Согласно теории электролитической диссоциации нейтрализация сильной кислоты сильным основанием в разбавленном растворе отвечает следующему уравнению:
Н+(жидкий) + ОН‾(жидкий) = Н2О(жидкая).
Используя данные табл. 6.1, рассчитайте по формуле (6.5) стандартную энтальпию реакции нейтрализации Δ r Н0 и сравните полученное значение с экспериментальной теплотой нейтрализации.
Таблица 6.1
Значения термодинамических функций
| Термодинамическая функция | Н+(жидкий) | ОН‾(жидкий) | Н2О(жидкая) |
| ΔfН0298, кДж/моль | 0 | –230,0 | –286,0 |
| S0298, Дж/(моль∙К) | 0 | –10,5 | 70,0 |
По уравнению (6.6) рассчитайте изменение энтропии в ходе реакции нейтрализации при стандартных условиях ΔrS0, а затем по уравнению (6.7) вычислите изменение энергии Гиббса ΔrG0 в стандартных изобарно-изотермических условиях и сделайте вывод о возможности самопроизвольного протекания данной реакции в неизолированных системах.
Задание 2. Определение теплоты нейтрализации сильной кислоты
Сильным основанием
Для измерения теплового эффекта реакции
H2SO4 + 2NaOH = Na2SO4 + 2H2O
используют калориметрическую установку, состоящую из двух сосудов (рис. 6.1). В наружном сосуде находится калориметрический стакан, закрытый крышкой, с термометром и мешалкой. Выделяемая в ходе реакции теплота передается реакционной смеси и самому калориметрическому стакану, в котором она находится, вызывая повышение температуры.
|
|
|
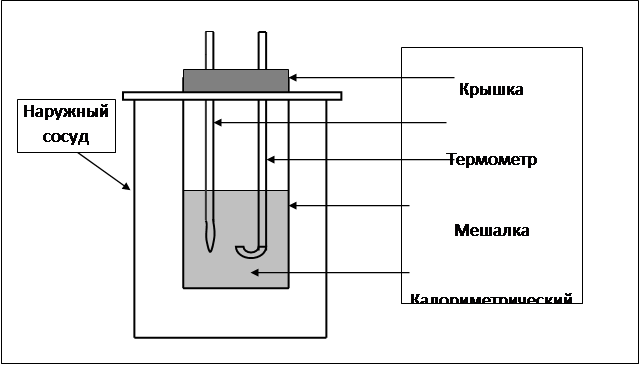
Рис. 6.1. Схема калориметрической установки
Приступая к работе, получите у преподавателя вариант задания в соответствии с табл.6.2.
Таблица 6.2
Варианты задания
| Вариант задания | 1 | 2 | 3 | 4 | 5 |
| Объем NaOH, мл | 80 | 100 | 120 | 140 | 150 |
| Объем H2SO4, мл | 80 | 100 | 120 | 140 | 150 |
Взвесьте сухой внутренний калориметрический стакан на технических весах, запишите его массу –m стакана.
Отмерьте цилиндром заданный объем раствора щелочи NaOH с молярной концентрацией 1 моль/л, вылейте его в калориметрический стакан и, перемешивая, отметьте температуру раствора – t начальная.
Затем добавьте такой же объем серной кислоты H2SO4 с молярной концентрацией 0,5 моль/л, закройте стакан крышкой, энергично перемешайте мешалкой и запишите максимальную (конечную) температуру опыта – t конечная.
По полученным данным рассчитайте:
1) разницу температурΔТ(К): ΔТ = Тконечная – Тначальная;
2) суммарную массу раствора m раствора(г), находящегося в калориметрическом стакане, приняв его плотность ρ равной 1 г/мл:
m раствора = (Vщёлочи + Vкислоты) ∙ ρ раствора;
3) теплоемкость системы сm (Дж/К) как сумму теплоемкостей раствора и стакана (теплоемкостью называют количество теплоты, необходимое для повышения температуры вещества на 1 К):
|
|
|
сm = cраствора ∙ m раствора + cстакана ∙ m стакана; (6.9)
где cраствора – удельная теплоемкость раствора, cраствора = 4,184 Дж /(г ∙К);
cстекла – удельная теплоемкость стекла, cстекла = 0,753 Дж /(г ∙ К);
m раствора – суммарная масса раствора, г;
m стакана – масса стакана, г;
4) количество теплоты q(Дж), выделившейся в калориметре:
q = cm.ΔТ; (6.10)
5) число моль полученной воды 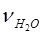 (моль), равное числу моль нейтрализованной щелочи:
(моль), равное числу моль нейтрализованной щелочи:
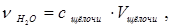
где с щёлочи – молярная концентрация раствора щелочи NaOH, моль/л;
Vщёлочи – объем раствора щёлочи NaOH, взятый для опыта, л;
6) тепловой эффект реакции нейтрализации (изменение энтальпии реакции) Δ r Н (кДж/моль):
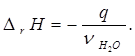 (6.11)
(6.11)
С учетом принятой в термодинамике системы знаков: знак "минус" ставят, если теплота выделяется системой, что и происходит в данном случае.
Сравните теоретическое значение теплоты нейтрализации Δ r Н0, полученное термодинамическим расчетом с использованием стандартных энтальпий образования веществ Δ f Н0298 (задание 1) и значение теплоты нейтрализации полученное экспериментально в задании 2.
|
|
|
Выводы
1. Опишите способы определения и расчета тепловых эффектов химических реакций.
2. Какие термодинамические функции служат критерием самопроизвольного протекания процессов в изолированных и неизолированных системах?
Отчёт о выполнении работы
∙ Оформление рабочих заданий (рабочая тетрадь представляется на проверку преподавателю).
∙ Выполнение задания для самостоятельной работы (проверяется преподавателем).
∙ Тестовое контрольное задание.
Дата добавления: 2020-12-12; просмотров: 178; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
