Полезная работа за цикл – это работа цикла
Термодинамические процессы
Термодинамический процесс (ТД процесс) – это изменение состояния ТД системы, характеризующееся изменением её параметров.
Графическое исследование ТД процессов проводится с помощью рабочей ( v - р) и тепловой ( s - T ) диаграмм, на которых состояние ТД системы изображается в виде точки, ТД процесс в виде кривой, представляющей последовательность состояний.
Равновесный ТД процесс – последовательность равновесных состояний.
Неравновесный ТД процесс – последовательность состояний, среди которых не все являются равновесными.
Обратимый ТД процесс – это процесс, при котором в прямом и обратном направлении рабочее тело проходит через цепь равновесных состояний , следовательно все обратимые процессы равновесные.
Условия обратимости:
Ø Бесконечно медленное протекание процесса;
Ø Нет потерь энергии
Ø Определение процесса:
Изохорный процесс
Изохорный процесс - процесс изменения состояния термодинамической системы, протекающий при постоянном объёме.
Уравнение процесса: v = const
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах
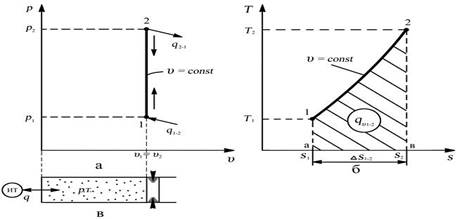
Изохора – линия изохорного процесса в рабочей диаграмме прямая параллельная оси давлений, в тепловой диаграмме логарифмическая кривая
Связь между параметрами в процессе: р1/р2 = Т1/Т2 – закон Шарля,
В изохорном процессе отношение абсолютных давлений пропорционально отношению абсолютных температур.
|
|
|
Уравнение первого закона термодинамики для процесса:
(q =Du + l, т.к. l = 0) q = D u ,
В изохорном процессе вся подведенная к телу теплота расходуется на изменение внутренней энергии.
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1)
Работа в процессе: l = 0
Теплота в процессе: (qv =D u) qv = cv (Т2 - Т1)
СХЕМА ЭНЕРГООБМЕНА
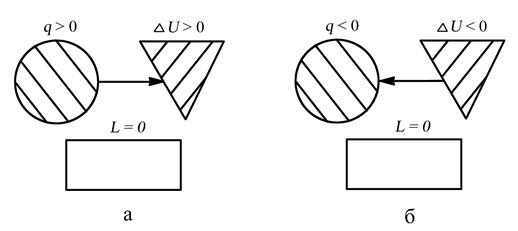
а – процесс подвода теплоты, б – процесс отвода теплоты
Изобарный процесс
Определение процесса:
Изобарный процесс - процесс изменения состояния термодинамической системы, протекающий при постоянном давлении.
Уравнение процесса: р = const
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах
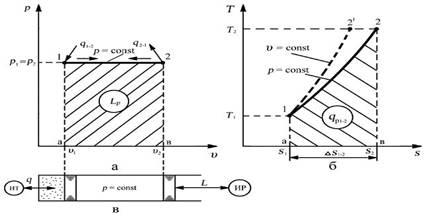
Изобара – линия изобарного процесса в рабочей диаграмме прямая параллельная оси удельных объемов, в тепловой диаграмме логарифмическая кривая (изохора располагается круче)
Связь между параметрами в процессе: v 1 / v 2 = Т1/Т2 – закон Гей-Люссака. В изобарном процессе отношение удельных объемов пропорционально отношению абсолютных температур.
Уравнение первого закона термодинамики для процесса: q = D u + l. В изобарном процессе вся подведенная к телу теплота расходуется на изменение внутренней энергии и совершении работы.
|
|
|
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1)
Работа в процессе: l = р( v 2 - v 1 ), l = R (Т2 - Т1)
l = рv2 - рv2 = R Т2 - R Т1 = R (Т2 - Т1) R = l /(Т2 - Т1 )
Теплота в процессе: q р =D u + l
qр = cv(Т2 - Т1)+ R (Т2 - Т1 ) = (cv + R) (Т2 - Т1)
q р = c р (Т2 - Т1 )
СХЕМА ЭНЕРГООБМЕНА
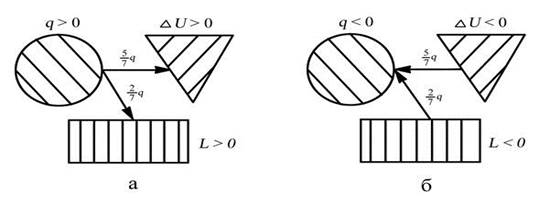
а – процесс подвода теплоты, б – процесс отвода теплоты
Изотермический процесс
Определение процесса:
Изотермический процесс - процесс изменения состояния термодинамической системы, протекающий при постоянной температуре.
Уравнение процесса: р v = со nst ( T = const , р v = RT )
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах

ИЗОТЕРМА – линия изотермического процесса, в рабочей диаграмме - равнобокая гипербола, в тепловой диаграмме прямая, параллельная оси энтропии.
Изотермический процесс – это реально очень медленно протекающий процесс, чтобы температура успевала выровняться.
Связь между параметрами в процессе:
р1 / р2 = v 2 / v 1 - закон Бойля –Мариотта,
В изотермическом процессе отношение абсолютных давлений обратно пропорционально отношению удельных объемов.
|
|
|
Уравнение первого закона термодинамики для процесса: q = l ,
(q =Du + l, т.к. Du = 0, Du = cv (Т2 - Т1)=0, Т2 = Т1
В изотермическом процессе вся подведенная к телу теплота расходуется на совершение работы.
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1), Т2 = Т1, D u =0
Работа в процессе:
l = ∫ pdv = ∫ RTdv / v ( p = RT / v )
l = RT∫dv/v = RT ln( v2 / v1 ) = RT ln( p1 / p2 )
l = pv ln( v2 / v1 ) = pv ln( p1 / p2 )
Теплота в процессе: (q =D u + l , D u =0) q = l = RT ln ( v 2 / v 1 ) = RT ln ( p 1 / p 2 )
 СХЕМА ЭНЕРГООБМЕНА
СХЕМА ЭНЕРГООБМЕНА
 | |||||||
 | |||||||
 | |||||||
 | |||||||
+ q -q
 |  | ||
+l -l
а б
а – процесс подвода теплоты, б – процесс отвода теплоты
Адиабатный процесс
Определение процесса:
Адиабатный процесс - процесс изменения состояния термодинамической системы, протекающий без теплообмена с окружающей средой.
|
|
|
Адиабатные процессы – это реальные процессы протекающие очень быстро и без учета трения.
Уравнение процесса: р vk = со nst , k - показатель адиабаты
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах
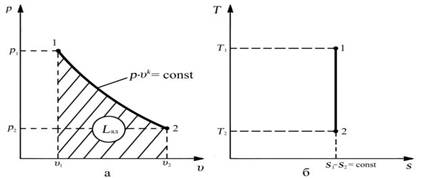
АДИАБАТА – линия адиабатного процесса, в рабочей диаграмме расположена круче изотермы, в тепловой, прямая параллельная оси температуры.
Соотношение между параметрами в процессе
р 1 / р 2 = (v2 / v1)k
T1/ T2 = (v2/ v1)k-1
T 1 / T 2 = (р1/ р2 )( k -1)/ k
Уравнение первого закона термодинамики для процесса:
q =Du + l, т.к. q = 0, D u = - l или l = - D u
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1)
Работа в процессе: l = - cv (Т2 - Т1) = cv (Т1 – Т2)
Выразим cv (изохорную теплоемкость) через k (показатель адиабаты) и R (удельную газовую постоянную) с помощью уравнения Майера, то получим формулу работы: l = R / k -1(Т1 – Т2), раскроем скобки и используем уравнение состояния газа l =( R Т1 – R Т2) /( k -1)=( pv 1 – pv 2 ) /( k -1), а если Т1 вынести за скобку и отношение температур заменить на отношение удельных объемов или отношение давлений, то получим следующие формулы работы:
l=R Т 1 (1 – T2/ T1 ) / (k-1) = pv1 (1 – T2/ T1 ) / (k-1)
l=R Т 1 (1 – (v1/ v2)k-1) / (k-1)= pv1 (1 – (v1/ v2)k-1) /( k-1)
l=R Т 1 (1 – ( р 2 / р 1 )(k-1)/k) / (k-1) = pv1 (1 – ( р 2 / р 1 )(k-1)/k) /(k-1)
Теплота в процессе: q = 0
СХЕМА ЭНЕРГООБМЕНА
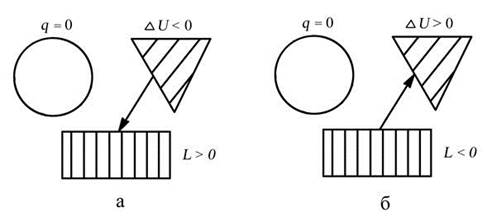
а – процесс подвода теплоты, б – процесс отвода теплоты
Второй закон термодинамики
Замкнутым процессом или циклом называется совокупность последовательных процессов, в результате совершения которых, конечное состояние газа одинаково с начальным состоянием.
Циклы осуществляются в тепловых машинах для получения полезной работы.
Для этого необходимо чтобы кривая процесса сжатия находилась ниже линии процесса расширения, то есть работа процесса сжатия был меньше работы процесса расширения.
Это возможно, когда теплота подводится в процессе расширения и отводится при сжатии.
Полезная работа за цикл – это работа цикла
l ц = l расш . - l сжат., где
l расш . - работа расширения
l сжат. - работа сжатия.
На получение этой работы
затрачивается теплота g1 - g2 Þ l ц = g 1 - g 2
Невозможно осуществление цикла теплового двигателя без отвода теплоты
ПРЯМОЙ – цикл, в котором за счет теплоты совершается работа По данному циклу работают тепловые машины.
ОБРАТНЫЙ - цикл, в котором за счет работы отводится теплота. По данному циклу работают холодильные машины.
ОБРАТИМЫЙ – цикл, состоящий из обратимых процессов. Идеальный цикл.
НЕОБРАТИМЫЙ – цикл, в котором хотя бы один процесс является необратимым. Реальные циклы.
Термический кпд используется для оценки эффективности превращения теплоты в работу в тепловом двигателе.
Определяется отношением работы цикла к подводимой теплоте:
h t = l ц / g1
h t = (g1 - g2)/g1 = 1 - g2/g1
Термический кпд показывает, какая часть подведённой теплоты используется для совершения работы.
Цикл Карно
Цикл Карно имеет наибольший кпд и является эталоном, с которым сравниваются циклы тепловых двигателей с целью определения их совершенства и экономичности.
Реальный тепловой двигатель тем совершеннее, чем ближе его кпд к кпд цикла Карно.

1-2 изотермический процесс подвода теплоты
2-3 адиабатный процесс расширения
3-4 изотермический процесс отвода теплоты
3-4 адиабатный процесс сжатия
Термический кпд цикла Карно: h t = 1 - Т2/Т1
Термический кпд зависит от температуры подвода Т1 и отвода теплоты Т2 и не зависит от природы газа.
Значение кпд тем больше, чем больше разность температур.
h t = 0 при Т2 = Т1, h t = 1 при Т2 = 0 или Т1 = ¥ , следовательно h t < 1
Идеальный цикл ТРД
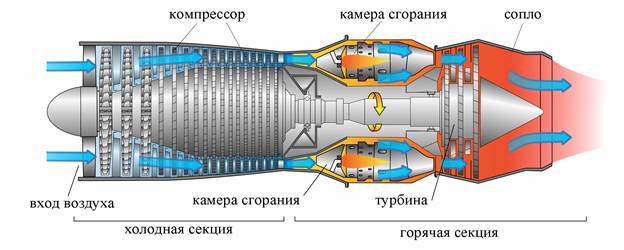
Турбореактивный двигатель (ТРД) состоит из следующих основных элементов:
· входное устройство (воздухозаборник)
· компрессор
· камера сгорания
· газовая турбина
· выходное устройство (выходное сопло).
Воздух из окружающей среды поступает во входное устройство, где предварительно сжимается. Дальнейшее сжатие происходит в компрессоре.
Сжатый воздух поступает в камеру сгорания и к нему подводится теплота, выделившаяся при сгорании топлива. Нагретый газ (смесь воздуха с продуктами сгорания топлива) поступает в газовую турбину, где расширяясь приводит её во вращение. Дальнейшее расширение газа происходит в выходном устройстве до давления окружающей среды. При выходе из двигателя горячие газы охлаждаются при смешивании с холодным воздухом окружающей среды.

Для описания процессов, протекающих в ТРД проточная часть двигателя разделена характерными сечениями:
Н – сечение невозмущенного потока на входе в двигатель,
В – сечение за входным устройством (воздухозаборником) или на входе в компрессор,
К – сечение за компрессором или на входе в камеру сгорания,
Г - сечение на выходе из камеры сгорания или на входе в турбину,
Т – сечение на выходе из турбины или на входе в сопло,
С – сечение на выходе из сопла или двигателя.
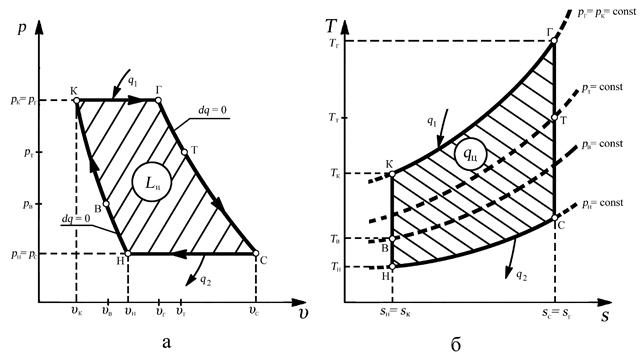
а – цикл ТРД в рабочей диаграмме б- цикл ТРД в тепловой диаграмме
Н-В-К адиабатный процесс сжатия во входном устройстве (Н-В) и в компрессоре (В-К)
К-Г изобарный процесс подвода теплоты в камере сгорания
Г-Т-С адиабатный процесс расширения в турбине (Г-Т) и в выходном устройстве (Т-С)
С-Н изобарный процесс отвода теплоты в выходном устройстве
h t = 1 – Тн / Тк
В ТРД различают три степени сжатия:
Скоростная степень сжатия p v =рв /рн
Степень сжатия воздуха в компрессоре p к =рк /рв
Суммарная степень сжатия pS = pv ×pк = рк /рн
ht = 1 – Тн / Тк = 1- , т.к. Тк / Тн =
ht = 1 – 1/
Из формулы видно, что термический КПД ТРД зависит от природы газа (показатель адиабаты k) и суммарной степени сжатия p S
• Для непрерывного превращения теплоты в
• работу необходимо наличие разности температур, при этом в работу переходит только часть теплоты, сообщенной рабочему телу.
• Закон, устанавливающий направление протекания тепловых процессов и условия превращения теплоты в работу в тепловых двигателях, называется вторым законом термодинамики.
• Преобразование теплоты в работу осуществляется в интервале температур. Отсюда ещё одна из формулировок закона: нельзя осуществить цикл теплового двигателя, в котором вся теплота, подведенная к рабочему телу, превращается в работу. Всегда работа цикла меньше подводимой теплоты.
• Другая формулировка закона:
• вечный двигатель второго рода невозможен.
• Вечный двигатель второго рода - воображаемый тепловой двигатель, который совершает работу без отвода теплоты.
Дата добавления: 2021-01-20; просмотров: 192; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
