Молекулярный механизм поверхностного натяжения.
Тема урока: Самостоятельная работа
Взаимное превращение жидкостей и газов
План занятия:
1. Изучить материалы из блока 1;
2. Рассмотреть примерные решения задач на данную тему блок 2;
Самостоятельно в тетради решить задачи из блока 3
БЛОК 1: Основные понятия, формулы, выводы.
Условия перехода из газообразной фазы в жидкую.
У идеального газа средняя потенциальная энергия взаимодействия частиц много меньше средней кинетической энергии молекул:
Е п << 3/2kТ. Для образования жидкости из газа потенциальная энергия притяжения молекул должна превышать их среднююкинетическую энергию Е п≥ 3/2kТ.
Физический смысл этого равенства состоит в том, что переход из газообразной фазы в жидкую возможен лишь при температуре, меньше некоторой критической температуры: Т <Ткр = 2Еп /3k.
Критическая температура - максимальная температура , при которойпар можно перевести в жидкость .
Критическая температура зависит от потенциальной энергии взаимодействия молекул вещества, а также от давления. С ростом внешнего давления при сжатии газа уменьшается расстояние между частицами вещества, возрастает сила притяжения между ними и соответственно средняя потенциальная энергия их взаимодействия.
Пар – вещество, находящееся в газообразном состоянии при температурениже критической .
2.Сжижение пара при его изотермическом сжатии: при изотермическом сжатии пара возрастает концентрация частиц и увеличивается давление. При дальнейшем уменьшенииобъёма пара его молекулы сближаются столь значительно, что вследствии их притяжения образуются капли жидкости . Начинается конденсация .
|
|
|
КОНДЕНСАЦИЯ - переход пара из газообразного состояния в жидкое.
Масса образовавшейся жидкости оказывается постоянной (при данном объёме)благодаря двум встречным процессам (их равновесию ): конденсации ииспарению молекул жидкости .
ИСПАРЕНИЕ - парообразование со свободной поверхности жидкости .
Когда число молекул пара, конденсирующихся за определённый промежутоквремени, становится равным числу молекул жидкости , испаряющихся с еёповерхности за это же время, между процессами конденсации и испаренияустанавливается термодинамическое равновесие.
Насыщенный пар – пар, находящийся в термодинамическом равновесиисо своей жидкостью.
3. Давление насыщенного пара при данной температуре - максимальноедавление, которое может иметь пар над жидкостью при этой температуре.
Объяснение: в закрытом сосуде в результате испарения концентрация молекул пара возрастает и достигает максимального значения, когда число молекул насыщенного пара (находящегося в равновесии с жидкостью), конденсирующихся за определённый промежуток времени, равно числу молекул жидкости, испаряющихся с ёе поверхности за это же время. Так как давление насыщенного пара пропорционально концентрации его молекул, то данной температуре давление пара большим быть не может.
|
|
|
С увеличением температуры давление насыщенного пара возрастает.
Степень влажности воздуха характеризуется относительной влажностью.
Влажность воздуха.
Абсолютная влажность – парциальное давление водяного пара (Па, мм рт.ст.)
Относительная влажность воздуха.Отношениеконцентрации водяного пара в воздухе к концентрации насыщенногопара при той же температуре:
φ = (р/р0)*100% = (ρ/ρн)*100%
р – парциальное давление водяного пара при данной температуре.
Р0 – давление насыщенного пара при той же температуре (таблица).
Точка росы – температура при которой пар становится насыщенным.
5. Кипение - парообразование, происходящее во всём объёме жидкости приопределённой температуре.
Условия, при которых начинается процесс кипения: всплывшие пузырьки начинают лопаться, когда давление насыщенного пара, которым они заполнены, будет превосходить атмосферное давление рнп>ра.
|
|
|
Температура кипения - температура , при которой давление насыщенногопара жидкости (внутри пузырьков) начинает превосходить внешнее давлениена жидкость .
Температура кипения жидкости зависит от внешнего давления и остаётсяпостоянной в процессе кипения. С увеличением внешнего давлениятемпература кипения повышается.
Физические процессы, происходящие при кипении. Пузырьки воздуха всегда, содержащиеся в жидкости, содержат газ, растворённый в жидкости. При незначительном нагревании жидкости растёт температура пара в пузырьках, возрастает его давление, увеличивается объём пузырька. Под действием силы Архимеда пузырьки начинают подниматься вверх. Попадая в верхние, ещё непрогретые слои жидкости, пузырьки охлаждаются, уменьшаются в объёме и с шумом схлопываются, не достигнув поверхности. При последующем нагревании жидкости внутрь пузырьков с их поверхности испаряются молекулы жидкости. Замкнутый объём пузырька оказывается заполненным не только воздухом, но и насыщенным паром. В достаточно нагретой жидкости давление внутри пузырька можно считать равным давлению насыщенного пара, так как с повышением температуры жидкости давление насыщенного пара растёт быстрее давления жидкости. Увеличение объёма пузырька происходит, когда давление насыщенного пара внутри него превосходит внешнее давление, которое складывается из атмосферного давления и гидростатического давления столба жидкости высотой h.
|
|
|
При увеличении температуры жидкости объём пузырька увеличивается. Когда сила Архимеда превосходит силу сцепления пузырька со стенкой сосуда и силу тяжести пузырька, пузырёк отрывается от стенки и всплывает. При подъёме в жидкости, имеющей постоянную температуру, пузырьки увеличиваются в объёме, согласно закону Бойля – Мариотта, так как давление в верхних слоях жидкости уменьшается.
Всплывая, пузырьки переносят содержащийся в них насыщенный пар к свободной поверхности жидкости.
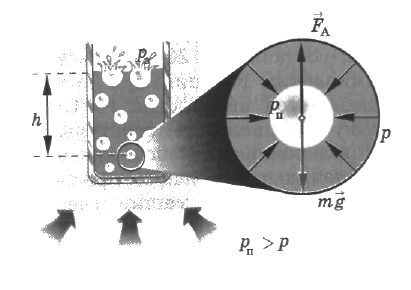 Всплывшие пузырьки начинают лопаться, когда давление насыщенного пара, которым они заполнены, будет превосходить атмосферное давление рнп>ра.
Всплывшие пузырьки начинают лопаться, когда давление насыщенного пара, которым они заполнены, будет превосходить атмосферное давление рнп>ра.
Поверхностное натяжение.
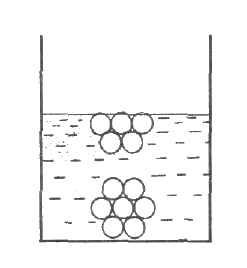
Если газ занимает весь предоставленный объём, то жидкость может занимать лишь определённую часть сосуда.
Внутри жидкости результирующая сила притяжения, действующая на молекулы со стороны других молекул = 0.
На границе с газом жидкость образует свободную поверхность . Молекулы поверхностного слоя жидкости притягиваются только молекулами внутренних слоев . Молекулы , находящиеся на поверхности , под действием результирующей силы притяжения втягиваются внутрь жидкости . На поверхности остаётся такое число молекул , при котором площадь поверхности жидкостиоказывается минимальной при данном объёме. Молекулы поверхностного слоя оказывают молекулярное давление на жидкость, стягивая её поверхность к минимуму .Этот эффект называют поверхностным натяжением .
Поверхностное натяжение- явление молекулярного давления на жидкость , вызванное притяжением молекул поверхностного слоя к молекулам внутри жидкости .
Молекулярный механизм поверхностного натяжения.
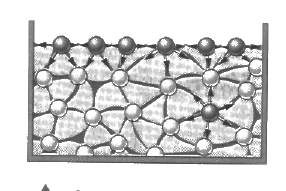
ПОВЕРХНОСТНАЯ энергия - дополнительная потенциальная энергия молекул поверхностного слоя жидкости:Е = σS, где
σ- коэффициент пропорциональности , характеризующий энергию молекул наединице площади поверхности жидкости.
СИЛА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ – сила, направленная по касательной к поверхности жидкости, перпендикулярно участку контура, ограничивающего поверхность,в сторону её сокращения: F = σL , где L- длина участка поверхностного слоя;
σ- поверхностное натяжение.
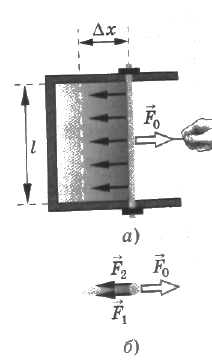 Единица поверхностного натяжения ньютон на метр ( Н/м ) .
Единица поверхностного натяжения ньютон на метр ( Н/м ) .
Силы, препятствующие растяжению мыльной плёнки (а. мыльная плёнка; б. вид сверху).
СМАЧИВАНИЕ - искривление поверхности жидкости у поверхности твёрдого тела в результате взаимодействия молекул жидкости с молекулами твёрдого тела.Жидкость смачивает поверхность, если силы притяжения между молекулами жидкости меньше сил притяжения между молекулами жидкости и твёрдого тела. Жидкость не смачивает поверхность, если силы притяжения между молекулами жидкости больше сил притяжения между молекулами жидкости и твёрдого тела.
МЕНИСК - форма поверхности жидкости вблизи стенки сосуда .
УГОЛ СМАЧИВАНИЯ - угол между плоскостью, касательной к поверхности жидкости и стенкой .
КАПИЛЛЯРНОСТЬ - явление подъёма или опускания жидкости в узких сосудах ( капиллярах ) .Высота подъёма жидкости в капилляре обратно пропорциональна его радиусуh = 2σ/ρgr, где
σ - поверхностное натяжение ;ρ -плотность жидкости;
g - ускорение свободного падения ;r - радиус капилляра.
Анализ формулы: чем меньше радиус капилляра, тем больше высота подъёма жидкости в капилляре.
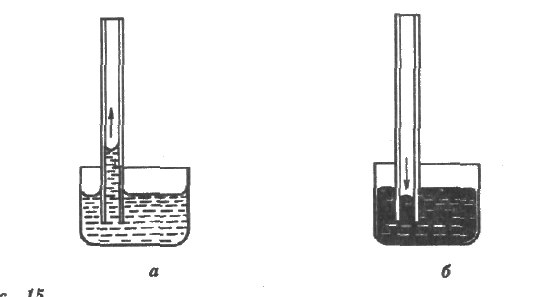
Угол смачивания: а) смачивающая жидкость (θ < 900);
б) несмачивающая жидкость (θ > 900);
Капиллярность: а) смачивающая жидкость поднимается в капилляре;
 б) несмачивающая жидкость опускается в капилляре;
б) несмачивающая жидкость опускается в капилляре;

Дата добавления: 2021-01-20; просмотров: 193; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
