Свойства коллоидных растворов.
Общая характеристика дисперсных систем.
Классификация дисперсных систем.
Современная коллоидная химия представляет собой науку, изучающую физико-химические свойства гетерогенных высокодисперсных систем и высокомолекулярных веществ в твердом состоянии и в растворах.
1. Общая характеристика дисперсных систем
Дисперсные системы – системы, состоящие из множества малых частиц, распределенных в жидкой, твердой или газообразной среде.
К дисперсным системам относят также капиллярно-пористые материалы (почвы, горные породы, спрессованные порошки, поглотители, катализаторы и т. д.). Понятие «дисперсный» происходит от латинского – раздробленный, рассеянный.
Дисперсная фаза – измельченное вещество.
Дисперсионная среда – вещество, в котором распределена дисперсная фаза.
Степень раздробленности вещества дисперсной фазы называют степенью дисперсности. Степень дисперсности математически определяют как величину, обратную размеру частицы:
D = 1/а, (1), где
D – степень дисперсности,
а – размер частицы (диаметр или длина ребра).
То есть чем меньше размер частиц, тем больше дисперсность.
Для всех дисперсных систем характерны два основных признака:
1. Высокая дисперсность.
2. Гетерогенность.
Эти признаки полностью определяют свойства и поведение дисперсных систем.
2. Классификация дисперсных систем
1. По степени дисперсности:
|
|
|
1) грубодисперсные с радиусом частиц 1м. Если дисперсная фаза состоит из твердых частиц, то система называется взвесью, или суспензией. Например, взмученная глина в воде. Если дисперсная фаза представлена капельками жидкости, то ее называют эмульсией, например, капли масла в воде, молоко. Эти системы неустойчивы;
2) коллоидно-дисперсные (золи) с размером частиц м. Частицы коллоидных систем значительно больше молекул (ионов), из которых состоит дисперсная среда, что приводит к наличию поверхности раздела между частицами и средой. Коллоидные частицы не видны в обычный микроскоп, но наблюдаются в ультрамикроскопе и в электронном микроскопе. Коллоиды относительно устойчивы, но со временем они разрушаются. При получении коллоидных систем затрачивается внешняя энергия;
3) молекулярные или ионные растворы с размером частиц менее 10-9м. В истинных растворах частицы достигают предела дисперсности. Эти растворы устойчивы, не разрушаются и получаются самопроизвольно.
2. По агрегатному состоянию фаз:
каждая из фаз может быть в трех агрегатных состояниях: газообразном, жидком, твердом. Поэтому возможно существование 8 типов дисперсных систем. Система «газ в газе» не входит в это число, так как является гомогенной.
|
|
|
Основные типы дисперсных систем
| Дисперсионная среда | Дисперсная фаза | Примеры | |
| Газ | Жидкость | Твердое тело | |
| Газ | Дисперсная система не существует | Аэрозоли (туман, облака, аэрозоли жидких лекарств, духов) | Аэрозоли (дым, пыль, песчаные бури) |
| Жидкость | Жидкие пены, газовые эмульсии | Эмульсии (сливочное масло, кремы, мази, пищеварительные соки) | Суспензии и коллоидные растворы (кисели, студни, соусы, клеи) |
| Твердое тело | Твердые пены (хлеб, пемза, силикагель, пенопласты, почва, керамика, шоколад) | Жемчуг, капиллярные системы, гели | Цветные стекла, минералы, сплавы |
Системы с газовой дисперсионной средой независимо от природы газа называют аэрозолями. Системы с жидкой дисперсионной средой – лиозоли. В зависимости от природы жидкости лиозоли делят на гидрозоли (д/с – вода) и органозоли (д/с – органическая жидкость), которые подразделяют на алкозоли, бензоли, этерозоли и т. д. Дисперсной средой в них являются соответственно спирт, бензол, эфир и т. д.
3. Посиле межмолекулярного взаимодействия между веществами дисперсной фазы и дисперсной среды:
1) лиофобные (греч.) – боящийся растворения. Для лиофобных систем характерно слабое взаимодействие вещества дисперсной фазы со средой. Такие системы термодинамически неустойчивы и требуют специальных методов стабилизации. К ним относится большинство дисперсных систем – лиозоли, аэрозоли, пены;
|
|
|
2) лиофильные (греч.) – любящий растворение. Лиофильные золи отличаются сильным взаимодействием веществ фазы и среды с образованием сольватных (гидратных) оболочек из молекул дисперсной среды. Эти системы термодинамически устойчивы. Мыла, некоторые глины самопроизвольно образуют коллоидные растворы в воде.
Тема 2. Коллоидные растворы
Методы получения.
Строение коллоидной частицы.
Свойства коллоидных растворов.
1. Методы получения
Коллоидные растворы по степени дисперсности занимают промежуточное положение между истинными растворами и грубодисперсными системами. Поэтому все методы получения коллоидных систем можно разбить на две основные группы:
1) диспергирование – дробление крупных частиц до коллоидной дисперсности;
2) конденсация – соединение атомов, ионов или молекул в более крупные частицы (агрегаты) коллоидных размеров.
К общим условиям получения коллоидных систем независимо от применяемых методов относятся следующие:
|
|
|
1) нерастворимость вещества дисперсной фазы в дисперсной среде;
2) достижение коллоидной дисперсности частиц дисперсной фазы;
3) наличие третьего компонента – стабилизатора. При соблюдении всех условий синтеза коллоидных систем любое вещество можно получить в коллоидном состоянии.
Например, хлорид натрия в бензоле можно получить в коллоидном состоянии, так как он не растворяется в бензоле.
Для очистки дисперсных систем от растворенных в них веществ Т. Грэм предложил воспользоваться способностью мелкопористых пленок (мембран) задерживать частички дисперсной фазы и свободно пропускать ионы и молекулы. Этот способ был назван диализом.
Диализ – процесс очистки коллоидных растворов, основанный на свойстве полупроницаемой мембраны пропускать примеси ионов и молекул малых размеров и задерживать коллоидные частицы.
Очищаемую дисперсную систему помещают в сосуд, изготовленный из мелкопористого материала или обладающий мелкопористым дном; сосуд омывается проточной дистиллированной водой. Согласно законам диффузии, ионы и молекулы растворенного вещества, составляющего примесь, проникают через мелкопористый материал в дистиллированную воду, а частицы дисперсной фазы остаются в дисперсной системе.
Скорость диализа мала, но ее можно значительно увеличить, воспользовавшись действием электрического поля на ионы растворенной примеси. Такой метод очистки называют электродиализом.
Эпектродиапизатор – это сосуд, разделенный мембранами на три отсека, из которых средний содержит очищаемую систему, а в крайних размещены электроды и циркулирует жидкость, однородная с веществом дисперсной среды очищаемой системы. В этих условиях при большой разности потенциалов дисперсная система быстро очищается от электролита.
В настоящее время диализ используют во многих производствах, например, при обработке многих продуктов питания и при вымачивании соленого мяса, рыбы. Электролиз применяется для очистки пищевого желатина, клея, красителей, целлюлозы и других веществ. Особенно эффективен он в медицине. Например, на принципе электродиализа основано действие аппарата «искусственная почка», позволяющего очищать кровь больного от вредных продуктов жизнедеятельности. Этим методом удаляют соли из молочной сыворотки, при этом повышается содержание в ней лактозы и белков. Такая сыворотка используется в диетическом питании.
Используя мелкопористые материалы, дисперсные системы можно концентрировать, «продавливая» дисперсную среду вместе с растворенными в ней веществами через ультрафильтры. Этот метод называется ультрафильтрация.
| Ультрафильтрация – процесс отделения дисперсной фазы от дисперсионной среды путем фильтрования коллоидных растворов через полупроницаемые мембраны. Ультрафильтрация в пищевой промышленности широко применяется для концентрирования белковых, крахмальных растворов. В производстве таких продуктов, как молоко, молочная сыворотка. Ультрафильтрационные мембраны отличаются от мелкопористых материалов тем, что каждая пора открывается в сторону низкого давления и любая малая частица проходит через мембрану, тогда как крупные остаются на ее поверхности. |

Для отделения дисперсной фазы в золях широко используют центрифуги. Методом центрифугирования производится сепарация молока, отделение мелкокристаллических осадков.
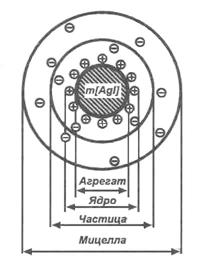
2. Строение коллоидной частицы
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь состоит из двух частей – мицелл и интермицеллярной жидкости.
Мицелла – это структурная коллоидная единица.
Интермицеллярной жидкостью называют дисперсную среду, разделяющую мицеллы.
В центре мицеллы находится кристаллическое тело, названное Песковым агрегатом. На нем, согласно правилу Панетта-Фаянса, адсорбируются ионы, способные достраивать его кристаллическую решетку. Эти ионы сообщают агрегату электрический заряд и называются потенциалоопределяющими. В результате образуется ядро мицеллы, несущее электрический заряд. Ядро создает вокруг себя электрическое поле, под действием которого к нему из раствора притягиваются противоионы, образующие вокруг ядра диффузный слой и частично входящие в состав адсорбционного слоя. Ядро совместно с адсорбционным слоем противоионов называется коллоидной частицей.
Строение мицеллы удобно представлять в виде формулы. Для золя Agl формула мицеллы пишется так, если стабилизатором будет AgN03:
 { m [ Agl ] n Ag+ (n - x ) NO3- } x NO3-,
{ m [ Agl ] n Ag+ (n - x ) NO3- } x NO3-,
| аргегат | ядро | частица | мицелла |
где
m — число молекул Agl,
n — число потенциалопределяющих ионов,
Ag+ — часть из них входит в адсорбционный, часть в диффузный слой.
3. Свойства коллоидных растворов
По своим оптическим свойствам коллоидные растворы отличаются от истинных и грубодисперсных систем.
В грубодисперсных системах размер частиц больше длины волны видимого света. Поэтому световые лучи, проходящие через грубодисперсную систему, не могут обойти частицы суспензии или эмульсии, они отражаются и преломляются на границе частиц со средой, обусловливая их мутность, видимую невооруженным глазом.
В истинных растворах светорассеяние ничтожно, так как размер частиц дисперсной фазы очень мал и нет препятствий для прохождения лучей.
Наиболее характерным оптическим свойством коллоидных растворов является опалесценция (светорассеяние). Частицы коллоидной дисперсности меньше длины полуволны света, и поэтому рассеяние света обусловлено не отражением света от поверхности частиц, а его дифракцией. Рассеяние света было исследовано Тиндалем, который обнаружил, что при освещении коллоидного раствора световым пучком его путь при наблюдении сбоку виден в виде светящегося конуса – конуса Тиндаля. Подобное явление наблюдается при прохождении луча в темном задымленном помещении (например, во время показа кино), при свете автомобильных фар в туманную погоду и в других случаях.
Для интенсивности рассеянного света Релеем в 1871 году была выведена зависимость:
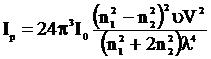 , (2.2)
, (2.2)
где
Ip – интенсивность рассеянного света,
I0 – интенсивность падающего света,
n1 и n2 – показатели преломления дисперсионной фазы и дисперсионной среды,
u – концентрация,
V – объем одной частицы,
l – длина световой волны.
Из этого уравнения видно, что интенсивность рассеянного света обратно пропорциональна 4-й степени длины волны. Если падающий свет полихроматичен, то рассеянный свет должен быть богаче короткими волнами, т. е. при боковом освещении коллоиды имеют синеватую окраску, а в проходящем красную.
На интенсивности рассеяния лучей коротковолновой части спектра основано применение ламп синего цвета для светомаскировки и красного для сигналов опасности. Красный свет виден на большое расстояние из-за малого светорассеяния. По той же причине противотуманные фары имеют оранжевую окраску.
Броуновское движение дисперсных (раздробленных) частиц обусловлено беспрерывными их соударениями с молекулами дисперсионной среды, находящимися в постоянном тепловом движении. Результирующая сила этих толчков хаотически передвигает дисперсную частицу в различных направлениях и ее сложный путь охватывает определенный объем пространства. Этот ломаный путь неопределенной конфигурации (в плоскости горизонтальной проекции на произвольно выбранную ось) может быть, тем не менее, охарактеризован средним сдвигом частицы АХ за время t (сек). Он представляет собой отрезок прямой, соединяющий начальную точку движения (t-0) с положением частицы в момент времени t.
Процесс самопроизвольного выравнивания концентраций дисперсных частиц по всему объему раствора, происходящий под влиянием Броуновского движения, называется диффузией . Скорость этого процесса характеризуется коэффициентом диффузии. Выравнивание концентраций в растворе прямо связано с различием значений химических потенциалов в разбавленных участках раствора и в участках с более высокой концентрацией.
Осмос – избирательная диффузия молекул дисперсионной среды (только растворителя) через полупроницаемую мембрану. Осмотическое давление – это давление, которое необходимо приложить к раствору по ту сторону мембраны, куда движутся молекулы растворителя, чтобы предотвратить перенос растворителя, то есть осмос. Явление осмоса применимо как к молекулярным, так и к коллоидным растворам. Величина осмотического давления определяется только частичной концентрацией (концентрацией коллоидных частиц) и не зависит от их природы и размера. Для разбавленного коллоидного раствора осмотическое давление рассчитывается по уравнению, аналогичному уравнению Вант-Гоффа.
В 1809 году профессор Московского университета описал неизвестные ранее явления, положившие начало изучению электрических свойств дисперсных систем.
Если в слой сырой глины погрузить на близком расстоянии две стеклянные трубки с водой, в которые насыпан песок, исполняющий роль пористого тела, погрузить инертные электроды и создать разность потенциалов, то уровень жидкости в трубке с положительным электродом понизится, а жидкость помутнеет. В трубке с отрицательным электродом жидкость не мутнеет и уровень ее повысится. Таким образом, при наличии разности потенциалов дисперсная фаза и дисперсионная среда двигаются в противоположных направлениях.
Электрофорез – перемещение частиц дисперсной фазы в электрическом поле.
Электроосмос – перемещение дисперсионной среды в электрическом поле.
Электрофорез используют при обезвоживании нефти, при очистке газообразных отходов производства (электрофильтры), при изготовлении гуммированных покрытий и резиновых изделий из латекса, в медицине для введения в организм лекарств в коллоидном состоянии. Электроосмос используется при опреснении воды, при очистке лекарств, дублении кожи.
В коллоидных системах различают два вида устойчивости – агрегативную и седиментационную.
Дисперсная система считается седиментационно-устойчивой, если ее дисперсные частицы не оседают, т. е. находятся в стабильном седиментационном равновесии. Если размеры частиц дисперсной фазы постоянны, то коллоидная система бесконечно долго может сохранять седиментационную устойчивость. Но частицы дисперсной фазы склонны укрупняться путем их слияния или перекристаллизации. Укрупнение частиц в дисперсной системе приводит к нарушению седиментационной устойчивости и выпадению осадка.
Агрегативная устойчивость – способность дисперсной системы сохранять неизменными размеры частиц дисперсной фазы.
Процесс слипания коллоидных частиц, образование более крупных агрегатов с последующей потерей коллоидной системой седиментационной устойчивости называется коагуляцией.
Коагуляцию можно вызвать нагреванием, замораживанием, центрифугированием, добавлением различных электролитов. Все эти воздействия, различные по своей природе, или уменьшают силы притяжения между коллоидными частицами, или увеличивают силы притяжения между ними. Так, при нагревании возрастает кинетическая энергия коллоидных частиц, увеличивается их скорость движения и силы отталкивания уже не могут препятствовать агрегированию мицелл.
Прибавление электролитов приводит к снижению электрокинетического потенциала и уменьшению сил отталкивания.
В заключение отметим, что явление, обратное коагуляции, т. е. разрушение агрегатов частиц под действием чистой дисперсионной среды или растворенных веществ, называется пептизацией.
Тема 3. Грубодисперсные системы
Пены.
Суспензии.
Эмульсии.
Аэрозоли.
1. Пены
Пены – высококонцентрированные грубодисперсные системы, в которых дисперсионная среда – жидкость, а дисперсная фаза – газ.
Пузырьки газа в пенах имеют размеры порядка миллиметров (или см); они разделены тонкими жидкими пленками, которые обладают размером коллоидных частиц. Газовые пузырьки взаимно сдавливают друг друга, а сама пена приобретает ячеистую сотовую структуру.
Пены получают методами диспергирования: интенсивное встряхивание или перемешивание жидкости, продавливание газа через жидкость. Реже используют конденсационные методы.
Пены характеризуются следующими показателями:
• пенистостью, т. е. отношением объема пены к объему жидкости в виде пленок;
• дисперсностью, т. е. средним размером пузырьков и средней толщиной жидкостных пленок;
• устойчивостью, т. е. временем существования пен. Мера устойчивости пены определяется временем ее жизни, т. е. от момента образования до самопроизвольного разрушения.
Устойчивую пену можно получить только в присутствии стабилизатора – пенообразователя, от природы и концентрации которого зависит устойчивость пены. В качестве пенообразователей используют ПАВ с длинными углеводородными радикалами, которые, адсорбируясь на поверхности вода – воздух, образуют высокосвязную структурированную пленку, препятствующую стеканию жидкости.
С повышением температуры время жизни пены уменьшается, так как снижается адсорбция пенообразователя и уменьшается вязкость. С увеличением вязкости устойчивость пены возрастает. Хорошие пенообразователи – это вещества, способные давать прочные пленки. Если эти пленки отвердевают, то получают безгранично устойчивые твердые пены (хлеб, зефир, пенопласты и т. д.).
Увеличение испарения (если пенообразователь летучий) и введение электролитов снижает время жизни пены.
Пены имеют разнообразное применение. Их используют при обогащении полезных ископаемыхфлотацией, при стирке и мойке, при тушении пожаров, в производстве высокопористых строительных и изоляционных материалов (пенобетон, пеностекло), в производстве пенопластов (поролон, пенополистирол, пенорезина, пенофенопласты и т. д.). Пены обеспечивают оптимальный технологический процесс в виноделии и в кондитерском производстве.
Очень распространены пенообразующие системы в пищевой промышленности. Такие продукты, как хлеб и ряд кондитерских изделий, имеют структуры пены, и это определяет не только их вкусовые свойства, но и пищевую ценность. Для приготовления вспененных кондитерских изделий (пастила, зефир, суфле) в качестве пенообразователей применяют белок, иногда экстракт чая, метилцеллюлозу.
Иногда образование пены приводит к нежелательным последствиям. Например, она мешает при перегонке, выпаривании, перемешивании. Большой вред наносят пены, образующиеся в сточных водах, которые содержат пенообразователи. Эти пены покрывают поверхность водоемов и закрывают доступ кислороду, что делает невозможным развитие любых организмов.
Для разрушения пен используют пеногасители, которые, будучи более активными, вытесняют пенообразователи. Таковы спирты, эфиры, силиконовые масла и т. п. Разрушению пен способствует и механическое воздействие.
2. Суспензии
Суспензии – дисперсные системы с жидкой дисперсионной средой и твердой дисперсной фазой.
Примерами суспензий являются глинистые, цементные и известковые растворы, глины, масляные густотертые краски, крахмальное молоко, протертые супы. Шоколад при температуре 3500С представляет собой суспензию частиц какао и кристалликов сахара в жидком какао-масле, помадные массы кондитерского производства и т. д.
В зависимости от относительного содержания дисперсной фазы суспензии подразделяют на три типа: разбавленные, концентрированные и высококонцентрированные. Последние обычно называют пастами.
Суспензии могут быть получены диспергационными и конденсационными способами.
Вследствие больших размеров частиц дисперсной фазы в суспензиях отсутствует броуновское движение. Явления диффузии и осмоса им также не свойственны. Прохождение света не вызывает опалесценции, а проявляется в виде мутности, так как световые лучи преломляются и отражаются частицами суспензии, а не рассеиваются.
Седиментационная устойчивость обычно очень мала вследствие крупных частиц, а для достижения агрегативной устойчивости необходимо выполнение, по крайней мере, одного из двух условий:
1. Смачиваемость поверхности частиц дисперсной фазы дисперсной средой.
2. Наличие стабилизатора. Добавляемый стабилизатор вводят в виде ионов, заряжающих и стабилизирующих частицы суспензии, или в виде ПАВ, либо в виде защитного высокомолекулярного соединения. Если стабилизатор отсутствует, то частицы смачиваются дисперсной средой и на их поверхности образуется оболочка, обладающая упругими свойствами и препятствующая соединению частиц в крупные агрегаты.
Вязкость разбавленных суспензий мало отличается от вязкости дисперсионной среды. В высококонцентрированных суспензиях (пастах) наблюдается структурирование, т. е. образование из частиц дисперсной фазы некоторой пространственной сетки, в петлях которой находится дисперсная среда. Внешне это выражается чрезмерно большой вязкостью и переходом при длительном покое в твердое состояние – гелеобразованием.
3. Эмульсии
Эмульсии – грубодисперсные системы из взаимно нерастворимых жидкостей, в которых одна из жидкостей взвешена в другой в виде капелек.
Классификация эмульсий может быть основана на различных признаках. В зависимости от полярности фаз различают два типа эмульсий.
1. Прямые (эмульсии 1-го рода), которые состоят из полярно дисперсионной среды (воды) и неполярной дисперсной фазы (масло); их обозначают условно м/в.
2. Обратные (эмульсии 2-го рода) – имеют неполярную дисперсионную среду (масло) и полярную дисперсную фазу (вода); их условно обозначают в/м.
Примером эмульсии 1-го рода может служить молоко (эмульсия жира в гидрозоле белка), а 2-го рода – природная нефть, различные медицинские мази (эмульсии воды в масле), сливочное масло.
Обычный способ получения эмульсий – диспергирование, проводимое в присутствии эмульгаторов, т. е. ПАВ, способствующих образованию эмульсий. Для диспергирования используют различные мешалки, смесители, коллоидные мельницы, ультразвук и другие средства.
Устойчивость эмульсий в случае чистых жидкостей невысока, легко происходит самопроизвольное слияние капелек дисперсной фазы с последующим расслоением жидкостей. Слияние капель эмульсии называют коалесценцией.
Вещества, стабилизирующие эмульсию, называют стабилизаторами или эмульгаторами, они адсорбируются на поверхности капель эмульсии и препятствуют их слиянию. Эмульгатор должен быть подобен той жидкости, которая образует дисперсионную среду. Например, эмульсии типа м/в стабилизируются растворимыми в воде ВМС, например, белками или мылами. Эмульгаторами при получении эмульсии в/м служат ВМС, нерастворимые в воде, но хорошо растворимые в органических растворителях (каучук, смолы), а также нерастворимые в воде мыла.
Специфическим свойством большинства эмульсий является взаимное превращение эмульсий двух типов: м/в « в/м. Этот процесс называется обращением фаз, осуществляется введением ПАВ, которое стабилизирует обратный тип эмульсии. Обращение эмульсии иногда может быть вызвано длительным механическим воздействием. Так, сбивание сливок (эмульсия типа м/в) приводит к получению масла (в/м).
Биологическое значение эмульсий очень велико. Например, сметана, майонез, молоко, яичный белок, сливочное масло, маргарин, мороженое представляют собой эмульсии. Усвоение жиров в организме осуществляется через их эмульгирование под влиянием желчи. Эмульгирование жира оказывает исключительное влияние на вкусовые свойства при производстве маргарина и, особенно при производстве мороженого. Млечный сок каучуконосных растений (латекс) также представляет эмульсию. Эмульсии находят широкое применение в промышленности; например, при омылении жиров в мыловарении, битумные эмульсии для асфальтирования, краски. Эмульсии широко применяются в медицине, фармации, косметике.
Но на практике часто требуется и разрушать эмульсии. Разрушение эмульсий (деэмульгирование) осуществляется следующими способами:
• разрушением защитных пленок сильными реагентами (кислотами);
• вытеснением эмульгатора веществом, которое лучше адсорбируется, чем эмульгатор, но не является эмульгатором;
• использованием механического воздействия: сбивание, центрифугирование, фильтрование;
• применением полей высокого напряжения;
• нагреванием, ведущим к десорбции эмульгатора.
4. Аэрозоли
Аэрозоли – дисперсные системы, дисперсионной средой которых является газ, а дисперсной фазой могут быть твердые частицы или капельки жидкости.
Обычно аэрозоли классифицируют по агрегатному состоянию дисперсной фазы. Аэрозоли с жидкой дисперсной фазой называют туманами, с твердыми частицами – дымами.
Как и любые дисперсные системы, аэрозоли образуются двумя методами – конденсационным и диспергационным.
К конденсационным относится возникновение тумана при охлаждении. При диспергационных – твердые или жидкие капельки размельчаются механическим путем, а затем распределяются в газе. Например, пневматическое распыление жидкостей осуществляется с помощью так называемых аэрозольных баллончиков при получении парфюмерно-косметических аэрозолей, аэрозолей-инсектицидов, эмалей.
По оптическим свойствам аэрозоли очень близки к растворам коллоидов. Для них также характерно светорассеяние. Однако вследствие большой разницы в показателях преломления газовой дисперсной среды и жидкой или твердой дисперсной фазы светорассеяние у аэрозолей более интенсивно и они не пропускают свет. На этом свойстве аэрозолей основано применение маскировочных дымовых завес. Благодаря сильному светорассеянию аэрозоли, находящиеся в верхних слоях атмосферы, уменьшают интенсивность солнечной радиации и влияют на климатические условия.
Специфические свойства аэрозолей – термофорез и теплопреципитация, т. е. удаление дисперсных частиц от нагретой поверхности и оседание частиц дисперсной фазы аэрозолей на холодной поверхности. Эти свойства объясняются тем, что молекулы газа движутся от более горячей поверхности с большой скоростью и «толкают» дисперсные частицы аэрозолей к более холодным участкам пространства.
Другое свойство аэрозолей – фотофорез, т. е. движение частиц по направлению к источнику светаили от источника света. Пока фотофорез не имеет обоснованного теоретического объяснения.
Аэрозоли используются в военном деле для маскировки в виде дымовых завес. В сельском хозяйстве – для борьбы с вредителями, для защиты растений от внезапных заморозков. В медицине широко используется аэрозольный метод лекарственной терапии. Различные поверхности часто окрашивают путем пневматического распыления красок и лака. Этот метод окраски более производителен, чем обычный, и обеспечивает равномерное покрытие высокого качества. Жидкое и твердое топливо эффективно сжигать в распыленном состоянии, в виде аэрозоля, так как чем лучше оно перемешивается с воздухом, тем полнее сгорает. Поэтому в камеру сгорания двигателей топливо поступает в мелкодисперсном состоянии.
Мероприятия, направленные на охрану природы и здоровья людей – это очистка воздуха от взвешенных в нем частиц перед выбросом в атмосферу и разрушение аэрозолей, образующихся в производственных помещениях.
Для разрушения аэрозолей используют: инерционное осаждение, фильтрацию, электростатическое осаждение и коагуляцию.
Инерционное осаждение проводят в устройствах, называемых циклонами. Циклон представляет собой металлический цилиндр, в котором поток воздуха с частицами пыли движется по спирали. При этом частицы отбрасываются на стенки и оседают на них. Циклоны применяют для разделения грубых аэрозолей с крупными частицами.
Мелкие частицы можно отделить на тканевых или волокнистых фильтрах. Для этого обычно применяют хлопчатобумажные, синтетические или шерстяные ткани. Действие фильтров основано на механическом задержании частиц и осаждении их на фильтре.
Частицы дисперсной фазы аэрозолей могут электризоваться вследствие трения друг от друга. Поэтому разрушать аэрозоли можно действием электрического поля в электрофильтрах.
Большое значение для сельского хозяйства имеет борьба с ливнями и градом, основанная на разрушении градовых и ливневых облаков коагуляцией. Для этого в них вводят распылением искусственные центры кристаллизации: кристаллическую углекислоту, песок и т. д. Эти центры способствуют быстрому укрупнению частиц аэрозоля путем их перекристаллизации.
Тема 4. Физико-химические изменения органических
веществ пищевых продуктов
Дата добавления: 2021-01-20; просмотров: 637; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
