ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ.
Учебная дисциплина: ОДП.04. Химия.
Группа: СВ-4-18.
Профессия:15.01.05 Сварщик (электросварочные и газосварочные работы)
Дата проведения: 14.04.20 г.
Тема № 3: АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Урок № 39
Тема урока: Аминокислоты. Изомерия, номенклатура, классификация.
Биологическая роль аминокислот.
Цели урока:
- образовательные: изучить аминокислоты, их представителей, изомерию, номенклатуру и классификацию, свойства и получение,рассмотреть биологическую роль аминокислот;
· развивающие: сформировать у студентов понятие об аминокислотах и их значении в жизни человека;
· воспитательные: воспитать творчески мыслящую личность.
Тип урока: урок получения новых знаний.
Организационная форма урока: дистанционная.
Методы обучения: объяснительно-демонстрационный, частично-поисковый.
Обеспечение урока:
· техническое: персональный компьютер;
· наглядное: Рудзитис Г.Е. Химия 10 класс: Учебник для общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман - М.: «Просвещение», 2012. - 192 с.
Ход урока.
I. Организационный момент.
Тема нашего урока сегодня:
АМИНОКИСЛОТЫ. ИЗОМЕРИЯ, НОМЕНКЛАТУРА, КЛАССИФИКАЦИЯ.
БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОКИСЛОТ.
II. Изучение нового материала.
АМИНОКИСЛОТЫ
Аминокислоты — органические бифункциональные соединения, в состав которых входят карбоксильные группы–СООН и аминогруппы -NH2.
|
|
|
Простейший представитель — аминоуксусная кислота H2N-CH2-COOH (глицин)

КЛАССИФИКАЦИЯ
Все природные аминокислоты можно разделить на следующие основные группы:
1) алифатические предельные аминокислоты (глицин, аланин)
NH2-CH(CH3)-COOH
аланин
2) серосодержащие аминокислоты (цистеин)
NH2-CH(CH2SH)-COOH
цистеин
3) аминокислоты с алифатической гидроксильной группой (серин)
NH2-CH(CH2ОH)-COOH
серин
4) ароматические аминокислоты (фенилаланин, тирозин)
NH2-CH(CH2С6Н5)-COOH
фенилаланин
5) аминокислоты с двумя карбоксильными группами (глутаминовая кислота, аспарагиновая кислота)
NH2-CH(CH2СН2COOH)-COOH
глутаминовая кислота
6) аминокислоты с двумя аминогруппами (лизин)
NH2(CH2)4-CH(NH2)-COOH
лизин
Некоторые важнейшие α-аминокислоты

Название—R
Глицин—Н
Аланин—СН3
Цистеин—CH2—SH
Серин—CH2—ОН
Фенилаланин—CH2—C6H5
Тирозин
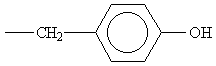
Глутаминовая кислота—CH2 —CH2 —СООН
Лизин—(CH2)4—NH2
Номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:

Часто используется также другой способ построения названий аминокислот,
|
|
|
согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого
алфавита. Пример:

Для α-аминокислот R-CH(NH2)COOH, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются
тривиальные названия.
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставкадиамино-, три группы NH2 – триамино- и т.д.

Наличие двух или трех карбоксильных групп отражается в названии суффиксом -диовая или -триовая кислота:

ПОЛУЧЕНИЕ АМИНОКИСЛОТ
1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
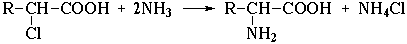
2. Присоединение аммиака к α,β-непредельным кислотам с образованием β-аминокислот (против правила Марковникова):
CH2=CH–COOH + NH3 à H2N–CH2–CH2–COOH
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот):
O2N–C6H4–COOH + 3H2 à H2N–C6H4–COOH + 2H2O
СВОЙСТВА АМИНОКИСЛОТ.
Физические свойства
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы электропроводны. При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
|
|
|
H2N-CH2-COOH ⇄ + H3N-CH2-COO -
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ.
1. Кислотно-основные свойства:
Аминокислоты — это амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Аминокислоты реагируют как с кислотами, так и с основаниями:
H2N-CH2-COOH + HCl à Cl[H3N-CH2-COOH]
H2N-CH2-COOH + NaOH à H2N-CH2-COONa + H2O
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей схемой:
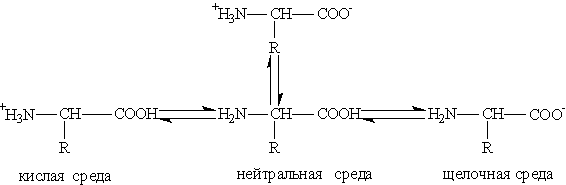
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
2. Как кислоты, аминокислоты могут реагировать с металлами, оксидами металлов, солями летучих кислот:
|
|
|
2H2N-CH2-COOH +2 Na à 2H2N-CH2-COONa + H2
2H2N-CH2-COOH + Na2O à 2H2N-CH2-COONa + H2O
H2N-CH2-COOH + NaHCO3 à H2N-CH2-COONa + CO2 ↑+ H2O
3. Аминокислоты могут реагировать со спиртами в присутствии газообразногохлороводорода, превращаясь в сложный эфир:
H2N-CH2-COOH + C2H5OH –(HCl)à H2N-CH2-COOC2H5 + H2O
4. Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов.
При взаимодействии двух α-аминокислот образуется дипептид.

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью.
Из трех молекул α-аминокислот (глицин+аланин+глицин) можно получить трипептид:
H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH
глицилаланилглицин
6. При нагревании разлагаются (декарбоксилирование):
NH2-CH2-COOH –(t)à NH2-CH3 + CO2
амин
7. Декарбоксилирование с помощью щелочи:
NH2-CH2-COOH +Ва(ОН)2 –(t)à NH2-CH3 + ВаCO3 + Н2О
амин
8. С азотистой кислотой:
NH2-CH2-COOH + HNО2 à HO-CH2-COOH + N2 + Н2О
БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОКИСЛОТ.
Существенные: Валин. Это третья разветвленная аминокислота, Один из главных компонентов в росте и синтезе тканей тела. Используется для лечения депрессии, так как действует в качестве несильного стимулирующего соединения.
Известно около 200 природных аминокислот, но только 20 из них играют важнейшую роль в жизни человека.
Эти аминокислоты называютпротеиногенными — строящими белки.
Первые аминокислоты были открыты в начале XIX века.
В пищевых продуктах наиболее распространены 22 аминокислоты.
В составе белков найдено 20 различных α-аминокислот (одна из них – пролин, является не амино- , а иминокислотой), поэтому их называют белковыми аминокислотами.
Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
Многие из них найдены только в определенных организмах, а некоторые – только в одном каком-либо организме.
Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты, животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей.
К заменимым относятся аминокислоты, присутствие которых в пище не обязательно для нормального развития организма. В случае их недостаточности они могут синтезироваться из других аминокислот или из небелковых компонентов. Аминокислоты валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан и фенилаланин являются незаменимыми почти для всех видов животных.
Аминокислоты являются наиболее важной составной частью организма. Аминокислоты – строительные блоки, из которых строятся белковые структуры, мышечные волокна. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов.
Они содержатся в ядре, протоплазме и стенках клеток, где выполняют разнообразные функции жизнедеятельности.
Аминокислоты участвуют в обмене белков и углеводов, в образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотиков и т. д.
Некоторые аминокислоты служат посредниками при передаче нервных импульсов.
С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма.
Главными продуктами разложения аминокислот являются аммиак, мочевина и мочевая кислота. Восполнение потерь аминокислот происходит в основном в результате расщепления белков.
Аминокислоты обеспечивают:
— основные метаболические процессы: синтез и утилизация витаминов, липотропное (жиромобилизующее) действие, гликолиз и гликонеогенез;
— процессы детоксикации организма, в том числе при токсикозе беременных;
— формирование иммунной системы организма;
— энергетические потребности клеток и, прежде всего, мозга, участвуют в образовании нейромедиаторов, обладают антидепрессантной активностью, улучшают память;
— метаболизм углеводов, участвуют в образовании и накоплении гликогена в мышцах и печени, обеспечивают наращивание мышечной массы, cнижают утомляемость, улучшают работоспособность;
— стимулируют работу гипофиза, увеличивают выработку гормона роста, гормонов щитовидной железы, надпочечников;
— участвуют в образовании коллагена и эластина, способствуют восстановлению кожи и костной ткани, а также заживлению ран;
— принимают участие в кроветворении, и, прежде всего, в выработке гемоглобина.
Признаки недостаточности аминокислот в организме:
При недостаточном количестве аминокислотных соединений в организме формируется дисбаланс белкового обмена, в результате которого недостающие элементы «извлекаются» из соединительной ткани, мышц, крови и печени.
В первую очередь высвобожденные белки используются для питания мозга и обеспечения работы сердечно-сосудистой системы.
Расходуя собственные аминокислоты и не получая их с пищей, организм начинает слабеть и истощаться, это приводит к сонливости, выпадению волос, анемии, потере аппетита, ухудшению состояния кожи, задержке роста и умственному развитию.
Дата добавления: 2021-01-20; просмотров: 52; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
