Трилонометрическим методом определяют:
Осадительное титрование.
Методы осаждения используют для определения неорганических соединений галогенидов, цианидов, тиоцианатов, растворимых солей серебра, среди которых NaCl, КВг, КI, AgNО3 и др. Эти методы также применяют для определения лекарственных препаратов: димедрола гидрохлорида, бромкамфоры, новокаина гидрохлорида и других.
Титриметрические методы осаждения основаны на применении при титровании реакций, сопровождающихся образованием малорастворимых соединений. Содержание определяемого компонента (вещества) рассчитывают по величине объема титранта, израсходованного на осаждение определяемого вещества.
В аналитической химии известно много реакций, которые сопровождаются образованием малорастворимых соединений. Из них в количественном анализе могут быть использованы только те, которые отвечают следующим требованиям:
1. Реакция между определяемым веществом и стандартным раствором (титрантом) должна протекать в условиях, обеспечивающих образование осадка с минимальной растворимостью (S ≤ 10 -5 моль/дм3).
2. Реакция образования осадка должна протекать быстро, количественно, стехиометрично. При этом не должно наблюдаться образование пересыщенных растворов.
3. Должна быть возможность выбора индикатора для фиксирования конечной точки титрования.
Методы осаждения дают возможность количественно определять соединения, анионы которых образуют осадки с катионами:
|
|
|
- серебра Аg+ + Вr‾ ↔ AgВr↓
- ртути Hg22+ + 2Сl‾ ↔ Hg2Cl2↓
- бария Ва2+ + SO42‾ ↔ BaSO4↓
- свинца Pb2+ + CrO42‾ ↔ PcrO4↓
- цинка 3Zn2+ + 2К+ + 2[Fe(CN)6]22‾ ↔ Zn3К2[Fе(СN)6]2↓
Наиболее широко применяют методы, основанные на реакциях осаждения малорастворимых солей серебра:
Аg+ + Наl‾ ↔ AgНаl↓
где Наl‾ являются Сl‾, Br‾, I‾ и др. Эти методы объединены в раздел титриметрического анализа, называемый аргентометрией.
В титриметрии применяют также метод меркурометрии, основанный на осаждении малорастворимых солей ртути (I), таких как Hg2C12, Hg2Br2, Hg2I2
Hg22+ + 2Сl‾ ↔ Hg2Cl2↓
АРГЕНТОМЕТРИЯ
Аргентометрическийтитриметрический метод анализа основан на применении в качестве осадителя стандартного раствора серебра нитрата:
Аg+ + Наl‾ ↔ АgНаl↓
Стандартный раствор 0,1 моль/дм3 серебра нитрата может быть приготовлен:
- как первичный стандартный раствор;
- вторичный стандартный раствор.
Для приготовления первичного стандартного 0,1 моль/дм3 раствора AgNО3 рассчитанную навеску химически чистой соли AgNО3 взвешивают на аналитических весах, переносят в мерную колбу, растворяют в дистиллированной воде, доводят объем раствора до метки, тщательно перемешивают и переносят в склянку из темного стекла.
|
|
|
При приготовлении вторичного стандартного раствора АgNО3 рассчитанную навеску соли взвешивают на технических весах, переносят через воронку в склянку из темного стекла, добавляют цилиндром необходимый объем дистиллированной воды и тщательно перемешивают.
Полученный вторичный стандартный раствор AgNО3 стандартизуют по химически чистым стандартным веществам KCl или NaCl или же по их растворам.
МЕРКУРОМЕТРИЯ
Меркурометрический метод анализа основан на образовании малорастворимых солей ртути (I) с хлоридами, бромидами, йодидами:
Hg2 2+ + 2Сl ‾↔ Hg2Cl2↓
Hg 2 2+ + 2 Br ‾ ↔ Hg 2 Br 2 ↓
Hg 2 2+ + 2 I ‾ ↔ Hg 2 I 2 ↓
Титрант метода меркурометрии - раствор 0,1 моль/дм3нитрата ртути (I)
Приготовление стандартного раствора Нg2(NО3)2.
Нитрат ртути (I) не является стандартным веществом, так как соль гигроскопична, неустойчива и содержит примеси Нg2+- ионов. Поэтому из нее готовят вторичный стандартный раствор. Рассчитанную навеску Нg2(NО3)2 ∙ 2Н2О взвешивают на технических весах, переносят в мерный стакан, прибавляют раствор 2 моль/дм3 азотной кислоты и нагревают до полного растворения навески.
|
|
|
К полученному раствору прибавляют 4-5 капель металлической ртути. Приготовленный раствор выдерживают над металлической ртутью не менее суток, что приводит к восстановлению Hg2+ -ионов:
Hg2+ + Hg → Hg22+
Только после этого полученный раствор стандартизуют по стандартным веществам - химически чистому NaCl или КСl или же по их стандартным растворам. Концентрация раствора ртути (1) нитрата не изменяется в течение нескольких месяцев.
Меркурометрический метод анализа имеет преимущества перед
аргентометрическим методом:
- галогениды ртути (I) менее растворимы, чем соответствующие соли
серебра, поэтому конечная точка титрования в методе меркурометрии фиксируется более четко;
- он исключает использование дорогостоящих солей серебра.
Основной недостаток меркурометрического метода - соли ртути (I) ядовиты! При работе с ними необходимо соблюдать правила работы с
ядовитыми веществами.
Методы комплексообразования.
В аналитической химии широко применяется метод анализа, основанный на использовании реакций, сопровождающихся образованием внутрикомплексных соединений с органическими соединениями - комплексонами.
|
|
|
Комплексонами называют аминополикарбоновые кислоты и их производные. Среди них наиболее распространены:
Комплексон II (трилон А) – этилендиаминтетрауксусная кислота (ЭДТУ)
 CH2COOH
CH2COOH
Н2С – N – CH2COOH
 |
H2C – N – CH2COOH
 CH2COOH
CH2COOH
КомплексонIII (трилонБ) – двунатриеваясольэтилендиаминтетрауксуснойкислоты (ЭДТА)
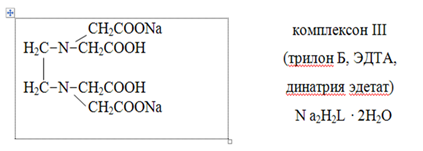
В анализе чаще используют двунатриевую соль, которая в отличие от кислоты хорошо растворима в воде и находит более широкое применение.
Комплексоны являются лигандами, которые образуют со многими катионами (Са2+, Ва2+, Sr2+, Mg2+, Со2+, Сu2+, Bi3+, Al3+, Zn2+, Fe3+, Ni2+ и др.) очень прочные, хорошо растворимые в воде, бесцветные внутрикомплексные соединения.
Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений.
В растворе трилон Б диссоциирует на ионы:

Во всех случаях независимо от степени окисления катионов они реагируют с комплексоном в соотношении 1: 1.
Схематически реакции комплексообразования с катионами, имеющими различные степени окисления, можно представить следующими уравнениями:
H2L2‾ + Ме2+ ↔ [MeL]2‾ + 2Н+
H2L2‾+ Ме3+ ↔ [MeL] ‾ + 2Н+
H2L2‾ + Ме4+ ↔ [MeL] ‾ + 2Н+
В качестве титранта используют растворы 0,1; 0,05 или 0,02 моль/дм3 трилона Б.
Приготовление стандартного раствора трилона Б.
Динатриевая соль этилендиаминтетрауксусной кислоты (трилон Б, комплексон ІІІ) гигроскопична, поэтому из нее готовят вторичный стандартный раствор, а затем определяют его точную концентрацию по стандартным веществам - химически чистыми Zn, ZnO, СаСО3. Для этого точную навеску стандартного вещества растворяют в химически чистой серной или хлороводородной кислотах, полученный раствор нейтрализуют раствором NaOH или аммиака, прибавляют аммиачную буферную смесь и титруют раствором трилона Б. Стандартизуют приготовленный раствор трилона Б так же - по стандартным растворам ZnSО4 или MgSО4.
Условия комплексонометрическоro титрования:
1. Реакции комплексообразования должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки эквивалентности определяемые катионы были практически полностью связаны в комплекс.
2. Комплексонометрическое титрование следует проводить при определенном значении рН (рН < 10), так как в щелочной среде могут образовываться осадки гидроксидов определяемых катионов или их основные соли.
Трилонометрическим методом определяют:
а) общую жесткость воды;
б) практически все катионы щелочноземельных и тяжелых металлов (Cu2+, Со2+, Pb2+, Ni2+, Zn2+, Fе3+, Ва2+, Сг3+,Ca2+, Mg2+ и т. д.);
в) в фармацевтическом анализе - лекарственные формы, содержащие катионы щелочноземельных металлов.
Дата добавления: 2021-01-20; просмотров: 386; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
