Основное уравнение молекулярно-кинетической теории (МКТ) газов. Температура в МКТ
Лекция № 5. свойства газов. газовые законы
Структура газов, жидкостей и твердых тел и молекулярное движение в них
Газообразные, твердые и жидкие тела имеют разную структуру и неодинаковый характер молекулярного движения в них. Причина этого состоит в том, что структура вещества и характер молекулярного движения в нем определяются силами межмолекулярного взаимодействия, а силы взаимодействия быстро убывают с увеличением межмолекулярных расстояний.
В газах среднее расстояние между молекулами во много раз больше размеров самих молекул. Межмолекулярные силы сцепления на таких расстояниях слабы, и молекулы движутся почти независимо друг от друга, меняя направление движения при столкновениях между собой или со стенками сосуда.
В кристаллах расстояния между молекулами значительно меньше, чем в газах, а межмолекулярные взаимодействия сильнее. Поэтому характер молекулярного движения в кристаллах совершенно иной. В кристаллах молекулы, атомы или ионы (в зависимости от природы вещества) переходят с места на место сравнительно редко, колеблясь большую часть времени около некоторых неподвижных положений равновесия, или узлов. Эти узлы распределены в пространстве тем или иным закономерным образом, который определяется характером межмолекулярных взаимодействий.
Повышение температуры кристалла приводит к увеличению амплитуды колебаний составляющих его частиц, к увеличению расстояния между узлами (расширение тела при нагревании) и, следовательно, к ослаблению сил сцепления. От этого случаи оставления частицами своего узла становятся все более частыми, и при некоторой температуре, называемой точкой плавления, исчезает упорядоченность в размещении центров колебаний, решетка разрушается и кристалл плавится.
|
|
|
Газы и кристаллы резко отличаются друг от друга своей структурой и характером молекулярного движения. Для газов типична хаотичность, а для кристаллов — упорядоченность. В этом смысле газы и кристаллы противоположны друг другу.
В жидкостях же сочетаются свойства, типичные для газов, со свойствами, типичными для кристаллов.
Молекулы жидкости не так прочно связаны друг с другом, как молекулы кристалла, но и не так свободны, как молекулы газов; молекулы жидкости колеблются, подобно молекулам кристаллов, но положения равновесия, около которых совершаются колебания, не остаются неподвижными, как в кристаллах, а непрерывно меняются.
Таковы в самых общих чертах особенности молекулярного движения в различных агрегатных состояниях вещества.
Идеальный газ. Основное уравнение состояния идеального газа.
|
|
|
Идеальным газом в термодинамике называется газ, подчиняющийся законам Бойля-Мариотта, Гей-Люссака и Шарля.
Для определенного количества вещества (числа молей):
• при постоянной температуре pV = const (закон Бойля-Мариотта);
• при постоянном давлении 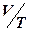 = const (закон Гей-Люссака);
= const (закон Гей-Люссака);
• при постоянном объеме  = const (закон Шарля).
= const (закон Шарля).
Здесь Т — абсолютная температура. Эти законы были установлены экспериментально.
Все три газовых закона являются следствием уравнения состояния идеального газа (уравнения Менделеева-Клапейрона):
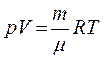
где m — масса газа; m — его молярная масса; R называется универсальной газовой постоянной
Плотность газа определяется выражением:

Парциальным давлением некоторого газа в смеси называется такое давление, которое создавал бы этот газ, если бы все остальные газы отсутствовали.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений компонентов:
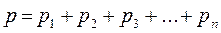
Закон Авогадро: при одинаковых значениях давления и температуры в равных объемах разных идеальных газов содержится одинаковое количество молекул. В одном моле любого вещества содержится число молекул, равное 6,02×1023 моль-1.
|
|
|
Изопроцессы
Изопроцесс — термодинамический процесс, в котором один из термодинамических параметров не изменяется:
• изохорический процесс V = const;
• изобарический процесс р = const;
• изотермический процесс Т = const.
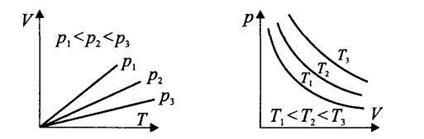
На рисунках изображены изохоры идеального газа в рТ-координатах, изобары идеального газа в КТ-координатах и изотермы идеального газа в pV-координатах
|
Рис. Графики изопроцессов |
Основное уравнение молекулярно-кинетической теории (МКТ) газов. Температура в МКТ
Основные положения молекулярно-кинетической теории газов.
В соответствие с молекулярно-кинетическими представлениями:
- все тела состоят из молекул (атомов); атомы одного вида тождественны друг другу;
- молекулы находятся в хаотическом тепловом движении;
- между молекулами существуют силы взаимодействия, зависящие от агрегатного состояния вещества.
Эти представления подтверждаются опытными данными:
- явление диффузии и растворения, теплопроводность;
- броуновское движение;
- упругость газов (давление на стенки сосуда);
наблюдение наиболее крупных молекул на экране электронного микроскопа.
Наиболее успешно молекулярно-кинетическая теория объясняет свойства газов (кинетическая теория газов). Важным пунктом этой теории является представление об идеальном газе. В модели идеального газа атомы и молекулы рассматриваются как идеально твердые шарики, взаимодействие между которыми сводится к абсолютно упругому удару. К такой модели газа можно применить законы сохранения импульса и механической энергии при описании движения отдельной частицы (атома).
|
|
|
Поступательное движение частиц идеального газа в основном хаотическое: многократно сталкиваясь друг с другом и со стенками, они беспорядочно изменяют направление и величины своих скоростей.
Основное уравнение МКТ связывает давление (макроскопический параметр) газа на стенки сосуда с его концентрацией, массой молекул и средней квадратичной скоростью их движения (микроскопическими параметрами)
 .
.
где п — концентрация частиц газа; т — масса частицы; ( 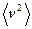 — средний квадрат скорости частиц;
— средний квадрат скорости частиц; 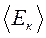 — их средняя кинетическая энергия.
— их средняя кинетическая энергия.
Основное уравнение состояния идеального газа можно преобразовать к виду:
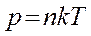 ,
,
откуда
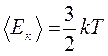
В МКТ температура является мерой средней кинетической энергии движения частиц макросистемы.
Теорема Максвелла о равнораспределении средней кинетической энергии молекул по степеням свободы гласит, что в состоянии термодинамического равновесия на каждую степень свободы частицы приходится кинетическая энергия, среднее значение которой составляет для частиц, совершающей только поступательное движение
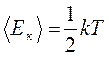
Здесь k называется постоянной Больцмана.
Распределение Больцмана
Распределение Больцмана описывает зависимость концентрации частиц идеального газа, находящегося в потенциальном поле W , от координат:

где п0 — концентрация частиц в точке (или на поверхности), в которой Wp = 0.
В поле силы тяжести (например, в поле земного тяготения):
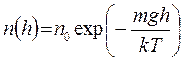
где h — высота от поверхности тяготеющего тела (Земли); n 0 — концентрация частиц у поверхности; т — масса частиц.
Распределение молекул разных сортов в земной атмосфере различно благодаря различию их масс: наиболее тяжелые молекулы сильнее концентрируются вблизи поверхности.
Реальные газы
Модель идеального газа достаточно точно описывает лишь часть экспериментальных данных. Более точно описывают поведение газов модели реальных газов. В этих моделях учитываются в качестве поправок и конечный объем частиц газа, и взаимодействие между ними.
 Уравнение реального газа Ван-дер-Ваалъса для одного моля газа:
Уравнение реального газа Ван-дер-Ваалъса для одного моля газа:

Постоянные а и b характеризуют конкретное вещество и определяются экспериментально. Постоянная а описывает отличие давления газа на стенку при учете взаимодействия между частицами газа от давления идеального газа. Постоянная b характеризует объем, занимаемый собственно частицами газа.
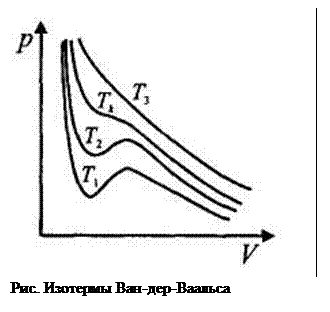
Изотермы газа Ван-дер-Ваальса изображены на рис. При высоких зна  чениях температуры (Т3) изотермы реального газа близки к изотермам идеального газа. Тк называется критической температу рой. При Т = Тк изотерма реального газа имеет лишь точку перегиба. Изотермы реального газа при Т <Тк (например, Т1, или Т2) описывают как газообразное, так и жидкое состояние. При Т > Tk нет таких давлений, при которых существовала бы жидкая фаза.
чениях температуры (Т3) изотермы реального газа близки к изотермам идеального газа. Тк называется критической температу рой. При Т = Тк изотерма реального газа имеет лишь точку перегиба. Изотермы реального газа при Т <Тк (например, Т1, или Т2) описывают как газообразное, так и жидкое состояние. При Т > Tk нет таких давлений, при которых существовала бы жидкая фаза.
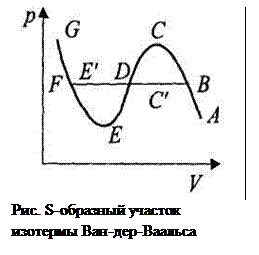 При больших значениях объема (на участке АВ) реальный газ по своему поведению близок к идеальному На участке BF (рис. ) и BC ' DE ' F(рис. )сосуществуют в динамическом равновесии жидкая и газообразная фазы. На участке GF изотерма описывает жидкость. Экспериментальная изотерма ABFG отличается от изотермы Ван-дер-Ваальса прямолинейным участком. Участок FE описывает перегретую (неустойчивую) жидкость. Участок ВС описывает переохлажденный (неустойчивый) пар. Участки FE и ВС называются также метастабильными состояниями, поскольку присутствие небольших инородных тел приводит к кипению или конденсации.
При больших значениях объема (на участке АВ) реальный газ по своему поведению близок к идеальному На участке BF (рис. ) и BC ' DE ' F(рис. )сосуществуют в динамическом равновесии жидкая и газообразная фазы. На участке GF изотерма описывает жидкость. Экспериментальная изотерма ABFG отличается от изотермы Ван-дер-Ваальса прямолинейным участком. Участок FE описывает перегретую (неустойчивую) жидкость. Участок ВС описывает переохлажденный (неустойчивый) пар. Участки FE и ВС называются также метастабильными состояниями, поскольку присутствие небольших инородных тел приводит к кипению или конденсации.
Ожижение газов
Для того чтобы ожижить газ, необходимо охладить его ниже критической температуры Ткр.
 Один из промышленных методов ожижения газов (метод Линде) использует для охлаждения газа эффект Джоуля - Томсона.
Один из промышленных методов ожижения газов (метод Линде) использует для охлаждения газа эффект Джоуля - Томсона.
На рис. дана принципиальная схема метода Линде. Сжатый компрессором К газ проходит через холодильник X , в котором охлаждается до температуры, лежащей ниже точки инверсии. Это нужно для того, чтобы при последующем расширении газ в результате эффекта Джоуля - Томсона не нагревался, а охлаждался. Затем газ течет по внутренней трубке теплообменника Т.О. и, пройдя через дроссель Др (выполняющий те же функции, что и ватный тампон в опыте Джоуля— Томсона), сильно расширяется и охлаждается.
Теплообменник состоит из двух длинных трубок разных диаметров, вставленных одна в другую (для сокращения размеров теплообменника обе трубки свиваются в спираль). Стенки внутренней трубки делаются хорошо проводящими тепло. Наружная трубка покрывается тепловой изоляцией. Если по трубкам пустить встречные потоки газов, имеющих на входе разную температуру, то в результате теплообмена через стенки внутренней трубки температура газов будет выравниваться: газ, имевший на входе в теплообменник более высокую температуру, по мере прохождения по теплообменнику охлаждается, встречный поток нагревается. Сразу после запуска установки понижение температуры газа при расширении не достаточно для того, чтобы вызвать ожижение газа. Слегка охладившийся газ направляется по внешней трубке теплообменника, чем достигается некоторое охлаждение газа, текущего по внутренней трубке по направлению к дросселю. Поэтому каждая последующая порция газа, поступающая к дросселю, имеет более низкую температуру, чем предыдущая. Вместе с тем, чем ниже начальная температура газа, тем больше понижается его температура за счет эффекта Джоуля - Томсона. Следовательно, каждая последующая порция газа имеет до расширения более низкую температуру, чем предыдущая, и, кроме того, охлаждается при расширении сильнее. Таким образом, достигается все большее понижение температуры газа в сборнике Сб и, в конце концов, температура понижается настолько, что часть газа после расширения конденсируется в жидкость.
Жидкие газы с низкой температурой кипения хранятся в сосудах специальной конструкции, называемых сосудами Дьюара. Они имеют двойные стенки, зазор между которыми тщательно эвакуируется. В условиях вакуума теплопроводность газа убывает с уменьшением давления. Поэтому эвакуированный зазор между стенками сосуда создает высокую тепловую изоляцию. Сосуды Дьюара делаются как из стекла, так и из металла и бывают емкостью от нескольких десятков миллилитров до нескольких тысяч литров.
Дата добавления: 2020-12-12; просмотров: 82; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!