Обзор спектрофотометрического метода анализа.
Министерство образования и молодежной политики
Свердловской области
Уральский государственный колледж имени И.И. Ползунова
КП.18.02.01.24.ПЗ
Определение ионов меди( II ) в водном растворе спектрофотометрическим методом
Пояснительная записка
Руководитель Разработал
_________/А.Я. Голуб/ __________/А.Р. Яруллин/
Екатеринбург 2020
СОДЕРЖАНИЕ
Введение ....................................................................................................... 4
1 Литературный обзор................................................................................. 4
1.1 Характеристика меди и ее соединений…………………………………5
1.1.1 Медь как химический элемент.................................................. 5
1.1.2 Соединения меди........................................................................
1.2 Методы определения меди………………………………………...….
1.2.1 Химические методы........................................................................
1.2.2 Физико-химические методы ..........................................................
1.2.3 Физические методы ........................................................................
1.3 Обзор спектрофотометрического метода анализа…………………...
1.4 Приборы для спектрофотометрических определений……………….
1.4.1 Принцип действия приборов…………………………………….
1.4.2 Классификация приборов………………………………………..
1.4.3 Основные составляющие части…………………………………
2 Практическая часть…………………………………………………………
2.1 Сущность метода…………………………………………………...
|
|
|
2.2 Средства измерения, устройства, материалы, реактивы ………..
2.3 Приготовление растворов …………………………………………
2.4 Выполнение работы………………………………………………..
Заключение……………………………………………………………………
Список использованных источников………………………………………..
ВВЕДЕНИЕ
Медь — один из базовых металлов во многих отраслях промышленности, включая строительство, энергетику, автомобильную промышленность и машиностроение, производство микропроцессоров и электроники.
Медь, перед использованием в виде конечного продукта подвергается длительной подготовке от добычи медных руд до получения рафинированной меди из концентрата. На каждом этапе производства нужно определять концентрацию меди в аналите, лучше всего для этого подходит спектрофотометрический метод, который имеет ряд преимуществ, такие как: высокая точность; доступность; экспрессность анализа и т. д.
Актуальность проекта заключается в том, что за последние 20 лет объем мирового потребления меди увеличился вдвое и, по прогнозам, спрос на металл продолжит расти. В связи с этим, необходимо правильно подбирать метод анализа данного элемента, чтобы контролировать все технологические процессы его производства.
|
|
|
Цель работы: спектрофотометрическое определение ионов меди(II) в водном растворе.
Задачи:
1. Изучение литературных источников и нормативных документов;
2. Рассмотрение методов определения меди;
3. Рассмотрение метода спектрофотометрического определения ионов меди(II);
4. Реализация методики определение ионов меди(II) в водном растворе спектрофотометрическим методом.
Литературный обзор
Характеристика меди и ее соединений.
1.1.1 Медь как химический элемент
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) Периодической системы химических элементов Д.И. Менделеева, с атомным номером 29.
Медь в чистом виде — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет [1].
Медь находится на втором месте по популярности среди всех цветных металлов. Основной источник получения меди – это медная руда, которую добывают в многочисленных месторождениях сланца и песчаника.
|
|
|
Физические свойства. Медь обладает высокой электропроводностью, что позволяет использовать металл при изготовлении электродов, проводов. Относительная химическая инертность меди нашла применение металлу в узлах аппаратуры для работы с огнеопасными веществами. Также высокие показатели электро- и теплопроводности обуславливают широкое использование меди в строительной отрасли. Как известно, металл отличается устойчивостью к отрицательному действию коррозии и ультрафиолетовых лучей, также не деформируется в условиях резких колебаний температурного режима [4]. Некоторые физические свойства меди перечислены в таблице 1.
Таблица 1 – Физические свойства меди
| Свойство | Агрегатное состояние | Цвет | Растворимость в воде | Плотность | Теплопроводность | Электропроводность | Температура плавления | Температура кипения |
| Медь | Твердое | Золотисто-розовый | Нерастворима | 8,82 г/см3 | 401 Вт/(м К) | 55 мСм/м | 1356,55 К | 2840,15 K |
Химические свойства. Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет.
|
|
|
Характерные степени окисления меди – +1; +2. В химических реакциях проявляет свойства восстановителя. Электронная конфигурация атома показана на рисунке 1.
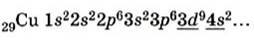
Рисунок 1 – Электронное строение атома меди
Для данного элемента свойственно такое явление, как «провал» электрона (Рисунок 2).
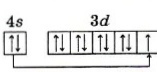
Рисунок 2 – «Провал» электрона в атоме меди
Нахождение в природе. Общее содержание меди в земной коре сравнительно невелико (0,01 вес.%), однако она чаще, чем другие элементы встречается в самородном виде. Медь входит в состав различных минералов, таких как:
· Куприт – Cu2O;
· Медный блеск – Cu2S;
· Халькопирит – CuFeS2;
· Малахит – (CuOH)2CO3.
Получение меди:
· В лаборатории: СuSO4 + Fe = FeSO4 + Cu
· В промышленности:
- 2CuO +Cu2S → 4Cu + SO2↑;
- электролиз;
- 2СuSO4 + 2H2O → 2Cu + O2↑ + 2H2SO4.
1.1.2 Соединения меди
Для измерения содержания меди, этот элемент количественно переводят в различные соединения. Чаще всего это окрашенные комплексные соединения, позволяющие определить концентрацию меди в растворе.
Медь (II) с диэтилтиокарбаматом натрия в слабоаммиачном растворе образует диэтилдитиокарбамат меди, окрашенный в желто-коричневый цвет, химизм процесса представлен на рисунке 3. Вещество имеет полосу поглощения в видимой области спектра. В разбавленных растворах диэтилдитиокарбамат меди образует коллоидные растворы, для большей устойчивости которых добавляют раствор крахмала. Для устранения мешающего влияния железа и жесткости воды добавляют раствор сегнетовой соли.
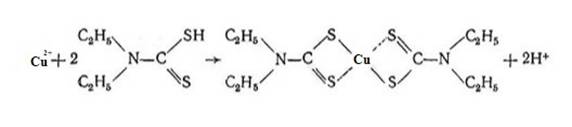
Рисунок 3 – Реакция образования диэтилтиокарбамата меди
Медь (II) с реактивом пикрамин-эпсилон образует комплексное соединение, окрашенное в красно-фиолетовый цвет, полоса поглощения расположена в видимой области спектра.
Медь (II) с раствором аммиака образует комплексное соединение, окрашенное в синий цвет – тетрааммиакат меди (II), оно достаточно устойчивое, имеет полосу поглощения преимущественно в видимой области спектра. Химизм процесса представлен на рисунке 4. Химическая связь молекул аммиака с комплексообразователем устанавливается через атом азота, который служит донором неподеленной пары электронов.
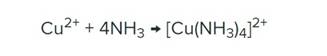
Рисунок 4 – Реакция образование тетрааммиаката меди (II)
Образование амминокомплексов в водных растворах происходит путем последовательного замещения молекул воды во внутренней сфере аквакомплексов на молекулы аммиака (Рисунок 5).
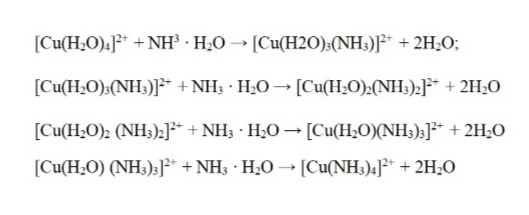
Рисунок 5 – Процесс формирования амминокомплекса меди (II)
В фотометрических методах анализа измеряют оптическую плотность растворов данных соединений для определения содержания меди.
Методы определения меди
1.2.1 Химические методы
К химическим методам анализа относятся гравиметрические и титриметрические. Аналитическим сигналом в таких методах может служить масса или объем, для его регистрации используют аналитические весы, измерительную посуду (бюретки, мерные пипетки).
Различные химические методы определения меди различаются по реакциям, лежащим в основе метода, целесообразность применения которых определяется в зависимости от предполагаемых примесей посторонних веществ, но принцип работы одинаков.
1.2.2 Физико-химические методы
Химические методы анализа характеризуются сравнительно небольшой чувствительностью, требуют больших затрат времени. Поэтому физико-химические методы нашли более широкое применение в химико-аналитических целях, благодаря повышенной чувствительности (по сравнению с химическими) и экспрессности.
В физико-химических методах анализа определяют изменение физических свойств системы, происходящие в результате химических или электрохимических реакций. Интенсивность физического сигнала зависит от концентрации определяемого компонента. В наиболее распространенных физико-химических методах определяются оптические или электрические свойства вещества
1.2.3 Физические методы
Обзор спектрофотометрического метода анализа.
Фотометрический метод основан на избирательном поглощении растворами веществ ультрафиолетового, видимого и инфракрасного света. Иногда этот метод называют методом абсорбционной спектроскопии. Виды фотометрического анализа показаны на рисунке 1 [7].

Рисунок 1 – Виды фотометрии
Спектрофотомерия основана на измерении поглощения монохроматического света в УФ и видимой области спектра.
Фотоэлектроколориметрия используют полихроматическое излучение преимущественно в видимой области спектра.
Колориметрия основана на визуальном сравнении окрасок раствора.
При прохождении света (I0) через окрашенный раствор часть света поглощается (In), часть света отражается (Iот), часть света проходит через окрашенный раствор (I). Интенсивность падающего светового потока больше чем интенсивность прошедшего через раствор (I0> I). При изучении поглощения света пользуются одинаковыми кюветами, для которых мощность отражённой части светового потока постоянна и мала и ею можно пренебречь. Интенсивность окраски раствора зависит от концентрации анализируемого вещества. Соответственно и интенсивность прошедшего светового потока зависит от концентрации вещества в растворе.
Зависимость оптической плотности от концентрации вещества в растворе и от толщины поглощающего слоя известна под названием закона Бугера - Ламберта - Бера (основной закон поглощения): оптическая плотность растворов при прочих равных условиях концентрации вещества и толщине поглощающего слоя. Математическое выражение показано в формуле 1. [7]
A = e*C*l (1)
где e – молярный коэффициент поглощения, дм3/моль*см;
С – концентрация, моль/дм3;
l – толщина поглощающего слоя, см.
Причины отклонения от закона Бугера - Ламберта - Бера: немонохроматическое излучение (обусловлено несовершенством устройства) концентрированные растворы и процессы, протекающие в растворах (такие как: диссоциация, ионизация и т.п.).
Основные методы определения анализируемого вещества в спектрофотометрии:
1) Метод сравнения со стандартом;
2) Метод добавок;
3) Метод градуировочного графика.
Метод сравнения со стандартом основан на измерении оптической плотности раствора (𝐴ст) с концентрацией, близкой к анализируемому раствору (𝐶ст). Сравнивают его оптическую плотность с анализируемым раствором (𝐴x) и по уравнению (3) находят концентрацию анализируемого компонента (𝐶x).
Аст/Аx = Cст/Сx (2)
Cx = Аx/Аст*Сст (3)
В методе добавок готовят 2 – 3 раствора с различной добавкой стандарта. Измеряют оптическую плотность анализируемого раствора без добавок СX, затем с добавками CX+д1 и CX+д2. После этого строят график. График проводят через точки пресечения AX+д2 , AX+д1 и AX до пересечения с осью абсцисс. Отсекаемый отрезок на оси и будет являться определяемой концентрацией (Рисунок 2).
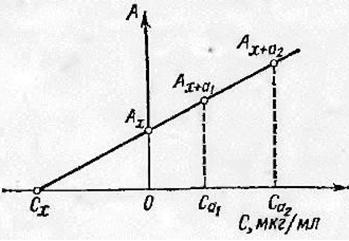 [8]
[8]
Рисунок 2 - Градуировочный график в методе добавок.
Сx = Cд*Аx/Ах-д – Ах (4)
Метод градуировочного графика. В этом методе готовят серию стандартных растворов с разной концентрацией. Измеряют их оптическую плотность и строят график зависимости оптической плотности от концентрации. Измеряют оптическую плотность анализируемого раствора и по графику находят концентрацию.
 [9]
[9]
Рисунок 3 - Градуировочный график
По графику можно определить молярный коэффициент поглощения. И соответственно можно определить концентрацию расчётным методом (5).
С = А/e*l (5)
Часто в производственных условиях при анализе руд, сплавов и т.д. требуется определять элементы при их высоком содержании. В таких условиях фотометрический анализ неприменим из-за отклонения от закона БЛБ [7].
Дата добавления: 2021-01-20; просмотров: 300; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
