Стабилизация процесса горения
Оглавление
1. ТОПЛИВО.. 4
1.1. Теплота сгорания топлива. 4
1.2. Газовое топливо. 4
2. МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ.. 7
2.1. Теоретически необходимое количество воздуха. 7
2.2. Объем продуктов сгорания. 7
2.3. Энтальпия продуктов сгорания. 8
2.4. Виды топочных устройств. 10
2.5. Тепловой баланс процесса горения. 11
2.6. Определение избытка воздуха. 14
3. ГОРЕНИЕ ГАЗОВЫХ И ЖИДКИХ ТОПЛИВ.. 18
3.1. Распространение пламени. 18
3.2. Условия устойчивой работы кинетических горелок. 21
3.3. Диффузионное горение газов. 25
3.4. Горелки промышленных агрегатов. 26
Библиографический Список.. 33
1. ТОПЛИВО
1.1. Теплота сгорания топлива
Теплота сгорания характеризует энергетическую ценность топлива и представляет собой количество тепловой энергии, выделяющейся в ходе химических реакций окисления горючих элементов газообразным кислородом. Различают высшую и низшую теплоту сгорания. Высшей теплотой сгорания Qв топлива называется количество теплоты, выделяющееся при полном сгорании 1 м3 газообразного топлива при условии конденсации водяных паров и охлаждении всех продуктов сгорания до 0 °С. Низшая теплота сгорания Qн отличается от высшей на величину теплоты испарения влаги, образующейся при горении водорода.
Для газообразных топлив при точно известном их составе теплота сгорания 1м3 сухого газа, МДж/м3, может быть достаточно точно подсчитана по формуле
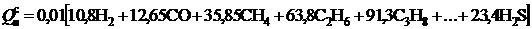 . (1.1)
. (1.1)
|
|
|
Здесь содержание соответствующих газовых компонентов подставляют в процентах.
Топочные устройства одинаковой мощности могут потреблять существенно разные количества топлива, так как теплота сгорания у разных видов меняется в широких пределах. Для сравнения экономичности работы на различных видах топлива введено понятие условного топлива, имеющего теплоту сгорания Qу = 7000 ккал/кг (29,33 МДж/кг). Тепловая мощность топочного устройства N связана с расходом B топлива и теплотой сгорания очевидным соотношением, МВт,
 . (1.2)
. (1.2)
Расход условного Bу топлива связан с расходом В натурального топлива соотношением
 .
.
1.2. Газовое топливо
В качестве газового топлива в энергетике используется преимущественно природный газ. В значительно меньших масштабах, главным образом в промышленной энергетике, находят применение различные виды искусственных горючих газов.
Важнейшими для энергетики характеристиками газового топлива являются теплота сгорания, плотность, концентрационные пределы взрываемости газа в смеси с воздухом.
|
|
|
Плотность газа по отношению к плотности воздуха определяет возможность скопления газа в верхней или нижней части помещений или установок. Плотность природного газа в нормальных условиях составляет 0,74 кг/м3. Концентрационные пределы взрываемости смесей газового топлива с воздухом характеризуют диапазон концентраций, в пределах которых эти смеси способны взрываться при наличии источника зажигания. Для природного газа в смеси с воздухом концентрационные пределы взрываемости составляют 5-15 %. Концентрационные пределы взрываемости могут быть расширены за счет предварительного подогрева воздуха либо газа.
Природным газовым топливом являются газовые смеси, добываемые из земных недр и состоящие в основном из метана и его гомологов. Соотношение между метаном и остальными углеводородами зависит от характера месторождения. Попутный газ получают при разработке нефтяных месторождений в процессе десорбции растворенных в нефти газов. Для месторождений восточных районов России выход попутного газа составляет 50-60 м3 на 1 тонну добываемой нефти. Для попутного газа характерно наибольшее (до 50 %) содержание высших углеводородов по сравнению с другими видами газового природного топлива.
|
|
|
Газ газоконденсатных месторождений помимо метана содержит до 10 % высших углеводородов, главным образом пропана и бутана. Газ чисто газовых месторождений состоит почти из одного метана; этан и пропан содержится в незначительных количествах. Балласт природного газа представлен преимущественно азотом и диоксидом углерода, в некоторых случаях в объемный состав входит до 1 % гелия.
Большинство газовых месторождений России дает топливо, практически не содержащее сернистых соединений. Исключением является Оренбургское месторождение, где в газе содержится 5-6 % сероводорода.
Перед подачей природного газового топлива в магистральные трубопроводы его подвергают переработке на специальных заводах, которая включает в себя очистку от сероводорода и диоксида углерода, извлечение высших углеводородов, осушку. Завершающая операция – одоризация (придание газу запаха) - осуществляется введением меркаптанов, которые позволяют легко обнаружить присутствие газа в воздухе. Применение природного газа чрезвычайно широко. Особенность использования – сложность хранения, хотя и существуют подземные хранилища газа, которые используются для обеспечения постоянства расхода транспортируемого газа. Поэтому при использовании газообразного топлива всегда предусматривается резервное топливо – уголь или мазут.
|
|
|
Теплота сгорания природного газа находится в пределах 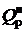 = 33-38 МДж/м3, и она тем ниже, чем меньше высших углеводородов содержится в газе.
= 33-38 МДж/м3, и она тем ниже, чем меньше высших углеводородов содержится в газе.
Искусственным газовым топливом являются горючие газы, получаемые в разнообразных технологических процессах: в металлургии, при переработке нефти, при переработке твердых горючих ископаемых. В некоторых случаях горючий газ является побочным продуктом основного производства.
В доменном производстве на каждую тонну выплавленного чугуна образуется около 2200-3000 м3 доменного газа, с теплотой сгорания 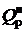 = 3,5-4 МДж/м3, содержащего 25-30 % оксида углерода и 2-3 % водорода.
= 3,5-4 МДж/м3, содержащего 25-30 % оксида углерода и 2-3 % водорода.
При производстве металлургического кокса на каждую тонну кокса получают ~ 300 м3 коксового газа, с теплотой сгорания около 17-18 МДж/м3, содержащего Н2≈ 60 %, СО≈ 6 %, СН4≈ 25 %,.
В двадцатых годах предыдущего столетия был отработан слоевой процесс воздушной газификации угля, что позволяло получать низкокалорийный газ содержащий ~60 % N2, 30 % СО и 10 % СО2, имеющий теплоту сгорания около 4 МДж/м3.
Проблема получения синтетического жидкого топлива из углей решена в 60-70-х годах прошлого столетия. В ЮАР до 90-ых годов работали два завода по облучению синтетического жидкого топлива (метанола) с предварительной парокислородной газификацией твердого топлива. Подача кислорода обеспечивала высокую температуру в топке и возможность проведения эндотермической реакции конверсии углерода водяным паром (С+Н2О=СО+Н2). В дальнейшем из продуктов парокислородной газификации на катализаторах синтезировали искусственное жидкое топливо - метанол (СО + 2Н2 = СН3ОН).
2. МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
2.1. Теоретически необходимое количество воздуха
Под теоретически необходимым понимают количество воздуха, которое требуется для полного окисления 1 м3 газообразного топлива.
Теоретически необходимый объем кислорода для окисления 1 м3 газообразного топлива рассчитывают по стехиометрическим уравнениям реакций для газообразных компонентов топлива:
2СО+О2=2СО2, 2Н2+О2=2Н2О, 2Н2S+3O2=2SO2+2H2O,
СН4+2О2=СО2+2Н2О, СmHn+(m+n/4)O2=mCO2+0,5n×H2O.
На окисление одного объема оксида углерода и водорода требуется по пол-объема кислорода, на окисление одного объёма сероводорода требуется полтора объёма кислорода, на окисление одного объёма метана требуется два объёма кислорода и, наконец, на окисление одного объёма углеводорода состава СmHn требуется (m+n/4) объёмов кислорода. Переводя процентное содержание газообразных компонентов в доли и учитывая объёмное содержание кислорода в воздухе (1/100/0,21=0,0476), получим выражение для расчета теоретически необходимого объема воздуха для окисления 1 м3 газообразного топлива в виде, м3/м3,
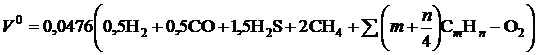 . (2.1)
. (2.1)
Для обеспечения полного выгорания топлива в топке воздух подают в количестве всегда несколько большем теоретически необходимого. Отношение действительно поданного количества воздуха 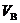 к теоретически необходимому
к теоретически необходимому 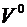 называют коэффициентом избытка воздуха
называют коэффициентом избытка воздуха 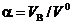 .
.
2.2. Объем продуктов сгорания
При тепловых расчетах котла энтальпию продуктов сгорания за каждой поверхностью нагрева определяют по составу дымовых газов и температуре. Для расчета энтальпий продуктов сгорания необходимо с достаточной точностью рассчитывать объемы продуктов сгорания. Реакции горения при высоких температурах идут с большой скоростью, поэтому состав конечных продуктов близок к равновесному. Состав продуктов сгорания при сжигании 1 м3 газообразного можно записать в следующем виде:
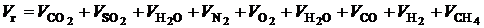 (2.2)
(2.2)
Первые три слагаемых представляют собой продукты полного окисления горючих элементов топлива. Они состоят из трехатомных сухих газов, обозначаемых обычно через 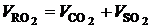 , и объема водяных паров.
, и объема водяных паров.
Следующие три слагаемых представляют собой объемы азота и кислорода, определяемые как остаток сухого воздуха после горения топлива и объем водяных паров. Здесь  , так как кислород в значительной мере израсходован на окисление. Объем водяных паров
, так как кислород в значительной мере израсходован на окисление. Объем водяных паров 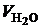 включает в себя влагу воздуха. Оставшиеся три слагаемых представляют собой продукты неполного горения.
включает в себя влагу воздуха. Оставшиеся три слагаемых представляют собой продукты неполного горения.
При полном сгорании 1 м3 газообразного  , а также отсутствии избыточного воздуха
, а также отсутствии избыточного воздуха  в образующихся газообразных продуктах должны содержатся лишь продукты полного окисления горючих элементов СО2, SО2, Н2О и азот воздуха N2. Получающиеся в этом случае объемы газов называют теоретическими:
в образующихся газообразных продуктах должны содержатся лишь продукты полного окисления горючих элементов СО2, SО2, Н2О и азот воздуха N2. Получающиеся в этом случае объемы газов называют теоретическими:
 . (2.2)
. (2.2)
При сжигании газообразного топлива объем сухих трехатомных газов составит, м3/м3:
 (2.3)
(2.3)
Теоретический объем азота при сжигании газообразного топлива, м3/м3,
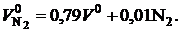 (2.4)
(2.4)
Теоретический объем водяных паров при сжигании газообразного топлива, м3/м3:
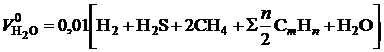 . (2.5)
. (2.5)
Избыточное количество воздуха приводит к увеличению объема азота 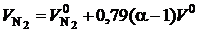 и водяных паров
и водяных паров  в продуктах сгорания. Кроме того, в продуктах сгорания появляется кислород
в продуктах сгорания. Кроме того, в продуктах сгорания появляется кислород 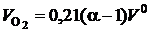 . Таким образом, действительный объем продуктов сгорания может быть рассчитан так, м3/м3:
. Таким образом, действительный объем продуктов сгорания может быть рассчитан так, м3/м3:
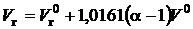 . (2.6)
. (2.6)
Объем сухих газов, м3/кг (м3/м3):
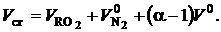 (2.7)
(2.7)
2.3. Энтальпия продуктов сгорания
Энтальпия продуктов сгорания рассчитывается на 1 м3 газообразного топлива и складывается из энтальпии теоретических продуктов сгорания и энтальпии избыточного воздуха, кДж/ м3:
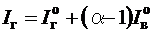 . (2.8)
. (2.8)
Энтальпия продуктов сгорания выше энтальпии воздуха на 15-20% из-за присутствия в них трехатомных газов (СО2, SO2, H2O), обладающих высокой теплоемкостью.
Энтальпия теоретического количества продуктов сгорания при температуре t ºС, может быть рассчитана так, кДж/ м3:

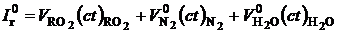 . (2.9)
. (2.9)
Энтальпия теоретически необходимого количества воздуха, кДж/ м3:
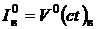 . (2.10)
. (2.10)
Все формулы для подсчета энтальпий относятся к случаю полного сгорания, но с достаточной для расчетов точностью они применимы при наличии химической неполноты сгорания, значение которой не превышает нормативного для этих топлив.
Теплота, выделяющаяся при сгорании топлива, воспринимается продуктами сгорания, которые нагреваются до определенной температуры. В реальных условиях не вся теплота идет на нагрев продуктов сгорания: часть передается теплообменным поверхностям, часть теряется в окружающую среду, а при высоких температурах часть теплоты затрачивается на диссоциацию продуктов сгорания. При атмосферном давлении и t = 1500 °С степень диссоциации СО2 составляет 0,8 %. Далее с повышением температуры она быстро возрастает, достигая 4 % при температуре 2000 ºС и 19 % при 2500 ºС.
Температуру горения для реальных условий можно определить из теплового баланса горения:
 . (2.11)
. (2.11)
где 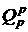 - располагаемая теплота топлива;
- располагаемая теплота топлива;  и
и 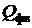 - физическая теплота топлива и воздуха соответственно,;
- физическая теплота топлива и воздуха соответственно,;  - теплота, отданная теплообменными поверхностями в окружающую среду;
- теплота, отданная теплообменными поверхностями в окружающую среду; 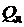 - теплота, затраченная на диссоциацию. Подставляя в выражение значение энтальпии продуктов сгорания
- теплота, затраченная на диссоциацию. Подставляя в выражение значение энтальпии продуктов сгорания  и преобразуя его, получим выражение для расчета
и преобразуя его, получим выражение для расчета
температуры горения
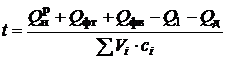 . (2.12)
. (2.12)
Максимальное значение температуры получим при условии  , т. е. в адиабатных условиях. Температура горения, получаемая в адиабатных условиях, называется теоретической температурой горения. Расчетное определение температуры горения осложнено зависимостью теплоемкости и теплоты диссоциации от температуры и возможно лишь с использованием ЭВМ. Значения энтальпий продуктов сгорания всех видов топлив, рассчитанные с учетом теплоты диссоциации и зависимости теплоемкости продуктов сгорания от температуры, приведены таблицах нормативного метода расчета котельных установок [6]. Для определения теоретической температуры горения можно использовать метод итераций или графический. В последнем случае строят график зависимости энтальпии продуктов сгорания от температуры для различных значений коэффициента избытка воздуха (рис. 2.1). Откладывая по оси ординат значение располагаемой теплоты топлива, графически определяют теоретическую температуру горения при заданном коэффициенте избытка воздуха.
, т. е. в адиабатных условиях. Температура горения, получаемая в адиабатных условиях, называется теоретической температурой горения. Расчетное определение температуры горения осложнено зависимостью теплоемкости и теплоты диссоциации от температуры и возможно лишь с использованием ЭВМ. Значения энтальпий продуктов сгорания всех видов топлив, рассчитанные с учетом теплоты диссоциации и зависимости теплоемкости продуктов сгорания от температуры, приведены таблицах нормативного метода расчета котельных установок [6]. Для определения теоретической температуры горения можно использовать метод итераций или графический. В последнем случае строят график зависимости энтальпии продуктов сгорания от температуры для различных значений коэффициента избытка воздуха (рис. 2.1). Откладывая по оси ординат значение располагаемой теплоты топлива, графически определяют теоретическую температуру горения при заданном коэффициенте избытка воздуха.
| Рис. 2.1. Зависимость энтальпии продуктов сгорания от температуры: цифры у кривых – коэффициент избытка воздуха |

2.4. Виды топочных устройств
Горение газообразного топлива организуют обычно в факеле.
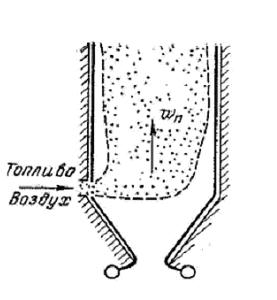
Рис. 2.2. Схемы организации сжигания
Газовое топливо поступает в камеру вместе с воздухом через специальное устройство – горелку и сгорает в факеле.
Топки характеризуются двумя параметрами: тепловым напряжением зеркала горения qf, МВт/м2, и удельным тепловым напряжением объёма топки qv,МВт/м3:
 ;
;  . (2.13)
. (2.13)
Расход воздуха, подаваемый на сжигание, может быть рассчитан как:
 , (2.14)
, (2.14)
где  - скорость дутья, приведенная к нормальным условиям.
- скорость дутья, приведенная к нормальным условиям.
Выражая из данного соотношения
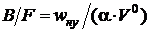 (2.15)
(2.15)
и подставляя в выражение для тепловых напряжений зеркала горения, получим
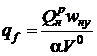 . (2.16)
. (2.16)
Отношение теплоты сгорания органического топлива к теоретически необходимому количеству воздуха для большинства топлив является величиной постоянной и равной примерно 3,8 МДж/м3. Тогда в окончательном виде тепловые напряжения зеркала горения можно представить в виде, МВт/м2,
 . (2.17)
. (2.17)
Для увеличения тепловых напряжений зеркала горения необходимо осуществлять сжигание топлива при минимальных избытках воздуха с максимально возможной для данной технологии скоростью дутья. Рекомендуемые значения тепловых напряжений зеркала горения и объёма топки приведены в следующей таблице.
Рекомендуемые значения тепловых напряжений
| Топки | qF, МВт/м2 | qV,МВт/м3 | Wну, м/с |
| Камерные | 3,5-5 | 0,1-0,2 | ~1 |
2.5. Тепловой баланс процесса горения
Эффективность использования топлива в топочном устройстве определяется двумя основными факторами: полнотой сгорания топлива в топочной камере и глубиной охлаждения продуктов сгорания.
Распределение вносимой в топку теплоты на полезно используемую и тепловые потери производится путем составления теплового баланса. Тепловой баланс составляется на 1 м3 газообразного топлива.
Располагаемая теплота, кДж/кг (кДж/ м3):
 , (2.18)
, (2.18)
где 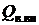 - теплота, вносимая в топку воздухом, подогретым вне котла;
- теплота, вносимая в топку воздухом, подогретым вне котла; 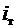 - физическая теплота топлива, определяемая его температурой: iт=стtт, здесь ст – удельная теплоемкость топлива, кДж/(м3×К); tт – температура топлива, °С.
- физическая теплота топлива, определяемая его температурой: iт=стtт, здесь ст – удельная теплоемкость топлива, кДж/(м3×К); tт – температура топлива, °С.
Количество теплоты, полученной воздухом при его подогреве в другой установке, определяют по формуле
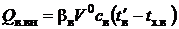 , (2.19)
, (2.19)
где bв – относительное количество воздуха, проходящее через дополнительную нагревательную установку; св – теплоемкость воздуха; 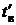 и tх.в – температуры холодного воздуха и воздуха, поступающего в топку.
и tх.в – температуры холодного воздуха и воздуха, поступающего в топку.
Располагаемая теплота расходуется на производство полезной теплоты Q1 и тепловые потери:
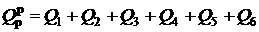 , (2.20)
, (2.20)
где 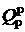 - располагаемая теплота на 1 кг твердого или жидкого либо на 1 м3 газообразного топлива; Q1 – полезно используемая теплота; Q2 – потеря теплоты с уходящими газами; Q3 - потеря теплоты с химической неполнотой сгорания топлива,; Q4 – потеря теплоты с механической неполнотой сгорания; Q5 – потеря теплоты через ограждения; Q6 – потеря с физической теплотой шлака. Разделив правую и левую части выражения (2.20) на
- располагаемая теплота на 1 кг твердого или жидкого либо на 1 м3 газообразного топлива; Q1 – полезно используемая теплота; Q2 – потеря теплоты с уходящими газами; Q3 - потеря теплоты с химической неполнотой сгорания топлива,; Q4 – потеря теплоты с механической неполнотой сгорания; Q5 – потеря теплоты через ограждения; Q6 – потеря с физической теплотой шлака. Разделив правую и левую части выражения (2.20) на  и умножив на 100 %, получим уравнения теплового баланса в следующем виде:
и умножив на 100 %, получим уравнения теплового баланса в следующем виде:
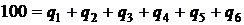 . (2.21)
. (2.21)
Коэффициент полезного действия котла:
 . (2.22)
. (2.22)
При сжигании газообразного топлива отсутствуют потери теплоты с механической неполнотой сгорания и физическим теплом шлаков.
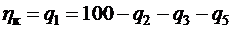
Большая часть теплоты, вносимой в топку, воспринимается поверхностями нагрева и передается рабочему телу. За счет этой теплоты производится подогрев воды до температуры кипения, ее испарение и перегрев пара. Это полезно используемая теплота, остальная часть составляет тепловые потери.
Полезное тепловосприятие связано с паропроизводительностью котла D соотношением
 (2.23)
(2.23)
где iп.п и iп.в - энтальпия перегретого пара и питательной воды, кДж/кг.
Наибольшей из потерь, как правило, является потеря теплоты с уходящими газами, %,
 (2.24)
(2.24)
где 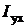 и
и 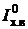 - энтальпия уходящих газов и теоретического количества холодного воздуха (при температуре 30 °С) соответственно;
- энтальпия уходящих газов и теоретического количества холодного воздуха (при температуре 30 °С) соответственно; 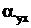 - коэффициент избытка воздуха в уходящих газах.
- коэффициент избытка воздуха в уходящих газах.
В продуктах сгорания топлив могут находиться газообразные горючие компоненты СО, Н2, СН4. Их догорание за пределами топочной камеры практически невозможно вследствие низких температур и концентраций как горючих компонентов, так и кислорода. Теплота, потерянная в результате неполного сгорания горючих веществ, составляет химический недожог топлива Q3, кДж/кг (кДж/м3). Расчет потерь теплоты q3, %, производят по формуле
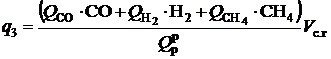 , (2.25)
, (2.25)
где 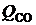 ,
, 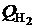 ,
,  - теплоты сгорания продуктов неполного горения; СО, Н2,СН4 – объемные содержания продуктов неполного сгорания топлива в сухих продуктах сгорания, %; Vс.г – объем сухих продуктов сгорания, м3/кг.
- теплоты сгорания продуктов неполного горения; СО, Н2,СН4 – объемные содержания продуктов неполного сгорания топлива в сухих продуктах сгорания, %; Vс.г – объем сухих продуктов сгорания, м3/кг.
Химический недожог при сжигании газообразного и жидкого топлива составляет q3=0-0,5 %, а при сжигании твердого топлива в факеле принимается равным нулю.
Потеря теплоты с химическим недожогом сильно зависит от коэффициента избытка (рис. 2.3) воздуха и нагрузки топочного устройства (рис. 2.4). Наличие химического недожога при a = 1 определяется несовершенством перемешивания топлива с воздухом. При коэффициенте избытка воздуха aкр (кривая q3) химический недожог не возникает. Обычно aкр = 1,02-1,03 и характеризует степень аэродинамического несовершенства горелочного устройства.
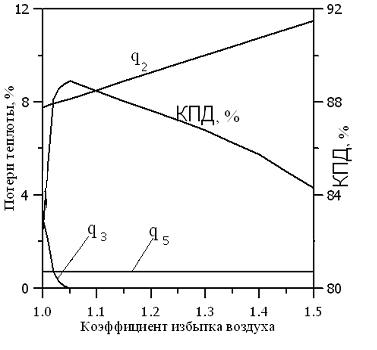
| 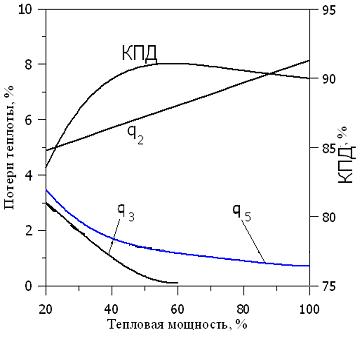
|
| Рис. 2.3. Зависимость потерь теплоты и КПД от коэффициента избытка воздуха | Рис. 2.4. Зависимость потерь теплоты и КПД от тепловой мощности котла |
Значение потерь теплоты от наружного охлаждения q5 составляет от 0,2 до 2,5 %.
При уменьшении тепловой нагрузки котельных установок происходит некоторое падение температуры уходящих газов, что приводит к уменьшению потерь теплоты с уходящими газами (рис. 2.4). Потери теплоты с химической и механической неполнотой сгорания увеличиваются с уменьшением тепловой нагрузки из-за ухудшения смешения топлива и воздуха при пониженных скоростях. Удельные потери теплоты через ограждения также увеличиваются, поскольку абсолютное значение этих потерь теплоты остается практически неизменным, а тепловая нагрузка уменьшается. Таким образом, из-за различной зависимости тепловых потерь от нагрузки оказывается, что при пониженной нагрузке кпд котельного агрегата достигает максимального значения.
2.6. Определение избытка воздуха
Расчетный коэффициент избытка воздуха a в топке устанавливается согласно нормам теплового расчета котла. Обычно он принимает следующее значение: 1,1-1,25 при сжигании твердых топлив; 1,03-1,1 при сжигании жидких и газообразных топлив.
Уменьшение избытка воздуха приводит к экономии расхода энергии на привод тягодутьевых машин и повышению кпд котла, однако его снижение ниже расчетного значения ведет к быстрому росту недожога топлива и снижает экономичность.
При работе котла под разрежением, создаваемым дымососом, происходит подсос в газовый тракт холодного воздуха из окружающей среды. За счет этого объем продуктов сгорания увеличивается, возрастает избыток воздуха и снижается температура газов. Присосы определяются в долях теоретически необходимого объема воздуха Dai = DVi/V0, где DVi – объем присосного воздуха в пределах i-й поверхности котла. Тогда избыток воздуха за i-й по порядку поверхностью нагрева после топки определится как aI = aт + SDai.
Для обеспечения оптимальных условий горения и минимума присосов воздуха по газовому тракту необходим постоянный контроль за избытками воздуха в газовом тракте.
Коэффициент избытка воздуха в соответствии с определением равен отношению действительно поданного количества воздуха к теоретически необходимому:
 , (2.38)
, (2.38)
где ΔV – избыточное количество воздуха.
Не учитывая увеличения содержания азота в дымовых газах за счет азота топлива, можно записать, что объем всего воздуха подаваемого на горение связан с объемом азота в дымовых газах следующим соотношением:
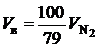 . (2.39)
. (2.39)
Избыточное количество воздуха, подаваемого на горение, связано с объемом кислорода, не вступившим в реакцию, соотношением
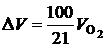 . (2.40)
. (2.40)
Подставляя (2.39) и (2.40) в (2.38), получим:
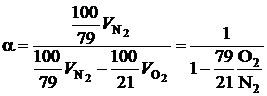 . (2.41)
. (2.41)
При наличии химнедожога расчет ведется на количество кислорода, который должен был прореагировать при полном окислении горючих элементов:
 , (2.42)
, (2.42)
Тогда азотная формула примет окончательный вид
 . (2.43)
. (2.43)
Таким образом, для точного определения коэффициента избытка воздуха необходимо измерить практически полный состав продуктов сгорания, а именно: концентрации кислорода, азота, оксида углерода, водорода, метана.
На практике используют два метода определения коэффициента избытка воздуха - по концентрации кислорода и по концентрации сухих трехатомных газов в продуктах сгорания. Основным является метод прямого определения концентрации кислорода (магнитный кислородомер или электролитическая ячейка). Пересчет процентного содержания кислорода в продуктах сгорания на значение избытка воздуха проведем исходя из следующих соображений.
Пусть горючая часть топлива не содержит водорода. При окислении углерода и серы объемы образовавшихся диоксидов углерода и серы равны объему израсходованного кислорода (С+О2=СО2, S+O2=SO2), при этом концентрация азота при любом коэффициенте избытка воздуха будет постоянной и равной 79 %. Тогда при отсутствии химического недожога (СО=0, Н2=0, СН4=0) азотная формула может быть преобразована к виду
 . (2.44)
. (2.44)
Пусть горючая часть топлива представлена только водородом. Тогда в продуктах полного сгорания будут содержаться только азот, кислород и вода, а в сухих продуктах сгорания (газоанализаторы работают при комнатной температуре) - только азот и кислород. Совершенно очевидно, что при коэффициенте избытка воздуха α = 1 концентрация азота в продуктах сгорания будет равна 100 %. Таким образом, наличие в топливе водорода приводит к увеличению концентрации азота в сухих продуктах сгорания.
На изменение концентрации азота в продуктах сгорания влияет также и содержание кислорода в топливе. При соотношении водорода топлива и кислорода топлива 32/4 = 1/8 (2Н2 + О2 = 2Н2О, 4 + 32 = 36) весь кислород топлива затрачивается на окисление водорода топлива, а кислород воздуха будет расходоваться на окисление углерода и серы. В этом случае концентрация азота в продуктах сгорания при любом избытке воздуха будет также постоянной и равной 79 %. Следовательно, кислородная формула дает достаточно точные значения либо когда содержание например, при сжигании древесины.
Вторым достаточно широко применяемым методом определения избытка воздуха в продуктах сгорания является его расчет на основе нахождения процентного содержания сухих трехатомных газов RO2 = CO2 + SO2, где RO2= 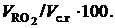
При полном сгорании топлива в стехиометрических соотношениях (a=1) и при условии, что содержание водорода и кислорода в топливе соответствует выражению Нр=Ор/8 (весь водород топлива окисляется кислородом топлива), содержание сухих трехатомных газов составит:
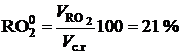 . (2.45)
. (2.45)
В большинстве твердых и жидких топливах Нр > Ор/8. Тогда остаток водорода будет окисляться за счет кислорода воздуха с образованием паров воды. Остающийся при этом объем азота 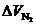 войдет в состав сухих газов, и максимальное содержание сухих трехатомных газов будет меньше 21 %:
войдет в состав сухих газов, и максимальное содержание сухих трехатомных газов будет меньше 21 %:
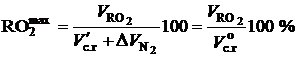 (2.46)
(2.46)
и тем меньше, чем больше разность Нр и Ор/8.
Показателем, отражающим это различие в содержании водорода и кислорода в топливе, является топливный коэффициент Бунте b. Его значение для твердых и жидких топлив определяется по формуле
 . (2.47)
. (2.47)
С помощью коэффициента b величину максимально возможного содержания сухих трехатомных газов в продуктах сгорания 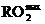 можно выразить следующим образом:
можно выразить следующим образом:
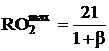 . (2.48)
. (2.48)
Значения 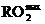 находятся в следующих пределах для различных видов топлив:
находятся в следующих пределах для различных видов топлив:
твердое топливо…………………..18 - 20%;
мазут……………………………….16 - 17%;
природный газ…………………….11 - 13%.
При коэффициенте избытка воздуха a > 1 объем сухих газов составит Vс.г= 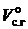 +DV и RO2=[
+DV и RO2=[ 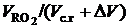 ]×100 и будет меньше, чем
]×100 и будет меньше, чем 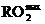 . Поскольку при этом объем
. Поскольку при этом объем 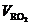 не изменится, то отношение
не изменится, то отношение
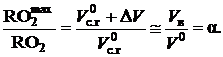 (2.49)
(2.49)
Надежность этого метода определения коэффициента избытка воздуха зависит от того, насколько точно известно для данного топлива значение  , а также от точности выполнения анализа дымовых газов на содержание RO2. Трудности использования данного метода возникают при сжигании топлив, чья минеральная часть содержит карбонаты, которые выделяют дополнительное количество СО2 при термическом разложении.
, а также от точности выполнения анализа дымовых газов на содержание RO2. Трудности использования данного метода возникают при сжигании топлив, чья минеральная часть содержит карбонаты, которые выделяют дополнительное количество СО2 при термическом разложении.
3. ГОРЕНИЕ ГАЗОВЫХ И ЖИДКИХ ТОПЛИВ
3.1. Распространение пламени
Интенсивность горения неподвижных или ламинарно-движущихся горючих газовых смесей характеризуется нормальной скоростью распространения пламени Un (пламя распространяется по нормали к фронту горения). Рассмотрим процесс распространения пламени в предварительно подготовленной горючей смеси, когда эта смесь движется внутри трубки. В результате начавшегося горения создается фронт пламени толщиной d и перемещающийся в направлении движения смеси. Стабилизация фронта пламени наблюдается при равенстве скоростей смеси и противоположно направленной скорости перемещения фронта пламени. Скорость нормального распространения пламени зависит от состава смеси (она максимальна в стехиометрической смеси), от температуры, от вида горючего газа и окислителя и имеет следующие значения: СО + воздух – 0,43 м/с; СН4 + воздух – 0,38 м/с; Н2 + воздух – 2,65 м/с; Н2 + О2 – 13 м/с.
Распространение пламени можно рассматривать как непрерывный процесс прогрессирующего ускорения реакции при прохождении газа через узкую зону пламени в условиях параллельного переноса теплоты теплопроводностью и диффузионного переноса продуктов горения, в том числе активных центров в свежую смесь и свежей смеси в зону горения [10].
При распространении пламени фронт делит массу газа на две части: впереди – слабо нагретая газовая смесь, позади – сильно нагретые продукты сгорания. В зоне горения температура изменяется от начальной Т0 до температуры горения Тг, при этом уменьшается концентрация горючих веществ от С0 до 0. Скорость реакции зависит от концентрации горючих веществ С и температуры Т, поэтому в зоне пламени она проходит через максимум (увеличивается с повышением температуры и уменьшается по мере уменьшения концентрации горючих). Чем больше скорость химической реакции, тем больше скорость распространения пламени и меньше время пребывания газа в зоне пламени.
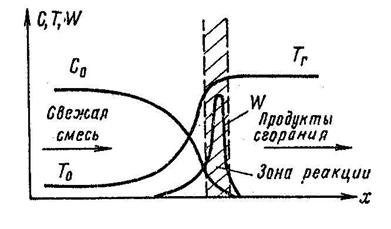
| Рис. 3.1. Изменение температуры, концентрации горючих веществ и скорости реакции во фронте пламени |

| Рис. 3.2. Определение толщины фронта пламени |
Заменим истинное распределение температур ломаной линией, проведя касательную в точке перегиба и продолжив до пересечения с прямым Т0 и Тг. Расстояние между точками пересечения d – тепловая ширина фронта пламени. Максимальный градиент температур в пламени можно представить в виде 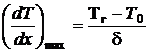 . Поток теплоты из зоны пламени идет на нагрев свежей смеси теплопроводностью
. Поток теплоты из зоны пламени идет на нагрев свежей смеси теплопроводностью  . С другой стороны, эта теплота затрачивается на подогрев смеси в количестве r·Un ·1 ( кг/м3· м/с ×м2·= кг/с) от температуры Т0 до Тг:
. С другой стороны, эта теплота затрачивается на подогрев смеси в количестве r·Un ·1 ( кг/м3· м/с ×м2·= кг/с) от температуры Т0 до Тг: 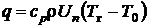 . Приравнивая выражения для q, получим соотношение, связывающее нормальную скорость распространения и толщину фронта пламени:
. Приравнивая выражения для q, получим соотношение, связывающее нормальную скорость распространения и толщину фронта пламени:
 , (3.1)
, (3.1)
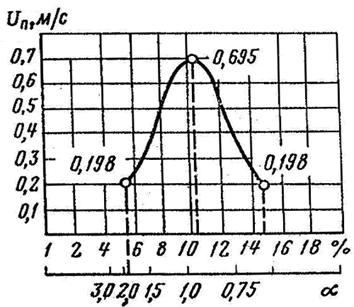
| Рис. 3.3. Зависимость скорости нормального распространения пламени от коэффициента избытка воздуха для смеси метан-воздух |
где a – коэффициент температуропроводности, м2/с.
Опыт показывает, что при нормальном распространении пламени химические реакции протекают в очень тонком слое, отделяющем несгоревшую часть от продуктов сгорания. Толщина фронта пламени даже для медленно горящих смесей составляет доли миллиметров.
Скорость нормального распространения пламени, в первую очередь, зависит от энергии активации и теоретической температуры горения. Теоретическая температура горения, в свою очередь, зависит от состава исходной горючей смеси. Максимальная температура горения достигается при коэффициенте избытка воздуха, близком к единице (рис. 3.3), следовательно, и максимальная скорость распространения пламени достигается в стехиометрической смеси. Предварительный подогрев смеси увеличивает Un, так как при этом повышается температура горения. Инертные добавки снижают скорость горения, поскольку при этом снижается температура горения.
Пределы воспламенения
При разбавлении смеси вследствие уменьшения температуры горения уменьшается Un, что приводит к прогрессирующему увеличению теплопотерь из пламени и прекращению горения. Опытные кривые Un = f (состава) обрываются на конкретных величинах Un, что говорит о граничных скоростях распространения пламени. Существуют нижний и верхний пределы распространения пламени. Если смесь лежит вне концентрационных пределов воспламенения и может быть зажжена сильным источником, все же пламя в ней не будет распространяться.
Тепловой поток излучением из фронта пламени, распространяющегося в трубке радиусом R, пропорционален толщине фронта пламени 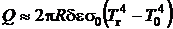 . Здесь δ – толщина фронта пламени, ε – приведенная степень черноты, σ0 - постоянная Стефана-Больцмана. Максимальная температура горения и соответственно скорость нормального распространения пламени достигаются в стехиометрической смеси. При увеличении (уменьшении) коэффициента избытка воздуха температура во фронте горения падает, соответственно уменьшается скорость нормального распространения пламени и возрастает толщина фронта пламени. Это приводит к увеличению теплопотерь из пламени, что в дальнейшем объясняет уменьшение температуры во фронте горения. При достаточно больших (малых) избытках воздуха теплопотери превысят тепловыделения во фронте пламени, что приведет к погасанию.
. Здесь δ – толщина фронта пламени, ε – приведенная степень черноты, σ0 - постоянная Стефана-Больцмана. Максимальная температура горения и соответственно скорость нормального распространения пламени достигаются в стехиометрической смеси. При увеличении (уменьшении) коэффициента избытка воздуха температура во фронте горения падает, соответственно уменьшается скорость нормального распространения пламени и возрастает толщина фронта пламени. Это приводит к увеличению теплопотерь из пламени, что в дальнейшем объясняет уменьшение температуры во фронте горения. При достаточно больших (малых) избытках воздуха теплопотери превысят тепловыделения во фронте пламени, что приведет к погасанию.
Концентрационные пределы распространения пламени не являются постоянными: сужаются при разбавлении смеси инертным газом, расширяются при предварительном подогреве смеси. Концентрационные пределы распространения пламени при атмосферном давлении в отсутствии предварительного подогрева имеют следующие значения: Н2 + воздух - 4-74,2%; СО + воздух - 12,5-74,2 %; СН4 + воздух - 5-15 %.

| Рис. 3.4. Концентрационные границы зажигания для различных газов в смеси с воздухом |
Со скоростью нормального распространения пламени связано также явление погасания пламени. Опыт показывает, что одна и та же смесь горит в широких трубках, но не горит в трубах малого диаметра. При уменьшении диаметра трубки увеличиваются относительные теплопотери, которые снижают температуру горения и, следовательно, скорость распространения пламени. С уменьшением Un увеличивается толщина пламени, а значит, возрастают теплопотери, что приводит к еще большему уменьшению температуры, а затем и к погасанию. Инженерное использование данного явления – огнепреградители, т. е. сужение диаметра газоподводящих каналов.
3.2. Условия устойчивой работы кинетических горелок
В однородной предварительно перемешанной смеси интенсивность горения зависит только от кинетики самих химических реакций, поэтому такой вид горения называется кинетическим. В зависимости от режима движения горящей смеси различают ламинарное и турбулентное горение.
При ламинарном движении смеси скорость ее движения распределяется в горелке по параболе, аналогичное распределение скоростей сохраняется и на выходе из горелки. Условием устойчивости ламинарного горения, осуществляемого в обычных атмосферных горелках, является равенство W = – Un на периферии основания факела.
Для однородной газовой смеси заданного состава Un - величина постоянная. На периферии Un уменьшается: внутри горелки за счет охлаждающего действия стен, на выходе из горелки (при ά < 1) за счет разбавления горючей смеси воздухом. Вблизи границ струи, где смесь обеднена, распространение пламени прекращается. На выходе из горелки струя расширяется, скорость потока падает, а скорость Un возрастает, так как исчезает охлаждающее действие стенок. И на каком-то расстоянии выполняется условие Un = W. В таких точках пламя удерживается стационарно, обеспечивая естественную стабилизацию факела.
Пламя в процессе распространения от периферии к центру сносится потоком и в результате этого достигает оси струи на некотором расстоянии от устья горелки, образуя конусообразный факел.
При данном диаметре горелки форма факела и его размеры зависят от скорости распространения пламени и скорости струи. Чем больше скорость распространения пламени и чем меньше скорость потока, тем короче факел. Длина факела может быть вычислена исходя из следующих соображений: пламя от периферии струи до оси горелки дойдет за время D  , за это же время струя по оси потока пройдет расстояние h = Dτ˙ W0, где W0 – скорость потока на оси струи. Тогда высота (длина) факела может быть рассчитана как
, за это же время струя по оси потока пройдет расстояние h = Dτ˙ W0, где W0 – скорость потока на оси струи. Тогда высота (длина) факела может быть рассчитана как
 . (3.2)
. (3.2)
При уменьшении скорости истечения смеси из горелки высота конуса уменьшается. Когда скорость истечения смеси становится меньше скорости распространения пламени, может произойти проскок пламени в горелку.
Условия отрыва и проскока в зависимости от коэффициента избытка воздуха изображены на рис. 3.5. Кривая, ограничивающая скорость проскока пламени в горелку, имеет такой же характер, как и зависимость скорости нормального распространения пламени. Действительно, чем выше скорость нормального распространения пламени, тем выше должна быть скорость истечения газа из горелки.
| Рис. 3.5. Пределы устойчивости горения в горелках
|

Кривая отрыва имеет несколько иной характер. При коэффициенте избытка воздуха a >1 с увеличением скорости истечения газовоздушной среды (рис. 3.6,а) наблюдается следующее. За счет расширения струи и падения скорости потока стабилизация горения, то есть равенство скоростей нормального распространения пламени и локальной скорости потока на переферии струи установится на несколько большем расстоянии от устья горелки. При дальнейшем увеличении скорости потока точка зажигания ещё сместится от устья горелки. Но при какой–то скорости потока упадет и значение Un за счет разбавления смеси на периферии струи. В этом случае во всех точках будет выполнятся условие W > Un и произойдет отрыв пламени от горелки.
| Рис. 3.6. Отрыв пламени при различных коэффициентах избытка воздуха a: а - a>1; б - a<1 |

При коэффициенте избытка воздуха a<1за счет разбавления смеси воздухом (из окружающей среды при использовании горелки Бунзена, за счет вторичного воздуха в промышленных горелках) на периферии струи будет наблюдаться локальное увеличение скорости нормального распространения пламени (см. рис. 3.6). Причем чем меньше коэффициент избытка воздуха в исходной газовоздушной смеси, тем больше локальное увеличение Un. Это приводит к тому, что отрыв пламени наблюдается при больших скоростях потока.
Таким образом, чем меньше коэффициент избытка воздуха в исходной смеси, тем шире диапазон скоростей, в котором горелка работает устойчиво. .Именно поэтому часто используют горелки частичного смешения с aисх = 0,4-0,7. Вести процесс при a < 0,4 не целесообразно, так как увеличивается недожог.
Стабилизация процесса горения
Для стабилизации пламени необходимо создать около устья горелки условия для надежного воспламенения газовоздушной смеси.
Наибольшее распространение в качестве стабилизаторов получили керамические туннели (рис. 3.7), зажигательные пояса, тела плохообтекаемой формы (рис. 3.8), а из аэродинамических методов - закручивание воздушного потока, создающее зоны рециркуляции продуктов сгорания около выходного сечения смесителя.
При стабилизации в туннелях струя смеси выходит из насадка в туннель большего диаметра. В головной части туннеля образуются устойчивые вихревые зоны, в которых осуществляется рециркуляция продуктов сгорания. Раскаленные продукты поджигают свежую смесь. Существуют оптимальные соотношения диаметров, так как, с одной стороны, продукты рециркуляции поджигают исходную смесь и их должно быть достаточно для прогрева пограничной зоны струи до температуры воспламенения, с другой стороны, газы рециркуляции разбавляют исходную смесь, уменьшая скорость выгорания. Оптимальное соотношение диаметров, подобранное экспериментально, оказалось равным ~2,5.
Плохо обтекаемые тела также приводят к образованию вихревых зон за стабилизатором с зоной рециркуляции продуктов сгорания (рис. 3.8).
| 
|
| Рис. 3.7. Схема керамического туннеля | Рис. 3.8. Схема организации зажигания рециркуляцией продуктов сгорания за плохо обтекаемым телом |
Зоны устойчивой рециркуляции продуктов сгорания можно организовать за счет закручивания струи (рис. 3.9). При этом образуются зоны разрежения по центру струи и у выходного сечения, обеспечивающие рециркуляцию раскаленных продуктов сгорания.
За счет взаимодействия струй при тангенциальном расположении горелок (рис. 3.10) в центре топки можно создать устойчивый вихрь раскаленных продуктов сгорания, являющийся источником зажигания.

| 
|
| Рис. 3.9. Стабилизация факела при использовании вихревых горелок | Рис. 3.10 Стабилизация факела при тангенциальном расположении горелок |
3.3. Диффузионное горение газов
В случае когда через горелку подается газ, не содержащий кислорода, при его поджигании горение происходит за счет потребления кислорода окружающего воздуха, поступающего посредством диффузии. Поскольку горение происходит в процессе взаимной диффузии горючего и окислителя, причем скорость горения определяется интенсивностью процесса смешения, подобное горение называется диффузионным. В зависимости от характера смешения различают ламинарное и турбулентное диффузионное горение.
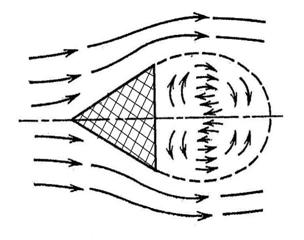
Ламинарное диффузионное горение происходит при ламинарном режиме движения газа, вытекающего из горелки. Зона устойчивого горения устанавливается по поверхности, где горючее и окислитель находятся в стехиометрическом соотношении. Образующиеся продукты горения диффундируют как в окружающее пространство, так и внутри факела. Структура диффузионного ламинарного факела показана на рис. 3.11. Концентрация горючего падает от наибольшего значения на оси струи до нуля во фронте пламени, а концентрация кислорода возрастает от нуля во фронте пламени до его значения в окружающем потоке. Концентрация продуктов максимальна во фронте.
| Рис. 3.11 Структура диффузионного ламинарного пламени |

В диффузионном ламинарном пламени температура достигает максимального значения в зоне горения. Вытекающий из горелки газ до поступления в зону горения нагревается за счет тепла, переносимого теплопроводностью и диффузией. В случае сжигания углеводородов их нагрев приводит к термическому разложению с образованием сажи и водорода. Находящиеся в пламени мелкодисперсные частицы сажи и свободного углерода, раскалившись за счет выделяемого при горении тепла, вызывают свечение пламени. Диффузионное горение частиц сажи протекает сравнительно медленно, в результате чего может возникнуть недожог топлива.
Высота ламинарного диффузионного пламени может быть рассчитана по формуле
 , (3.3)
, (3.3)
где W – скорость истечения газа; R – радиус соплового отверстия; D – коэффициент молекулярной диффузии.
Интенсивность диффузионного сжигания зависит от интенсивности смесеобразования. Поскольку массообмен при турбулентном течении пламени интенсивнее, чем при ламинарном, для промышленных условий более важным является способ турбулентного диффузионного горения. С увеличением скорости размеры факела растут, достигая некоторого максимума. Одновременно начинает теряться правильность очертаний и стабильность его вершины. Начинается турбулизация факела, захватывающая все большую его длину. По мере приближения турбулентного фронта к корню факела высота его несколько снижается, оставаясь дальше более или менее постоянной. По достижении некоторой критической скорости газовой струи весь факел становится турбулентным, и в дальнейшем при увеличении скорости высота факела не изменяется. Относительная высота турбулентного диффузионного факела рассчитывается по формуле
 , (3.4)
, (3.4)
где h – длина факела; d – диаметр устья горелки, V0 – теоретический объем продуктов сгорания; rв и rг – плотность воздуха и газа. Переход диффузионного факела от ламинарного режима горения к турбулентному наблюдается у разных газов при различных критериях Re, которое для водорода составляет 2200, для коксового газа - 3700-4000, для оксида углерода – 4750, для пропана и ацетилена - 8900-10400.
3.4. Горелки промышленных агрегатов
Основные характеристики горелок:
1. По давлению газа подразделяют на горелки:
· низкого давления – до 5 кПа (500 мм вод. ст.);
· среднего давления – 5 кПа–0,3 МПа; (500 мм вод. ст. – 30 м вод. ст.);
· высокого давления - более 0,30 МПа; (> 3 атм);
2. Тепловая мощность горелки рассчитывается как N=  .
.
3. Коэффициент предельного регулирования горелки по мощности n=Nmax/Nmin, который должен быть не менее 3. Коэффициент регулирования мощности пропорционален корню квадратному из отношения максимально и минимального давления перед горелкой: n~Bmax/Bmin~Wmax/Wmin; ~  . Для того чтобы коэффициент регулирования n был равен 3, должна быть возможность изменения давления в 10 раз.
. Для того чтобы коэффициент регулирования n был равен 3, должна быть возможность изменения давления в 10 раз.
4. Коэффициент избытка воздуха a (в том числе первичного и вторичного).
5. Номинальная относительная длина факела  , которая представляет собой расстояние от выходного сечения, выражения в калибрах горелки до точки, где концентрация СО2 составляет 95 % от max значения.
, которая представляет собой расстояние от выходного сечения, выражения в калибрах горелки до точки, где концентрация СО2 составляет 95 % от max значения.
6. Уровень шума допускается до 85 дБ.
Различают два основных типа - кинетические и диффузионные горелки.
В кинетических горелках осуществляется предварительное перемешивание газа с воздухом в пределах смесительной камеры, что позволяет сжигать топливо с минимальными значениями коэффициента избытка воздуха a = 1,02-1,05. Факел таких горелок слабосветящийся, стабилизация факела осуществляется за счет установки туннелей, тел плохообтекаемой формы, огнеупорных насадок и т.д. Недостаток таких горелок узкие пределы регулирования из-за возможности проскока пламени, а также невозможность подогрева воздуха более 500-600 °С.
В зависимости от способа приготовления смеси горелки делятся на две основные группы: дутьевые с вентиляторной подачей воздуха и инжекционные. В зависимости от способа подвода воздуха дутьевые горелки делятся на прямоточные и вихревые.
Инжекционные горелки
Газ поступает к соплу горелки, откуда вытекает с высокой скоростью, инжектируя необходимый для сгорания воздух непосредственно из атмосферы.

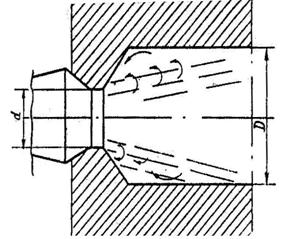
Рис. 3.12 Инжекционная горелка: 1 – сопло; 2 – камера смешения; 3 – насадок; 4 – кольцо, регулирующее подачу воздуха; 5 - диффузор
Образующаяся газовоздушная смесь поступает в диффузор, где за счет уменьшения скорости несколько увеличивается статическое давление, которое позволяет преодолевать сопротивление по тракту газовоздушной смеси. Подготовленная смесь из диффузора через насадок, который служит для предотвращения проскока пламени, поступает в камеру сгорания.
Преимущества инжекционных горелок:
· возможность работы без принудительной подачи воздуха;
· низкие избытки воздуха - a = 1,02-1,08, так как осуществляется полное предварительное смешение;
· автоматическое поддержание постоянства избытка воздуха при различных нагрузках.
Недостатки:
· расход газа не должен превышать 60 м3/ч (соответственно мощность не более 0,7 МВт). При больших расходах газа резко возрастет размер горелок и металлоемкость;
· повышенный уровень шума при В > 60 м3/ч.
Разработаны горелки с диаметром насадка от 15 до 235 мм и соответственно тепловой мощностью от 0,014 до 0,7 МВт. Горелки комплектуются туннелем из огнеупорного материала диаметром 2,5 d и длиной 6,5d. Насадок горелки, как правило, водоохлаждаемый. Относительная длина факела зависит от избытка воздуха: при a = 1,02 - L =6; при a = 1,5 – L = 2,5. Горелки Мосгазпроекта выпускают с пластинчатым стабилизатором, при этом отпадает необходимость в туннеле, который надо прогревать постепенно, что ограничивает быстрый набор мощности топки.
Дата добавления: 2021-01-20; просмотров: 305; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
