Б) Химические свойства кислорода
Тема: «Кислород – химический элемент и простое вещество».
 Дыхание – это синоним жизни, а источник жизни на Земле – кислород.
Дыхание – это синоним жизни, а источник жизни на Земле – кислород.
 Подчёркивая важность кислорода для земных процессов, Яков Берцелиус сказал: «Кислород – это вещество, вокруг которого вращается земная химия».
Подчёркивая важность кислорода для земных процессов, Яков Берцелиус сказал: «Кислород – это вещество, вокруг которого вращается земная химия».
Кислород – химический элемент
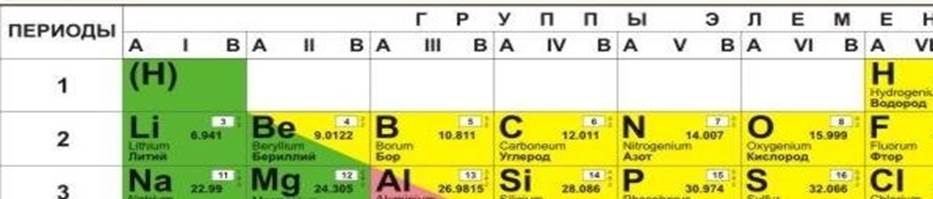 а) Характеристика химического элемента – кислорода по его положению в ПСХЭ
а) Характеристика химического элемента – кислорода по его положению в ПСХЭ

Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным порядковым номером 8. Обозначается символом O (лат. Oxygenium). Относительная атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
Б) Валентные возможности атома кислорода
В соединениях кислород обычно двухвалентен (в оксидах), валентность VI не существует. В свободном виде встречается в виде двух простых веществ: О2 («обычный» кислород) и О3 (озон). О2 — газ без цвета и запаха, с относительной молекулярной массой =32. О3 – газ без цвета с резким запахом, с относительной молекулярной массой, равной 48.
 в) Распространённость химического элемента кислорода в природе
в) Распространённость химического элемента кислорода в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 20 %, по массовой доле — около 65 %.
2.Кислород – простое вещество
А) Получение кислорода
Получение в лаборатории
1) Разложение перманганата калия (марганцовка):
2KMnO4 t˚C→ K2MnO4+MnO2+O2↑
2) Разложение перекиси водорода:
2H2O2 MnO2→ 2H2O + O2↑
3) Разложение бертолетовой соли:
2KClO3 t˚C , MnO2 →2KCl + 3O2↑
Получение в промышленности
1) Электролиз воды
2H2O эл. ток 2→H2 + O2↑
2) Из воздуха:
ВОЗДУХ давление, t=-183˚C → O2 (голубая жидкость)
В настоящее время в промышленности кислород получают из воздуха. В лабораториях небольшие количества кислорода можно получать нагреванием перманганата калия (марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:
· вытеснением воды;

 · вытеснением воздуха (кислород будет собираться на дне сосуда).
· вытеснением воздуха (кислород будет собираться на дне сосуда).
Существуют и другие способы получения кислорода.
Посмотрите видео-сюжет получение кислорода при разложении марганцовки (перманганата калия). Полученный кислород можно обнаружить на дне сосуда тлеющей лучинкой – она вспыхнет.
б) Химические свойства кислорода
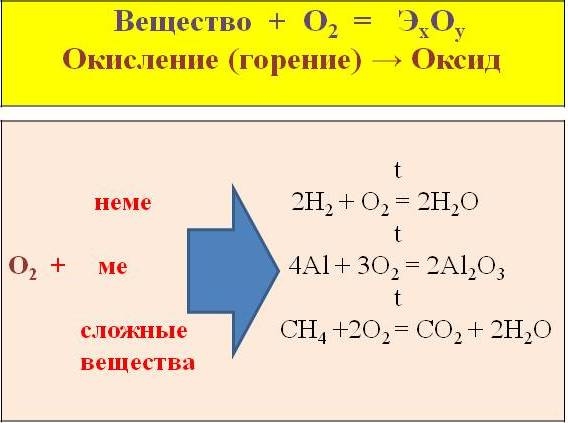
Взаимодействие веществ с кислородом называется окислением. В результате образуются оксиды – сложные вещества, состоящие из двух элементов, одним из которых является двухвалентный атом кислорода.
Реакции окисления, протекающие с выделением тепла и света, называют реакциями горения. Кислород взаимодействует с простыми веществами – металлами и неметаллами; а также со сложными веществами.
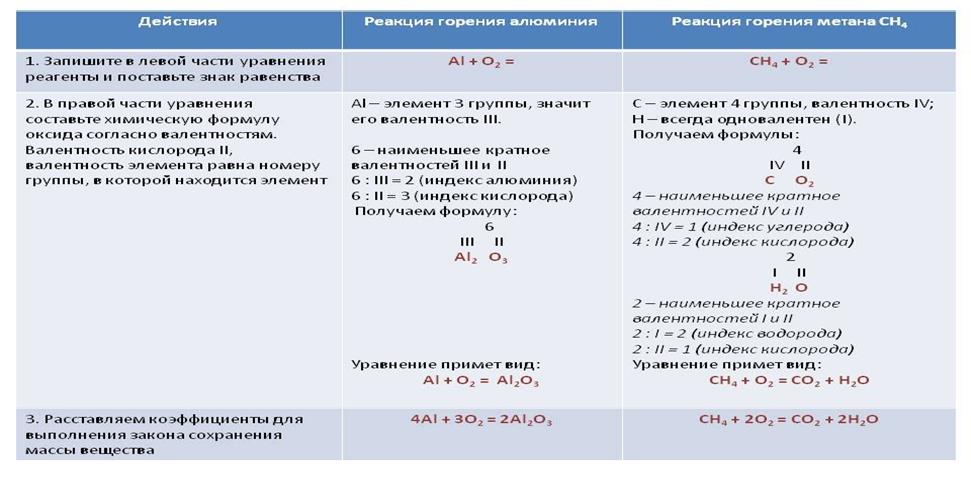
Изучите алгоритм составления уравнений реакций окисления на примере алюминия и метана CH 4.
Дата добавления: 2020-12-22; просмотров: 154; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
