На восстановление 4,56 г оксида трёхвалентного металла потребовалось 0,18 г водорода. Этот металл
Общая характеристика d- элементов»
I – вариант
1. В побочной подгруппе находится:
а) Pо; б) Cо; в) Al; г) В.
2. Заряд ядра атома меди равен:
а) +29; б) +1; в) +4; г) +64.
Какова электронная конфигурация атома цинка?
а) …3d104s1; б) …3d94s1; в) …3d104s2; г) …3d104s0.
4. Укажите степень окисления атома цинка в соединениях:
а) +1; б) +2;в) +3; г) +6.
5. Цинк – металл:
а) желтого цвета; б) синевато-белого цвета;
в) черного цвета; г) серовато-белого цвета.
6. Отметьте схемы осуществимых реакций:
а) Zn + HCl 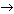 … ; б) Zn + NaOH
… ; б) Zn + NaOH 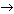 … ;
… ;
в) Zn + MgSO4 (р-р) 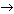 … ; г) Zn + Cl2
… ; г) Zn + Cl2 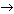 … .
… .
7. Cумма коэффициентов в уравнении реакции: ZnS + О2 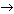 … равна:
… равна:
а) 8; б) 10; в) 9; г) 11.
Пользуясь электрохимическим рядом напряжений металлов, укажите металлы, вытесняемые цинком из растворов их солей.
а) Fe; б) Mg; в) Sn; г) Ag.
9. При взаимодействии цинка с концентрированной серной кислотой выделяется:
а) SO2; б) S; в) H2S; г) H2.
10. Оксид цинка обладает:
а) основными свойствами; б) кислотными свойствами;
в) амфотерными свойствами. г)
При восстановлении углеродом 32 г оксида железа (III) образовалась 21,28г железа. Выход железа
а) 85 %; б) 90 %; в)95 %;г) 98 %.
12. Формула оксида, образованного элементом со степенью окисления +2, если для растворения 4, 05 г его потребовалось 3,65 г соляной кислоты
а) СаО; б) ВаО; в) ZnO г) К2О.
13. Проявляет амфотерные свойства:
а) СаО; б) К2О; в) ZnO; г) Cr2O3.
При нагревании разлагается
а) NaOH б) KOH в) Ca(OH)2 г) Zn(OH)2.
Пластинка, покрывающаяся красным налётом в растворе сульфата меди (II)
|
|
|
а) железная; б) серебряная; в) золотая; г) платиновая
Гидроксид цинка может реагировать со всеми веществами в ряду
а) NaOH и H2O; б) HCl и H2SiO3; в) NaOH и HCl;г) H2SiO3 и H2SO4.
17. С раствором FeCl3 реагирует
а) Н2О; б) НСl; в) KCl; г) KOH
18. Соли железа Fe (II) в растворе можно определить с помощью;
а) K4[Fe(CN)6]; б) K3[Fe(CN)6]; в) H2S; г) NH4CNS.
Оксид железа (III) реагирует с веществами ряда
а) H2SO4 и H2O; б) H2SO4 и CuO; в) H2SiO3 и HCl; г) HCl и NaCl.
Железо вытеснит из раствора солей металл
а) Pb ; б) Co; в) Mn; г) Ag
Общая характеристика d- элементов»
II – вариант
1. В побочной подгруппе находится:
а) P; б) C; в) Al; г) Mn.
2. Число энергетических уровней в атоме меди:
a) 3; б) 4; в) 1; г) 2.
3. Цинк является:
а) s-элементом; б) p-элементом; в) d-элементом; г) f-элементом.
4. При взаимодействии цинка с водой при нагревании образуются:
а) ZnO и О2; б) Zn(ОН)2 и О2; в) ZnO и Н2; г) Zn(ОН)2 и Н2.
5. Цинк встречается в природе:
а) только в соединениях; б) только в свободном виде;
в) в соединениях и в свободном виде; г) не встречается в природе.
6. Укажите распределение электронов по энергетическим уровням для основного состояния цинка:
а) 2, 8, 10, 2; б) 2, 8, 18, 2; в) 2, 8, 18, 1; г) 2, 8, 18, 4.
7. Сумма коэффициентов в уравнении реакции: Zn + H2SO4 (конц.) 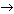 … равна:
… равна:
|
|
|
а) 6; б) 7; в) 4; г) 10.
Пользуясь электрохимическим рядом напряжений металлов, укажите металлы, вытесняемые цинком из растворов их солей.
а) Al;б) Pb;в) Ni; г) Cr.
9. Отметьте схемы осуществимых реакций:
а) ZnO + H2О 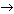 … ; б) ZnO + HCl
… ; б) ZnO + HCl 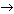 … ;
… ;
в) ZnO + NaOH 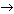 … ; г) ZnO + C
… ; г) ZnO + C 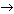 … .
… .
10. Гидроксид цинка обладает:
а) основными свойствами; б) кислотными свойствами;
в) амфотерными свойствами
11. Формула соединения, содержащего 68, 4% хрома и 31, 6% кислорода
а) CrO ; б) Cr2O3 в) CrO2; г) CrO3
На восстановление 4,56 г оксида трёхвалентного металла потребовалось 0,18 г водорода. Этот металл
а) Со; б) Са; в) Cr; г) Ва.
При нагревании разлагается
а) Ва ОН)2; б) Cu(OH)2; в) КОН; г) NaOH .
Кислотный оксид
а) CO; б) CrO3; в) Na2O; г) Fe2O3.
15. Формулы амфотерного гидроксида и кислоты соответственно:
а) Zn(OH)2 и NaOH ; б) NaOH и H2SO4; в) Zn(OH)2 и H2SO4;г) H2SO4 и NaOH.
16. Только при повышенной температуре с водой взаимодействует металл: а) натрий; б) калий; в) литий; г) железо.
17. С раствором ZnCl2 реагирует
а) Н2О; б) НСl; в) KOH; г) KCl
18. Соли железа Fe (III) в растворе можно определить с помощью;
а) K4[Fe(CN)6]; б) K3[Fe(CN)6]; в) H2S; г) NH4CNS.
Дата добавления: 2020-12-22; просмотров: 117; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
