ТЕМПЕРАТУРА. ТЕПЛОВОЕ РАВНОВЕСИЕ.
Внеаудиторное занятие по физике
Группа ИСП – 20.3
Преподаватель Т.Е.Тарасенко
Цель: выяснение понятий «идеальный газ», его свойств; средней квадратической скорости, абсолютной температуры; возникновение давления газа; формирование умений использования основного уравнения МКТ и сопутствующих ему формул для решения задач; умение работать со шкалой Кельвина; разбор примеров решения задач; систематизация знаний; формирование приёмов самостоятельного изучения материала; контроль знаний решением самостоятельной работы в двух вариатах.
Задание
1) первое знакомство с предоставленным материалом;
2) конспектирование прочитанного и изученного (с обязательными определениями, формулами с объяснением всех физических величин);
3) обязательно в конспекте должны быть примеры решения задач;
4) выполнение самостоятельной работы по вариантам (после примеров решения задач).
Оформление самостоятельной работы
1) самостоятельная работа
2) тема (основное уравнение МКТ);
3) фамилия, имя; номер группы; вариант;
4) текст первой задачи и ниже : дано, перевод в СИ и стандартный вид, решение, ответ;
5) затем текст второй задачи и т.д.
Задание сдать не позднее 14.00 часов 14.11.2020!!!
ИДЕАЛЬНЫЙ ГАЗ
Идеальный газ - это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало. Понятие "идеальный газ" вводится для математического описания поведения газов. Реальные разреженные газы ведут себя как идеальный газ!
|
|
|
Свойства идеального газа:
1) взаимодействие между молекулами пренебрежительно мало;
2) расстояние между молекулами много больше размеров молекул;
3) молекулы - это упругие шары; отталкивание молекул возможно только при соударении;
4) движение молекул - по законам Ньютона;
5) давление газа на стенки сосуда - за счет ударов молекул газа.
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
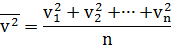
где n - число молекул в газе;
v - модули скоростей отдельных молекул в газе.
В теории газов часто используется понятие кинетической энергии молекул. Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
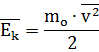 .
.
ОСНОВНОЕ УРАВНЕНИЕ МКТ ГАЗА
|
|
|
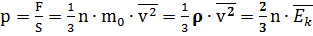
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р - давление, V - объем, Т - температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Выше приведены различные выражения для основного уравнения МКТ:
где р - давление газа на стенки сосуда(Па);
n - концентрация молекул, т.е. число молекул в единице объема (1/м3);
m0 - масса молекулы (кг);
V 2 - средний квадрат скорости молекул (м2/с2);
ρ - плотность газа (кг/м3);;
E k - средняя кинетическая энергия молекул (Дж).
Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
Дополнительные расчетные формулы по теме Формула для расчета концентрации молекул:
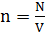
где N - число молекул газа;
V - объем газа (м3).
Формула для расчета плотности газа: 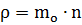
где mo - масса молекулы (кг);
n - концентрация молекул (1/м3).
Активная ссылка на источник «Класс!ная физика» обязательна: http://class-fizika.ru/10_27.html
ТЕМПЕРАТУРА. ТЕПЛОВОЕ РАВНОВЕСИЕ.
|
|
|
АБСОЛЮТНАЯ ШКАЛА ТЕМПЕРАТУР
ТЕМПЕРАТУРА
Температура - это мера средней кинетической энергии молекул. Температура характеризует степень нагретости тел.
Прибор для измерения температуры - термометр.
Принцип действия термометра
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры. В жидкостных термометрах - это изменение объема жидкости. При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой. В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35oС до +750oС) и спиртовые (от -80oС до +70oС). В них используется свойство жидкости изменять свой объем при изменении температуры. Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах. В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
|
|
|
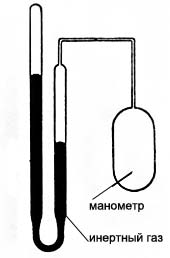
Этих недостатков лишены газовые термометры. Первый газовый термометр был создан французским физиком Ж. Шарлем. Преимущества газового термометра:
а) используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов;
б) точность измерения от 0,003oС до 0,02oС;
в) интервал температур от -271oС до +1027oС.
ТЕПЛОВОЕ РАВНОВЕСИЕ
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются. Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях.
Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго. Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е. для разреженных (идеальных) газов величина Ек зависит только от температуры, тогда 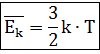
где k - постоянная Больцмана; 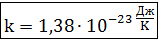
Эта зависимость дает возможность ввести новую температурную шкалу -абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
АБСОЛЮТНАЯ ШКАЛА ТЕМПЕРАТУР - введена английским физиком
У. Кельвином - нет отрицательных температур.
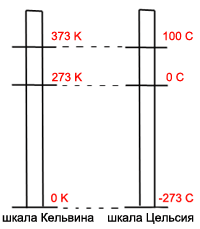
Единица абсолютной температуры в СИ: [T] = 1K (Кельвин) Нулевая температура абсолютной шкалы - это абсолютный ноль ( 0 0 К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура - 0,0001К. По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t»
. 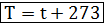
После введения абсолютной температуры получаем новые выражения для формул: средняя кинетическая энергия поступательного движения молекул; давление газа; основное уравнение МКТ;;средняя квадратичная скорость молекул.
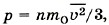 Р = nkT.
Р = nkT.
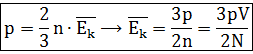
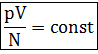
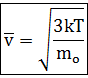
И, как следствие, закон Авогадро: В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул. Заметьте, здесь концентрация молекул также одинакова!
Запомните!!! Теперь при решении задач по МКТ температуру в 0 С всегда и обязательно переводить в абсолютную температуру в 0 К.
Пример.
1) 120 С; по шкале Кельвина Т = 12 + 273 = 285 К;
2) – 200 С; по шкале Кельвина Т = -20 + 273 = 253;
3) 2270 С; Т = 227 + 273 = 500 К;
4) -1730 С; Т = -173 + 273 = 100 К.
Активная ссылка на источник «Класс!ная физика» обязательна: http://class-fizika.ru/10_26.html
Примеры решения задач
Задача 1. Плотность газа в баллоне электрической лампы ρ = 0,9 кг/м2. При горении лампы давление в ней возросло с р1 = 8 • 104 Па до р2 = 1,1 • 105 Па.
На сколько увеличилось при этом значение среднего квадрата скорости молекул газа?
Решение
Произведение массы m0 одной молекулы на концентрацию молекул (число молекул в единице объёма) равно массе молекул, заключённых в единице объёма, т. е. плотности газа ρ = m0n.
Следовательно, основное уравнение молекулярно-кинетической теории (9.6) можно записать в виде Поэтому 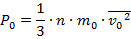 , тогда ѵ2 = 3Р0 /(nm0 ) = 3Р0 / ρ.
, тогда ѵ2 = 3Р0 /(nm0 ) = 3Р0 / ρ.
Р1 = nm0ѵ1 2 / 3, тогда ѵ1 2 = 3P1 / ρ;
P2 = nm0ѵ2 2 / 3, тогда ѵ2 2 = 3Р2 / ρ.
Значит ∆ѵ2 = 3Р2 / ρ – 3Р1 / ρ = (3(Р2 – Р1) ) / ρ =
= (3(1.1 * 105 – 0,8 * 105))/0,9 = 1 м2 / с2 .
Ответ. 1 м2 / с2.
Активная ссылка на источник «Класс!ная физика» обязательна: http://class-fizika.ru/10_a212.html
Задача 2.В ёмкости объёмом 1 л = 1 * 10-3 м-3 находится газ массой 5 г = 5 * 10-3 кг, частицы которого двигаются со скоростью 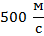 . Определить давление этого газа.
. Определить давление этого газа.
Эта задача также является задачей на основное уравнение МКТ, поэтому её решение начинается точно так же, как и решение предыдущей задачи:
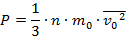
Или же, воспользовавшись одной из формул прошлого урока:
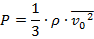
Однако теперь мы столкнулись с дополнительной сложностью, ведь мы не знаем, что за газ находится в сосуде, поэтому не можем воспользоваться табличными данными. Зато мы можем вспомнить определение плотности (масса единицы объёма) и в связи с этим записать
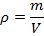
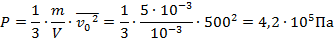
При подстановке данных мы не забыли перевести г в кг, а также л в 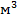 , учитывая, что
, учитывая, что 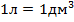 .
.
Задача 3. Чему равна температура газа, если при концентрации 2,65·1025 м-3 он создает давление 98,8 кПа? Ответ выразить в 0С.
Дано: n = 2,65⋅1025 м-3, p = 98,8 кПа = 98,8 * 103 Па, T−?
Решение
Воспользуемся формулой связи давления p с концентрацией молекул n и абсолютной температурой газа T: p = nkT.
В этой формуле k – это постоянная Больцмана, равная 1,38·10-23 Дж/К. Из этой формулы выразим искомую температуру T:
T = p/(nk).
Т = t + 273, тогда t = Т – 273.
Посчитаем численный ответ задачи: T=98,8⋅103 /( 2,65⋅1025⋅1,38⋅10–23 ) = 270,2К≈ –3∘C
Ответ: -3° C.
Источник: https://easyfizika.ru/zadachi/molekulyarnaya-fizika/chemu-ravna-temperatura-gaza-esli-pri-kontsentratsii-2-65x10-25-m-3-on-sozdaet/
Задача 4. Определить давление водорода, если средняя квадратичная скорость его молекул равна 2550 м/с, а концентрация молекул 3,6·1025 м-3.
Дано: ѵкв = 2550 м/с, n = 3,6⋅1025 м-3, p−?
Решение
Воспользуемся основным уравнением молекулярно-кинетической теории (МКТ) идеального газа: p = (m0nѵ2 ) / 3. Как вы и сами можете видеть, нам неизвестна только масса одной молекулы m0, входящее в это уравнение. Её можно найти, поделив молярную массу газа M (а она у водорода равна 0,002 кг/моль = 2 * 10-3 кг/моль) на число Авогадро NА (оно равно 6,022·1023 1/моль). m0 = M / NА . В итоге получается такая формула: p = (Mnѵ2 ) / 3NА. Произведем расчет ответа:
Р = (2 * 10-3 ⋅3,6⋅1025⋅25502 ) / (3 * 6,022⋅1023) = 259150Па ≈ 259кПа.
Ответ: 259 кПа.
Источник: https://easyfizika.ru/zadachi/molekulyarnaya-fizika/opredelit-davlenie-vodoroda-esli-srednyaya-kvadratichnaya-skorost-ego-molekul/
Самостоятельная работа
Вариант
Задача 1. Газ, находящийся по давлением 98,8 кПа, имеет концентрацию 2,65 * 1025 м-3 . Определить среднюю кинетическую энергию молекул.
Источник: https://easyfizika.ru/zadachi/molekulyarnaya-fizika/kakova-srednyaya-kineticheskaya-energiya-postupatelnogo-dvizheniya-molekul-gaza/
Задача 2. Какое значение температуры по шкале Кельвина соответствует температуре 100° C?
Источник: https://easyfizika.ru/zadachi/molekulyarnaya-fizika/kakoe-znachenie-temperatury-po-shkale-kelvina-sootvetstvuet-temperature-100-c/
Задача 3. Определить скорость движения частиц воздуха при нормальных условиях.
Из табличных данных: давление при нормальных условиях равно атмосферному давлению и обозначается 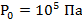 , плотность воздуха при нормальных условиях
, плотность воздуха при нормальных условиях 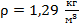 .
.
Вариант
Задача 1. Газ находится под давлением 200 кПа. Его молекулы движутся со скоростью
400 м/с. Масса одной молекулы 2.4 * 10-24 г. Определить концентрацию частиц этого газа.
Задача 2. Газ создаёт давление 2 * 106 Па. Его концентрация 4,4 * 1025 м-3 . Определить температуру газа и выразить её в 0 С.
Задача 3. Определить давление углекислого газа, если средняя квадратичная скорость его молекул 0,7 км/ с, а концентрация 3.8 * 1025 м-3 .
Дата добавления: 2020-12-22; просмотров: 219; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
