Железо, Кобальт, Никель и их соединения
Алюминий и его соединения
2Al + 6H2O = 2Al(OH)3↓ + 3H2↑ + 836 кДж (Алюминий амальгамированный! т.е. очищеный от оксидной пленки ртутью)
4Al + 3O2 (700°) = 2Al2O3 + 1676 кДж
2Al + Cr2O3 (800°) = 2Cr + Al2O3 + 539 кДж
10Al + 3V2O5 (900-1100°) = 5Al2O3 + 6V
2Al + 3F2 (600°) = 2AlF3
2Al (порошок) + 3Hal2 (25°) = 2AlHal3
2Al + 3S (150-200°) = Al2S3
2Al + N2 (800-1200°) = 2AlN
Al + P (500-800°) = AlP
4Al + 3C (1500-1700°) = Al4C3
8Al + 3(FeIIFe2III)O4 (>2000°) = 4Al2O3 + 9Fe (термитная смесь)
Al + H2 ≠
3Li[AlH4] + AlCl3 (в эфире) = 4AlH3 + 3LiCl
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H2SO4 (конц) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3 (конц) = Al(NO3)3 + 3NO2 + 3H2O
2Al + 3H2SO4 (разб) = Al2(SO4)3 + 3H2
Al + 4HNO3 (разб) = Al(NO3)3 + NO + 2H2O
8Al +30HNO3 (оч. разб.) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
2Al + 2NaOH + 6H2O (80°) = 2Na[Al(OH)4] + 3H2
2Al + 6NaOH (450°) = 2NaAlO2 + 3H2 + 2Na2O
8Al + 18H2O + 5KOH + 3KNO3 (100°) = 8K[Al(OH)4] + 3NH3↑
2Al2O3 + 9C (1800°) = Al4C3 + 6CO
Al2O3 + 6HCl (конц) (τ, 80°) = 2AlCl3 + 3H2O
Al2O3 + 2NaOH (900-1100°) = 2NaAlO2 + H2O
Al2O3 + 2NaOH + 3H2O (τ, 80°) = 2Na[Al(OH)4]
Al2O3 + CoO (1100°, KCl) = (CoAl2)O4 (синий)
Al2O3 + Na2CO3 (1000-1200°) = 2NaAlO2 (метаалюминат натрия) + CO2
Al2O3 + MgO (1600°) = (MgAl2)O4
Al2O3 + 6KHSO4 = Al2(SO4)3 + 3K2SO4 + 3H2O
Al(OH)3 (170-200°) = AlO(OH) + H2O
2AlO(OH) (360-575°)= Al2O3 + H2O
Al(OH)3 + KOH (конц) = K[Al(OH)4] (р) (на деле имеем K[Al(OH)4(H2O)2] )
Al(OH)3 + 3HCl (разб) = AlCl3 + 3H2O
Al(OH)3 + NaOH (1000°) = NaAlO2 + 2H2O
Al(OH)3 + 3HF (конц) + 3NaF = Na[AlF6]↓ + 3H2O (синтез криолита)
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
Na[Al(OH)4] + HCl = Al(OH)3 + NaCl + H2O
Na[Al(OH)4] (800°) = NaAlO2 + 2H2O
Na[Al(OH)4] (τ) = Al(OH)3↓ + NaOH (разбавление водой)
Na[Al(OH)4] + 4HCl = AlCl3 + NaCl + 4H2O
Na[Al(OH)4] + EO2 = Al(OH)3↓ + NaHEO3 (E = C, S)
3Na[Al(OH)4] + AlCl3 (конц) = 4Al(OH)3↓ + 3NaCl
2Na[Al(OH)4] + (NH4)2CO3 (100°) = 2AlO(OH)↓ + Na2CO3 + 2NH3↑ + 4H2O
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S
AlN + 3H2O = Al(OH)3↓ + NH3
AlP + 3H2O = Al(OH)3↓ + PH3
|
|
|
Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4
AlBr3 + 3KOH = Al(OH)3↓ + 3KBr
AlCl3 + 3NH3 + 3H2O (20°) = Al(OH)3↓ + 3NH4Cl
AlCl3 + 3NH3 + 3H2O (100°) = AlO(OH)↓ + 3NH4Cl + H2O
2Al(NO3)3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Сульфат алюминия - калия – алюмокалиевые квасцы
KAl(SO4)2*12H2O (120°) = KAl(SO4)2 + 12H2O
4KAl(SO4)2 (800-900°) = 2Al2O3 + 2K2SO4 + 6SO2 + 3O2
KAl(SO4)2 + 3KOH (конц) = K[Al(OH)4] + 2K2SO4
KAl(SO4)2 + 2Ba(NO3)2 = 2BaSO4↓ + Al(NO3)3 + KNO3
2KAl(SO4)2 + 3H2O + 3K2CO3 = 2Al(OH)3↓ + 3CO2↑ + 4K2SO4
2KAl(SO4)2 + 6H2O + 3K2S = 2Al(OH)3↓ + 3H2S↑ + 4K2SO4
KAl(SO4)2 + 4KOH (500°) = KAlO2 + 2K2SO4 + 2H2O
Благородные газы
238U 234Th + 4He
41H 4He + 2β+ + 2 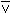
Xe + PtF6 = Xe[PtF6]
Xe + F2 = XeF2
Xe + F2O2 (-120°С) = XeF2 + O2
Xe + 2F2 (400°, 6 атм) = XeF4
Xe + 3F2 (250°, 50 атм) = XeF6
XeF2 + 2OH- = Xe + 1/2O2 + 2F- + H2O
2XeF2 + 4KOH = 2Xe + 4KF + O2 + 2H2O
5XeF2 + 2MnSO4 + 8H2O = 5Xe + 2H2SO4 + 10HF + 2HMnO4
XeF4 + Pt = PtF4 + Xe
XeF4 + 2Hg = 2HgF2 + Xe
6XeF4 + 12H2O = 2XeO3 + 24HF + 4Xe + 3O2
2XeF6 + SiO2 = 2XeOF4 + SiF4
XeF6 + H2O = XeOF4 + 2HF
XeF6 + RbF (-t°) = RbXeF7
2RbXeF7 (20°) = XeF6 + Rb2XeF8
2CsXeF7 (50°) = XeF6 + Cs2XeF8
Me2XeF8 (>400°) = Xe + 2Me + 4F2
H2XeF8 – октафторксеноновая кислота
XeO3 + H2O H2XeO4 H+ + HXeO4-
XeO3 + O3 + 4NaOH = Na4XeO6 + O2 + 2H2O
Ba2XeO6 + 2H2SO4(безводная, -t°) = 2BaSO4 + XeO4↑ + 2H2O
3XeO4 (t°>0°C, взрыв) = 2XeO3 + Xe + 3O2
Note Bene: KrF2, KrF4, RnF2, RnF4, RnF6, RnO3, Ar*6H2O, H6XeO6, H4XeO6, BaKrO4, Na4XeO6, Ba3XeO6, Na6XeO6, Ba2XeO6
Ванадий, Ниобий, Тантал и их соединения
4V + 5O2 = 2V2O5 (яд!)
2V + 5F2 = 2VF5
2V + 10HNO3 (конц, t°) = V2O5 + 10NO2 + 5H2O
V2O5 + 2KOH = 2KVO3 (метаванадат) + H2O
V2O5 + 4KOH = K2V2O7 (пированадат) + 2H2O
|
|
|
V2O5 + 6KOH = 2K3VO4 (ортованадат) + 3H2O
V2O5 + 6HCl (конц) = 2(VO)Cl2 (хлорид ванадила) + Cl2 + 3H2O
3V2O5 + 10Al = 6V + 5Al2O3
V2O5 + 6HCl (конц) = 2(VO)Cl2 + Cl2 + 3H2O
VO2 + H2SO4 = (VO)SO4 (сульфат ванадила) + H2O
4VO2 + 2NaOH = Na2V4O9 + H2O
2VCl2 + 2HCl (разб) = 2VCl3 + H2
2VCl3 + H2 (400°) = 2VCl2 + 2HCl
2VCl3 + H2SO4 (конц) = 2(VO)Cl2 + SO2↑ + 2HCl
(VO)SO4 + 3HCl + H0(Zn) = VCl3 + H2SO4 + H2O
10(VO)SO4 + 7H2O + 2KMnO4 = 5V2O5 + 2MnSO4 + 7H2SO4 + K2SO4
Шкала степеней окисления
+V V2O5 NH4VO3 Ca(VO3)2 Na3VO4 Ag2V2O7
+IV VO2 VO(OH)2 Na2VO3 K4VO4 Ca4V4O9
(VO)SO4 (VO)Cl2
+III V2O3 V(OH)3 KVO2 Cs[VCl4O]
V2(SO4)3 VCl3
+II VO V(OH)2 VSO4 VCl2
Nb и Ta содержатся в рудах вместе, принцип разделения основан на разнице кипения их хлоридов:
NbCl5 t°кип = 247,5° TaCl5 t°кип = 236°
NbF5 + 2HF = H2[NbF7]
H2[NbF7] + [O] = H2[NbOF7]
TaF5 + 2HF = H2[TaF7]
H2[TaF7] + [O] ≠
Бор. Борная кислота
[Промышленный способ получения (из буры):
[Na2B4O7*10H2O + H2SO4 = 4H3BO3↓ + Na2SO4 + 5H2O
[2H3BO3 (t°) = B2O3 + 3H2O
[B2O3 + 3Mg (t°) = 3MgO + 2B
2B + 3H2 ≠ (только косвенным путем)
4B + 3O2 (>700 °С) = 2B2O3
2B + N2 (>1200 °С) = 2BN (нитрид бора, огнеупорные материалы)
2B + 3F2 = 2BF3
2B + 3Cl2 (400 °С) = 2BCl3
2B + 3Br2 (600 °С) = 2BBr3
B + 2Ni = Ni2B
2B + 6KOH (t°) = 2KBO2 + 2K2O + 3H2
2B + 6H2O (пар) = 2H3BO3 + 3H2
B + 3HNO3 = H3BO3 + 3NO2
Mg3B2 + HCl = B2H6 B4H10 B5H11 B6H10 B10H11 Бораны – очень токсичные вещества
6MgB2 + 12HCl = H2 + B4H10 + 6MgCl2 + 8B
 диборан
диборан  тетраборан
тетраборан
B2H6 +6H2O = 2H3BO3 + 6H2
Note Bene: Cr4B Cr2B CrB Cr3B4 CrB2
|
|
|
BHal3 + 3H2O = H3BO3 + 3HHal
2BCl3 + 3H2 = 2B + 6HCl
BCl3 + NH3 = NH3─BCl3 (рассматривается как кислота Льюиса)
B2O3 + 3H2O = 2H3BO3 (B(OH)3 – в разной литературе по разному…)
H3BO3 H+ + H2BO3- 2H+ + HBO3- 3H+ + BO3- (k1=5,8*10-10 k2=4*10-13 k3=4*10-14)
4H3BO3 + 2NaOH = Na2B4O7 (тетраборат натрия) + 7H2O
H3BO3 + 3HOC2H5 = B(OC2H5)3 + 3H2O
Na2B4O7 + 10H2O = Na2B4O7*10H2O
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H3BO3
H3BO3 (t°) HBO2 + H2O↑
4HBO2 (t°) H2B4O7 + H2O↑
H2B4O7 (t°) 2B2O3 + H2O↑
Вода и Пероксид водорода
H2 + O2 = H2O «гремучая смесь» – 4-74% H2 по объему
NH3 + H2O NH3*H2O NH4OH
CuSO4 + 5H2O = CuSO4*5H2O
FeSO4 + 7H2O = FeSO4*7H2O
CuO + H2 = H2O + Cu
Cu(OH)2 (t°) = CuO + H2O
BaO + H2O = Ba(OH)2
P2O5 + 3H2O = 2H3PO4
CaCl2 + 6H2O = CaCl2*6H2O
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
2K + H2O = 2KOH + H2↑
2Al + 6H2O = 2Al(OH)3 + 3H2↑
3Fe + 4H2O (FeIIFe2III)O4 + 4H2↑
2Cl2 + 2H2O = O2 + 4HCl
2BaO + O2 (изб) (<500°) = 2BaO2
BaO2 + H2SO4 = BaSO4↓ + H2O2
3F2 + 3H2O = F2O↑ + 4HF + H2O2 (взрывной характер реакции)
Na2O2 + 2H2O = 2NaOH + H2O2
H2O2 + Cl2 = 2HCl + O2
2H2O2 (>150°, кат. MnO2) = 2H2O + O2
H2O2 (разб) + 2NaOH (разб) =NaHO2 + H2O
H2O2 + Ag2O = H2O + O2 + 2Ag
5H2O2 (30%) + I2 (т) = 2HIO3 + 4H2O
H2O2 (10%) + SO32- = SO42- + H2O
PbS (черн.) + 4H2O2 = PbSO4 (бел.)↓ + 4H2O
H2O2 + OH- + [Sn(OH)3]- = [Sn(OH)6]2-
H2O2 (конц) + Ag2O = 2Ag↓ + O2↑ + H2O

2H2O2 (конц) + Ca(ClO)2 = CaCl2 + 2H2O + 2O2↑
HNO2 + H2O2 = HNO3 + H2O
2NH3 + H2O2 = N2 + 6H2O
2HIO3 + 5H2O2 = 5O2 + I2 + 6H2O
Ba(OH)2 + H2O2 = BaO2 + 2H2O
2NaOH (т) + H2O2 (конц) (0°C) = Na2O2↓ + 2H2O
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
|
|
|
Водород
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
2CH4 + O2 2CO + 4H2
2H3O+ + 2e = H2↑ + 2H2O
2KH (t°) = 2K + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
CO + H2O CO2 + H2↑
CH4 + H2O (1000°) CO2 + 3H2
NaH + H2O = NaOH + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2↑
H2O + C H2 + CO
2H2 + O2 (550°) = 2H2O
3H2 + N2 (500°, p, кат. Fe, Pt) 2NH3
2H2 + CO (400°/300атм. ZnO/Cr2O3) → CH3OH
2Li + H2 = 2LiH
CH2=CH2 + H2 = CH3-CH3
CO + 2H2 CH3OH
CuO+H2 (150-250°) = Cu + H2O
H2 + Ca (500-700°) = CaH2
H2 (Ni) = 2H0
Mg + 2H+ = Mg2+ + 2H0 (водород in statu nascendi, лат. – в момент возникновения, время жизни 0,5 секунд)
5H0 + 3H+ + MnO4- = Mn2+ + 4H2O
2H0 (Zn, разб. HCl) + KNO3 = KNO2 + H2O
2H0 (Zn, разб. HCl) + O2 = H2O2
Использование амфигенов в щелочной среде
Zn + 2OH- + 2H2O = [Zn(OH)4]2- + 2H0
8H0 + KNO3 (100°) = NH3↑ + KOH + 2H2O
Реакция Зинина :
Fe + 2H+ = Fe2+ + 2H0
C6H5NO2 + 6H0 = C6H5NH2 + 2H2O
Галогенов соединения. Кислоты
В одном объеме воды можно растворить около 400 объемов HCl, 530 объемов HBr и около 400 объемов HI. Именно поэтому HCl и HF получают действием концентрированной (безводной!) серной кислоты на твердые галогениды:
KF + H2SO4(конц) = HF + KHSO4
KCl + H2SO4(конц) = HCl + KHSO4
Аналогично HBr и Hl получить не удается, т.к. они являются сильными восстановителями и окисляются концентрированной серной кислотой. Их получают иным способом (например, гидролизом галогенидов фосфора):
2P (красный) + 3Br2 + 6H2O = 6HBr + 2H3PO3
2P (красный) + 3I2 + 6H2O = 6HI + 2H3PO3
Ag+ + Hal- = AgHal↓
AgCl – белый, AgBr – желтовато-белого и AgI – ярко-желтого цвета осадок.
2NaNO3(насыщ) + CaCl2(насыщ) = 2NaCl(тв)↓ + Ca(NO3)2(р-р)
SiO2 + 4HF = SiF4↑ + 2H2O
2AgHal(тв) (hν) 2Ag(тв) + Hal2↑
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
6FeSO4 + KClO3 + 12KOH + 3H2O = 6Fe(OH)3↓ + KCl + 6K2SO4 (по последним данным вещество Fe(OH)3 не сушествует)
6FeSO4 + KClO3 + 12KOH = 3Fe2O3 + KCl + 6K2SO4 + 6H2O (Fe2O3*H2O)
6I2 + 6Ba(OH)2 = 5BaI2 + Ba(IO3)2 + 6H2O
6KClO3 + 5S + 2H2O = 3Cl2 + 3K2SO4 + 2H2SO4
5KBr + KBrO3 + 3H2SO4 = 3Br2 + 3K2SO4 + 3H2O
Галогены
F2 + 2Cl - = 2F - + Cl2
Cl2 + 2Br - = 2Cl - + Br2
Br2 + 2I - = 2Br - + I2
Фтор
2Al + 3F2 = 2AlF3 + 2989 кДж
2Fe + 3F2 = 2FeF3 + 1974 кДж
3F2 + 3H2O = F2O↑ + 4HF + H2O2 (взрывной характер реакции)
H2 + F2 = 2HF + 547 кДж
Hal2 + F2 = 2HalF
3BrF5 + Br2 = 5BrF3
2ClF3 + Br2 = 2BrF3 + Cl2
5ClF3 + 4I2 = 3IF5 + 5ICl
Note Bene: ClF, ClF3, ClF5, BrF3, BrF5, IF5, IF7
Si + 2F2 = SiF4 + 1615 кДж
Xe + F2 = XeF2 + 152 кДж
RClm + SbF3 = RClm-nFn (реакция Свартса)
C6H5NH2 (HNO2, HBF4) C6H5─N2+BF4- (t°) C6H5F + N2 + BF3 (реакция Шимана)
CHClF2 (t°, -HCl) CF2=CF2 (-CF2-)n
nC + 2nF2 CF4, C2F6, C3F8, C6F12, C6F12 (циклич.) – не ядовиты
nC (графит) + n/2F2 (200-450°) (CF)n «твердая смазка» (туда же MoS2 и графит)
(CF)n (t°) C + CF4 + C2F6 + C3F8
CaF2 + H2SO4 (конц., 96-99%) = CaSO4 + 2HF
HF (4000°) H + F (40% от общ.)
TlF3 + H2O = Tl(OH)3 + 3HF
 трифтор бороксин
трифтор бороксин
3R─Mg─Hal (реактив Гриньяра) + BF3 = R3B + 3Mg(Hal)F
Na2B4O7*10H2O + 6CaF2 + 8H2SO4 = 4BF3 + 2NaHSO4 + 6CaSO4 + 17H2
Na2B4O7*10H2O + 12HF = Na2[O(BF3)4] + 16H2O
2B2O3 + 12NH4F = (NH4)2[O(BF3)4] + 10NH3 + 5H2O
(NH4)2[O(BF3)4] + H2S2O7 = 4BF3 + 2H2SO4 + 2NH3 (H2S2O7 = H2SO4*SO3)
2(BO)n + 2nSF4 = nB2F4 (газ) + 2nSOF2
CH2=CH2 + B2F4 = F2BCH2CH2BF2
Note Bene: KBF4, NaBF4, NH4BF4
H3BO3 + 3HF HBF3(OH) + 2H2O
HBF3(OH) + HF HBF4 + H2O α20 (HBF4) = 1,38
Note Bene: AlF3*nH2O n=9, 3.5, 3, 1, 0.5
4Al + 6OF2 = 4AlF3 + 3O2
3CF2=CF2 + 2OF2 = 2CF3CF3 + 2COF2
3HF + Al(OH)3 = AlF3 + 3H2O
H2SiF6 + 2Al(OH)3 + 2H2O = 2AlF3*3H2O + SiO2
Al2O3*3H2O + H2SiF6 = 2AlF3 + SiO2 + 4H2O
SiO2 + 2CaF2 + 2H2SO4 = SiF4 + 2CaSO4 + 2H2O
3SiF4 + 2H2O = 2H2SiF6 + SiO2
3SiF4 + (x+2)H2O = 2H2SiF6 + SiO2*xH2O
SiF4 + 2NaF = Na2SiF6
SiF4 + 3RMgHal (реактив Гриньяра) = R3SiF + 3Mg(Hal)F
SiO2 + 6HF = H2SiF6 + H2O
Na2SiF6 + 6NaOH = 6NaF + Na2SiO3 + 3H2O
H2SiF6 + 2NaOH = Na2SiF6 + 2H2O
H2SiF6 + MgCO3 = MgSiF6 + CO2 + H2O
H2SiF6 + 2NaCl = Na2SiF6 + 2HCl
SiF62- + 2H2O SiO2 + 4H+ + 6F- K=5,4*10-27
H2SiF6 + 6NaOH + (x-4)H2O = 6NaF + SiO2*xH2O
3Na2SiF6 + 4Al (t°) = 2Na3AlF6 + 2AlF3 + 3Si Na3AlF6 – фторирование водопроводной воды
Note Bene: PF3, PF5, P2F4, O=PF3
Cu + 2NF3 = CuF2 + N2F4
SO2 + NF3 = SOF2 + NOF
SOF2 + 2NOF = SF4 + NO2 + NO
SO2 + 2NF3 = SO2F2 + N2F4
V2O5 + 3NF3 = 2VOF3 + 3NOF
VOF3 + NOF = NO+(VOF4)-
V2O5 + 6NOF = 2VOF3 + 3NO + 3NO2
N2F4 + N2O5 = ONNF2 + ...
N2F4 + SF4 = SF5NF5 + ...
P2O5 + 2HF + H2O = 2H2PO3F – монофторангидрид фосфорной кислоты
2NaOH + H2PO3F = 2H2O + Na2PO3F – компонент зубных паст

| 
| 
|
| Диизопропиловый эфир фторангидрида фосфорной кислоты | Зарин (смертоносный яд) | Натриевая соль фторангидрида фосфорной кислоты |
HPO2F2 + H2O = H2PO3F + HF (такие кислоты иногда называют сверхкислотами)
HSO3F – жидкость с t°кип 162,7°C и плотностью 1,7264 (25°), термически устойчива (до 900°).
S + 2HSO3F (t°) = 3SO2 + 2HF
NaCl + HSO3F = NaSO3F + HCl
MgCl2 + 2HSO3F = Mg(SO3F)2 + 2HCl
AlCl3 + 2HSO3F = ClAl(SO3F)2 + 2HCl
C6H6 + HSO3F C6H5SO2F + H2O C6H5SO3H + HF
C6H5SO2F + C6H6 = C6H5SO2C6H5
RNH2 + HSO3F = RNHSO3H + HF
RCOOH + HSO3F = RCOF + H2SO4
HF + SO3 = HSO3F η – 98,5%
2FClO3 (>470°) = 2FCl + 3O2
FClO3 + KOH = KClO4 + HF
FClO3 + AlCl3 ClO3+ + AlCl3F-
C6H6 + ClO3+ = C6H5ClO3 + H+
C6H6 + FClO3 (кат.: AlCl3) = C6H6ClO3 перхлорилбензол
KClO3 + F2 = FClO3 + KF
KClO4 + 2HSO3F = KF + H2SO4 + FClO3
KClO4 + 2HF + SbF5 (40-50°) = FClO3 + KSbF6 + H2O (лабораторный способ)
 Токсично! = COCl2
Токсично! = COCl2  Яд!
Яд!  10 x COCl2
10 x COCl2

Номенклатура фторуглеродных соединений:
1. В связи с тем, что весь водород может быть заменен фтором, применяют приставку перфтор, которая избавляет от перегруженности названия и его трудности в плане понимания:
CF3CF2CF2I перфтор – н – пропилиодид (1,1,1,2,2,3,3 – гептафторид – 3 – иодпропан)
2. В случае присутствия водорода (но не тогда когда его больше фтора!), его обозначают приставкой гидро, с указанием его положения:
CHF2CClFCF3 – 1 – гидро – 2 – хлор – перфторпропан
3. Часто названия дают исходя из функциональных групп (тут, правда, мне не все понятно):
C6F5NH2 – перфторанилин (а как же водород при азоте…)
CF2Br2 – 2 – бром – перфторметан
Цифровое обозначение фреонов:
1. Пишем фреон или букву F.
2. Указываем количество углерода минус один, если ноль то не пишем.
3. Указываем количество водорода плюс один.
4. Указываем количество фтора.
5. Наличие брома указывают буквой B с количеством атомов в соединении.
6. Циклическую структуру указываем буквой C.
7. Под остатком неиспользуемых атомов подразумеваем хлор.
8. Более распространенный изомер (в плане получения) помечаем буквой «а».
Фреон – 12B2; Фреон – 12; Фреон – 11; Фреон – 22; F – 113; F – 114B2; F – C318.
CClF2CClF2 F-114
CCl2FCClF2 F-113
CHClF2 F-22
Хлор
[2CaOCl2 + CO2 + H2O = CaCO3 + CaCl2 + 2HOCl
[2Cl2 + Ca(OH)2 = CaCl2 + Ca(OCl)2 + 2H2O (Хлорная известь)
2Cl2 + Si = SiCl4 (ж) + 662 кДж
3Cl2 + 2Al = 2AlCl3 (кр) + 1405 кДж
3Cl2 + 2Fe = 2FeCl3 (кр) + 804 кДж
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O (при нагревании)
Cl2 + 2HBr = 2HCl + Br2
Cl2 + 2HI = 2HCl + I2
Cl2 + 2KBr = 2KCl + Br2
3Cl2 + KBr + 6KOH = KBrO3 + 6KCl + 3H2O (горячая KOH)
Cl2 + 2NaOH = NaCl + NaClO + H2O (на холоде)
Cl2 + CH2=CH2 = CH2Cl─CH2Cl
Cl2 + CH3─CH3 = CH3─CH2Cl + HCl
Cl2 + H2 = 2HCl (г) + 185 кДж
Cl2 + H2O HCl + HClO – 25 кДж
Cl2 + HCOOH = CO2 + 2HCl
Cl2O + H2O = 2HClO
8HCl + K2MnO4 = 2Cl2 + 2KCl + MnCl2 + 4H2O
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2HCl + CaOCl2 = CaCl2 + Cl2 + H2O
Бром
Si + 2Br2 = SiBr4 (ж) + 433 кДж
2Fe + 3Br2 = 2FeBr3 + 538 кДж
H2 + Br2 = 2HBr (г) + 73 кДж
6KBr + K2Cr2O7 + 7H2SO4 = 3Br2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
Йод
Fe + I2 = FeI2 + 116 кДж
Fe + 2HI = FeI2 + H2
H2 + I2 2HI – 53 кДж
2HIO3 (t°) = I2O5 + H2O
Германий, Олово, Свинец и их соединения
Ge + 4H2SO4 = Ge(SO4)2 + 2SO2 + 4H2O
Ge + 4HNO3 = H2GeO3 + 4NO2 + H2O
Sn + 2NaOH + 2H2O = Na2[Sn(OH)4] + H2
SnO + 2HCl = SnCl2 + H2O
SnO + 2KOH + H2O = K2[Sn(OH)4]
Sn + 2H2SO4 = SnSO4 + SO2 + 2H2O
Sn + 4HNO3 = H2SnO3 + 4NO2 + H2O
5SnSO4 + 2KMnO4 + 8H2SO4 = 5Sn(SO4)2 + 2MnSO4 + K2SO4 + 2H2O
SnCl2 + H2O = Sn(OH)Cl↓ + HCl
SnCl2 + 2FeCl3 = SnCl4 + 2FeCl2
SnCl2 + HgCl2 + 2HCl = Hg + H2[SnCl6] см. также ртуть
Pb + 2NaOH + 2H2O = Na2[Pb(OH)4] + H2
2PbO + PbO2 (t°) = Pb3O4 – свинцовый сурик
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2H2O
Pb(OH)2 + KOH = K2[Pb(OH)4]
Железо, Кобальт, Никель и их соединения
Шкала степеней окисления
+VII FeO4
+VI FeO42- K2FeO4 BaFeO4
+III Fe3+ Fe2O3 FeO(OH) Fe2(SO4)3 FeCl3 NaFeO2 Na3[Fe(OH)6]
+II Fe2+ FeO Fe(OH)2 FeSO4 FeCl2 FeS
0 Fe
3Fe + 2O2 (160°) = (FeIIFe2III)O4
2Fe + 3Cl2 (200°) = 2FeCl3
Fe + S (600°) = FeS
Fe + 2S (700°) = FeII(S2-I)
3Fe + 4H2O (пар) (800°) = (FeIIFe2III)O4 + 4H2
2Fe + 3H2O (пар) (t°) = Fe2O3 + 3H2
Процесс ржавления (поэтапно):
( I ) 2Fe + 2H2O (влага) + O2 (τ) = 2Fe(OH)2
(II) 2Fe + 2H2O (влага) + O2 + 4CO2 (τ) = 2Fe(HCO3)2
Fe(HCO3)2 (τ) = Fe(OH)2 + 2CO2
(III) 4Fe(OH)2 + O2 + (2n-4)H2O (влага) (τ) = 2(Fe2O3*nH2O)
Fe2O3*nH2O (τ) = 2FeO(OH) + (n-1)H2O
(IV) Fe(OH)2 + 2FeO(OH) (τ) = 2H2O + (FeIIFe2III)O4 (ржавчина)
2Fe + 3Br2 = 2FeBr3
Fe + H2SO4 (разб) = FeSO4 + H2
2Fe + 6H2SO4 (конц) = Fe2(SO4)3 + 3SO2 + 6H2O
2Fe + 6HNO3 (конц) = Fe(NO3)3 + 3NO2 + 6H2O
Fe + 4HNO3 (разб) = Fe(NO3)3 + NO↑ + 2H2O
Fe + 2NaOH (50%) + 2H2O (100°) = Na2[Fe(OH)4]↓ + H2↑
Fe + 2KOH + 2KNO3 (420°) = K2FeO4 + 3KNO2 + H2O
Fe + 5CO (>150°) [Fe(CO)5] (250°) Fe + 5CO
2(FeIIFe2III)O4 (>1538°) = 6FeO + O2
(FeIIFe2III)O4 + 8HCl (разб) = FeCl2 + 2FeCl3 + 4H2O
(FeIIFe2III)O4 + 10HNO3 (конц) = 3Fe(NO3)3 + NO2 + 5H2O
4(FeIIFe2III)O4 + O2 (450-600°) = 6Fe2O3
(FeIIFe2III)O4 + 4H2 (1000°) = 4H2O + 3Fe (особо чистое)
(FeIIFe2III)O4 + CO (500-800°) = 3FeO + CO2
(FeIIFe2III)O4 + Fe (900-1000°) 4FeO
4FeO (560-700°) (FeIIFe2III)O4 + Fe
(FeIIFe2III)O4 + 8Al (>2000°) = 4Al2O3 + 9Fe
3Fe2O3 + C (t°) = 2(FeIIFe2III)O4 + CO
6Fe2O3 (1200-1300°) = 4(FeIIFe2III)O4 + O2
Fe2O3 + 6HCl (разб) (τ, 600°, p) = 2FeCl3 + 3H2O
Fe2O3 + 2NaOH (конц) (τ) = H2O + 2NaFeO2 (красн.) диоксоферрат (III)
Fe2O3 + MO = (MIIFe2III)O4 (M = Cu, Mn, Fe, Ni, Zn)
3Fe2O3 + H2 (400°) = 2(FeIIFe2III)O4 + H2O
Fe2O3 + 3H2 (1050-1100°) = 3H2O + 2Fe (особо чистое)
Fe2O3 + Fe (900°) = 3FeO
Fe2O3 + 3H2S (750°) = 2FeS + 3H2O + S
3Fe2O3 + CO (400-600°) = 2(FeIIFe2III)O4 + CO2
FeO – бертоллид (Fe0,89O, Fe0.91O, Fe0.93O)
FeO(OH) + 3HCl (разб) = FeCl3 + 2H2O
FeO(OH) (NaOH, 75°, τ) Na3[Fe(OH)6], Na5[Fe(OH)8]
2FeO(OH) + 3Ba(OH)2 + 2H2O (τ, 90°) = Ba3[Fe(OH)6]2↓ (желт.) – гексагидроксоферрат (III)
2FeO(OH) + Fe(OH)2 (600-1000°) = (FeIIFe2III)O4 + 2H2O
2FeO(OH) + 3H2 (500-600°) = 4H2O + 2Fe (особо чистое)
2FeO(OH) + 3Br2 + 10KOH = 2K2FeO4 + 6H2O + 6KBr
Fe(OH)2 (150-200°, в атм. N2) = FeO + H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)2 + 2HCl (разб) = FeCl2 + 2H2O
Fe(OH)2 + 2NaOH (>50%) = Na2[Fe(OH)4]↓ (сине-зеленый)
Fe(OH)2 + 2NH4Cl (конц) (τ, 100°) = FeCl2 + 2NH3 + 2H2O
4Fe(OH)2 (суспензия) + O2 (τ) = 4FeO(OH)↓ + 2H2O
2Fe(OH)2 (суспензия) + H2O2 (разб) = 2FeO(OH)↓ + 2H2O
Fe(OH)2 + KNO2 (конц) (60°) = FeO(OH)↓ + NO↑ + KOH
Fe(OH)3 + 3KOH = K3[Fe(OH)6]
Fe(OH)3 + 2HNO3 = FeOH(NO3)2 + 2H2O
Fe(OH)3 + HNO3 = Fe(OH)2NO3 + H2O
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
2FeCl3 + 3K2S = 2FeS + S + 6KCl
2FeS + 10H2SO4 (конц) = Fe2(SO4)3 + 9SO2 + 10H2O
2FeS + 36HNO3 (разб) = 10Fe2(SO4)3 + 10S + 3N2 + 18H2O
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
2Fe2(SO4)3 (t°) = 2Fe2O3 + 6SO2 + 3O2
Fe2(SO4)3 (500-700°) = Fe2O3 + 3SO3
4Fe(NO3)3 (t°) = 2Fe2O3 + 12NO2 + 3O2
4[Fe(NO3)3*9H2O] (600-700°) = 2Fe2O3 + 12NO2 + 3O2 + 36H2O
FeCO3 (490-550°) = FeO + CO2
4K2FeO4 (700°) = 4KFeO4 + 3O2 + 2K2O
4K2FeO4 + 6H2O (гор) = 4FeO(OH)↓ + 8KOH + 3O2↑
K2FeO4 + 2(NH3*H2O) (80°) = 2FeO(OH)↓ + N2↑ + 2H2O + 4KOH
K2FeO4 + 3C2H5OH (40°) = Fe2O3 + 3CH3C(H)O↑ + 4KOH + H2O
K3[Fe(CN)6], K4[Fe(CN)6] – красная и желтая кровяная соль, реактив для качественного определения ионов Fe2+ и Fe3+ соответственно (гексацианоферрат II и III).
K4[Fe(CN)6] + Fe3+ = KFeIII [FeII(CN)6]↓ + 3K+ – берлинская лазурь
K3[Fe(CN)6] + Fe2+ = KFeII [FeIII(CN)6]↓ + 2K+ – турнбуллевая синь
KFeII [FeIII(CN)6] KFeIII [FeII(CN)6] => одно и тоже вещество
Co3O4 + 4C = 3Co + 4CO
Co + H2SO2 = CoSO2 + H2
Co + 2HCl = CoCl2 + H2
CoCl2 + 2NaOH = Co(OH)2 + 2NaCl
2Co(OH)2 + Br2 + 2H2O = 2Co(OH)3 + 2HBr
Ni + H2SO4 = NiSO4 + H2
Ni + 4CO = Ni(CO)4
Кислород. Озон
2BaO2 (t°) = 2BaO +O2
2H2O2 (t°) = 2H2O + O2
2HgO (t°) = 2Hg + O2
2KClO3 (150-300°, кат. MnO2) = 2KCl + 3O2
2KMnO4 (200-240°) = K2MnO4 + MnO2 + O2
2KNO3 (400-520°) = 2KNO2 + O2
2Pb3O4 (t°) = 6PbO + O2
4K2Cr2O7 (t°) = 4K2CrO4 + 2Cr2O3 + 3O2
2HgO (450-500°) = 2Hg + O2
2H2S + 3O2 = 2SO2 + 2H2O
2H2S + O2 = 2S + 2H2O
2NO + O2 = 2NO2
C + O2 (600-700°) = CO2
2C + O2 (1000°) = 2CO
N2 + O2 2NO - Q
S + O2 (280-360°) = SO2
5O2 + 4P (240-400°) = 2P2O5
O2 + 4Li (>200°) = 2Li2O
O2 + Na (250-400°) = Na2O2
O2 + 2Hg (250-350°) = 2HgO (красн)
Атомарный кислород
KNO3 (t°) = KNO2 + O0 (кислород in statu nascendi, лат. – в момент возникновения)
O0 + C (графит) = CO2
3O2 (УФ-изл. или 250°, кат. MnO2, Pt) 2O3
Электрический разряд в озонаторе:
O2 2O0
O2 + O0 O3
O3 + MO2 = O2 + MO3 (озониды) (ниже 0°C, M = K, Rb, Cs)
4O3 + 4KOH = 4KO3 + O2 + 2H2O
O3 + NO NO2 + O2
O3 + H2O + Mn2+ = MnO2↓ + O2↑ + 2H+
4O3 + 3PbS (влажн.) = 3PbSO4
O3 (Al, Ag, Cl2) Al2IIIO3, (AgIAgIII)O2, ClVIO3
2KI + O3 + H2O = I2 + 2KOH + O2 (качественная реакция на озон)

H2C=CH2 + O3 = (H2CO)2O
Кремний. Оксиды. Силикаты. Силициды. Силаны
H2SiO3 H+ + HSiO3- (k1 = 2,2 *10-10)
H2SiO3 – метакремниевая кислота
H4SiO4 – ортокремневая кислота
H2Si2O5 – двуметакремниевая кислота
Si + O2 = SiO2
2Si + O2 = 2SiO
Si + SiO2 = 2SiO
4Si + S8 = 4SiS2
Si + C = SiC (карборунд)
3Si + 4HNO3 + 12HF = 3SiF4↑ + 4NO + 8H2O
Si + 2NaOH + H2O = Na2SiO3 + H2
3Si + 2MgO = Mg2Si + 2SiO
Si + 2Mg = Mg2Si
SiO2 + 2KOH = K2SIO3 + H2O
SIO2 + 4HF = SiF4 + 2H2O
SiO2 + CaO (t°) = CaSiO3
SiO2 + Na2CO3 (t°) = Na2SIO3 + CO2
6SiO2 + Na2CO3 + CaCO3 = Na2O*CaO*6SiO2 (стекло) + 2CO2↑
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
K2SiO3 + H2O 2KOH + H2SiO3↓ (жидкое стекло)
CaO*SiO2 + CO2 + H2O = CaSO3↓ + H2SiO3↓ (обычный цемент)
[Ca3SiO5 + H2O = Ca2SiO4 + Ca(OH)2 (портландский цемент)
[Ca2SiO4 + 4H2O = Ca2SiO4*4H2O
2CaH2 + Si = Ca2Si + 2H2
Ca2Si + 4HCl = 2CaCl2 + SiH4 (моносилан, запах плесени)
SinH2n+2 где n от 1 до 6
SiH4 + 2O2 = SiO2 + 2H2O (самопроизвольно воспламеняется)
SiH4 + 2KOH + H2O = K2SiO3 + 4H2
SiH4 + 2H2O = SiO2 + 4H2
SiH4 = Si + 2H2
2SiH3Cl + Ca = Si2H6
Кремневая органика – соединения, в которых углерод непосредственно связан с кремнием Si-C
Si(CH3)4 Si(C2H5)4 Si(CH3)3OCH3 Si(CH3)2(OCH3)2 – при гидролизе этих соединений получаются гидроксильные производные, которые далее могут конденсироваться с образованием полимерных соединений:

Высокомолекулярные соединения, содержащие группировки –Si-O-Si-O-, называют силиконами.
От соотношения количества радикальных групп и кремния зависят свойства силиконов:
R/Si > 2 – вязкие жидкости
R/Si ~ 2 – эластичные каучукоподобные массы
R/Si < 2 – твердые вещества с различной степенью жесткости
Дата добавления: 2020-12-22; просмотров: 103; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
