Влияние температуры на скорость химической реакции
Лекция 6.
Химическая кинетика. Скорость химических реакций.
Определение скорости химической реакции
Взаимодействие между ионами в растворах, в основном, протекает очень быстро. Скорость любой реакции можно определить на основании тех изменений, которые происходят за определенный отрезок времени. Скорость реакции обычно определяют по изменению концентрации исходных веществ или продуктов реакции в единицу времени.
Рассмотрим реакцию общего вида, протекающую при постоянной температуре и давлении:
А + В → АВ.
Обозначим концентрацию вещества А в момент времени τ0 через С0. По мере протекания реакция в некоторый момент времени τ1 (τ1 > τ0) концентрация вещества А уменьшится за счет образования продукта АВ и будет равна С1 (С1 < С0). За промежуток времени τ1– τ0 изменение концентрации вещества А равно С1 – С0, отсюда скорость реакции соответствует выражению:
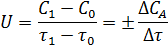
| (1) |
Скоростью химической реакции называют изменение концентрации реагирующих веществ в единицу времени. Концентрацию чаще всего выражают в моль/л.
Со временем концентрации реагирующих веществ уменьшаются и увеличиваются концентрации продуктов реакции.
Перед дробью ставится знак «-», когда наблюдается убыль концентрации исходных веществ, а знак «+», если за тот же промежуток времени концентрация продуктов реакции увеличивается.
|
|
|
Истинная скорость получается, если Δτ стремится к нулю.

| (2) |
Реакции проходят в гомогенных и гетерогенных средах. Реакция называется гомогенной, если она протекает в одной фазе. Фаза – часть системы, имеющая поверхность раздела, при переходе через которую свойства меняются скачкообразно.
Пример гомогенной реакции: СН4(газ) + 2О2(газ) → СО2(газ) + Н2О(пар)
Скоростью гомогенной реакции (Uгом) называют изменение количества вещества, участвующего в реакции, (Δn) за единицу времени (τ) в единице объема (V):
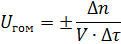
| (3) |
Для растворов:
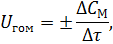
| (4) |
где: СМ – молярная концентрация.
Реакция в гомогенной среде протекает во всем объеме.
Реакция называется гетерогенной, если она протекает в двух или нескольких фазах. Гетерогенные реакции происходят на границе раздела фаз.
Пример гетерогенной реакции: СаО(тв) + Н2О(ж) → Са(ОН)2(тв)
Скоростью гетерогенной реакции (Uгет) называют изменение количества вещества, участвующего в реакции,(Δn) за единицу времени (τ) на единице поверхности (S):
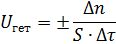
| (5) |
Основными параметрами, которые приходится учитывать почти во всех процессах, являются концентрация, температура, давление и действие катализаторов.
|
|
|
Влияние концентрации реагирующих веществ на скорость реакции
Взаимодействие между молекулами возможно лишь при условии их столкновения. Следовательно, чем чаще происходят эти столкновения в единицу времени, тем выше скорость реакции. Вероятность столкновения реагирующих частиц возрастает с увеличением их концентрации.
Влияние концентрации на скорость реакции выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих их стехиометрическим коэффициентам.
Для реакции аА + бБ = вВ + гГ закон действия масс записывается уравнением:
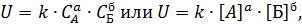
| (6) |
где: U – скорость химической реакции; СА, СБ, [А], [Б] – концентрации веществ А и Б; а, б – стехиометрические коэффициенты компонентов А и Б; k – константа скорости химической реакции.
По физическому смыслу константа скорости реакции – это скорость реакции, при концентрации каждого из реагирующих веществ равной единице. Чем больше константа скорости, тем быстрее идет реакция.
Например, для гомогенных процессов в газовой фазе:
N2 + 3H2 = 2NH3
U = k·[N2]·[H2]3
в растворе:
|
|
|
CH3COOH + C2H5OH = H2O + CH3COOC2H5
U = k·[CH3COOH]·[C2H5OH]
Гетерогенные реакции идут на поверхности раздела фаз, поэтому концентрация твердого тела остается практически постоянной и не входит в выражение закона масс.
Например, в гетерогенном процессе
2Са(тв) + О2(г) = 2СаО(г)
скорость реакции определяется концентрацией только газообразного вещества:
U = k·[O2]
Так как концентрация газообразного вещества пропорциональна его парциальному давлению, то можно записать:
U = k·РO2
Уравнения, показывающие зависимость скорости химической реакции от концентрации реагирующих веществ, называются кинетическими.
Пример.
Как изменится скорость прямой реакции 2NO + O2 = 2NO2, если: 1) увеличить давление в 3 раза; 2) увеличить объем в 2 раза; 3) уменьшить концентрацию окиси азота в 4 раза?
Решение:
Согласно закону действия масс
U1 = k·[NO]2·[O2]
Для простоты обозначим [NO] = а, [O2] = b, тогда начальная скорость реакции:
U1 = k·а2b
1) При увеличении давления в 3 раза концентрация каждого газа увеличится в 3 раза. Тогда скорость реакции:
U2 = k·(3а)2·3b = k·27а2b
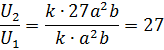
Ответ: скорость реакции увеличится в 27 раз.
2) При увеличении объема в 2 раза концентрация газов уменьшается в 2 раза. Тогда скорость реакции:
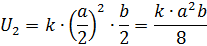

Ответ: скорость реакции уменьшится в 8 раз.
|
|
|
3) При уменьшении концентрации NO в 4 раза скорость реакции:
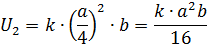
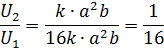
Ответ: скорость реакции уменьшится в 16 раз.
Влияние температуры на скорость химической реакции
Зависимость скорости химической реакции от температуры выражается приближенным правилом Вант-Гоффа: при повышении температуры на каждые 10 °С скорость реакции увеличивается в 2÷4 раза:
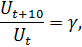
| (7) |
где: Ut – скорость реакции при температуре t°С; Ut +10 – скорость реакции при увеличении температуры на 10 °С; γ – температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °С.
В общем случае, при изменении температуры на t°С уравнение принимает вид:
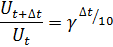
| (8) |
Пример.
Как изменится скорость коррозии металла при увеличении температуры с 20 °С до 40 °С, если температурный коэффициент равен 2.
Решение:
Согласно правилу Вант-Гоффа
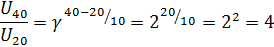
Ответ: скорость увеличится в 4 раза.
Дата добавления: 2020-12-22; просмотров: 677; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
