Самостоятельная работа на тему
ТЕМА 15: ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ.
Предельными одноосновными карбоновыми кислотами называют органические соединения, содержащие карбоксильную группу – СООН, связанную с углеводородным радикалом.
R – СООН – общая -формула одноосновных карбоновых кислот
Гомологический ряд одноосновных карбоновых кислот.
| предельные углеводороды | К арбоновые кислоты | по рациональной номенклатуре | по систематической номенклатуре |
| СН4 метан | Н – СООН | муравьиная | метановая |
| С2Н6 этан | СН3 – СООН | уксусная | этановая |
| С3Н8 пропан | С2Н5 – СООН | пропионовая | пропановая |
| С4Н10 бутан | С3Н7 – СООН | масляная | бутановая |
| С5Н12 пентан | С4Н9 – СООН | валериановая | пентановая |
| С6Н14 гексан | С5Н11 – СООН | капроновая | гексановая |
Физические свойства.
Молекулы карбоновых кислот подобно спиртам могут образовывать водородные связи друг с другом и с молекулами воды. С возрастанием молекулярной массы растворимость карбоновых кислот в воде падает.
Высшие кислоты в воде практически нерастворимы.
Кислоты с число атомов углерода в молекуле от 1 до 9 при комнатной температуре-жидкости с неприятным, раздражающим запахом. Высшие карбоновые кислоты запаха не имеют.
Химические свойства.
1. Кислотные свойства:
|
|
|
а) диссоциация

б)с металлами
2СН3СООН + Mg → (CH3COO)2Mg + H2
в) с основными оксидами
2СН3СООН + MgO → (CH3COO)2Mg + H2O
г) с основаниями
СН3СООН + NaOH → CH3COONa + H2O
д) с солями
2СН3СООН + CaCO3 → (CH3COO)2Ca + H2O + CO2
2.Реакция этерификации.
СН3 – СООН+ С2Н5ОН→ СН3 – СОО С2Н5 + H2O
3.Реакции по углеводородному радикалу.
СН3 – СООН + Cl2 → Cl – CH2 – COOH + HCl
хлоруксусная кислота
Получение и применение уксусной кислоты.
1. Окисление этанола.
С2Н5ОН + О2 → СН3СООН + H2O
1. Окисление ацеталъдегида.
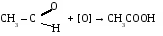
3. Окисление бутана.
2С4Н10 + 5О2 → 4СН3СООН + 2H2O
Основная часть получаемой уксусной кислоты используется для производства искусственных волокон и пластмасс на основе целлюлозы, для производства красителей, ядохимикатов.
ВЫСШИЕ КАРБОНОВЫЕ КИСЛОТЫ
С15Н31СООН – пальмитиновая кислота
С17Н35СООН – стеариновая кислота
С17Н33СООН – олеиновая кислота
С17Н31СООН – линолевая кислота
Высшие карбоновые кислоты вступают в те же реакции, что и другие кислоты.
Соли высших карбоновых кислот называются мылами.
Мыла.
Мыла - соли высших карбоновых кислот.
1. Моющие мыла.
С17Н35СООNa – твердое мыло
С17Н35СООK –жидкое мыло
Мыла проявляют свойства солей, то есть реагируют с кислотами, щелочами и растворами других солей, а также подвергаются гидролизу.
|
|
|
2C17H35COONa + BaCl2 → (C17H35COO)2Ba↓ + 2NaCl
2C17H35COO- + 2Na+ + Ba2+ + 2Cl- → (C17H35COO)2Ba↓ + 2Na+ + 2Cl-
2C17H35COO- + Ba2+ → (C17H35COO)2Ba↓
C17H35COONa + H2O → C17H35COOH↓ + NaOH
C17H35COO- + Na+ + H2O → C17H35COOH↓ + Na+ + OH-
C17H35COO- + H2O → C17H35COOH↓ + OH-
2. Немоющие мыла .
(C17H35COO)2Сa, (C17H35COO)3Al
Немоющие мыла используются для изготовления консистентных смазок (солидол) и для получения напалма.
СЛОЖНЫЕ ЭФИРЫ.
Производные карбоновых кислот, в которых атомы водорода карбоксильной группы замещены на углеводородные радикалы, называют сложными эфирами.
Общая формула сложных эфиров 
Физические свойства.
Сложные эфиры низших карбоновых кислот представляют собой летучие жидкости, многие из которых обладают приятным фруктовым или цветочным запахом. Они практически нерастворимы в воде.
Получение сложных эфиров.
В основе получения сложных эфиров лежит реакция этерификации между карбоновой кислотой и спиртом. Реакция катализируется сильными кислотами.

Химические свойства.
1. гидролиз

2. горение
2CH3 – CО – O – СH3 + 7О2 → 6СО2 + 6 H2O
уксуснометиловый эфир
ЖИРЫ
Жирами называют сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
|
|
|

1. Животные жиры.
Животные жиры обычно твердые вещества (исключение - рыбий жир). Животные жиры используются в пищу и для получения твердого мыла.
2. Растительные жиры (масла).
Растительные жиры обычно жидкие (исключение - пальмовое масло). Растительные жиры используются в пищу, для получения маргарина, для получения олифы.
Самостоятельная работа на тему
«КАРБОНОВЫЕ КИСЛОТЫ»
Вариант 1.
1. Составьте уравнения реакций по схеме:

2.Из 20 кг технического карбида кальция получили 5,6 м3 ацетилена. Определите %содержание СаС2 в карбиде кальция.
3.При гидратации этилена получили 28 г этанола, что составляет 80 %от теоретически возможного выхода. Какой объем этилена ввели в реакцию гидратации?
Вариант 2.
1. Составьте уравнения реакций по схеме:
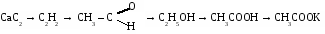
2.Из 40 г раствора этилового спирта получили 11,2 л этилена. Определите %содержание С2Н5ОН в растворе.
3.При гидратации ацетилена получили 16,5 г уксусного альдегида, что составляет 70 %от теоретически возможного выхода. Какой объем ацетилена ввели в реакцию гидратации?
Вариант 3.
1. Составьте уравнения реакций по схеме:
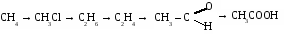
2.В реакцию «серебряного зеркала» ввели 3 г раствора формальдегида. При этом выделилось 1,08 г серебра. Определите %содержание альдегида в растворе.
|
|
|
3.При окислении метанола получили 22,5 кг формальдегида, что составляет 60 %от теоретически возможного выхода. Определите массу метанола, введенного в реакцию.
Вариант 4.
1. Составьте уравнения реакций по схеме:
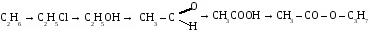
2.К 50 г раствора фенола добавили раствор гидроксида натрия. При этом получили 5,8 г фенолята натрия. Определите %содержание фенола в исходном растворе.
3.При окислении этанола получили 135 г уксусной кислоты, что составляет 90 %от теоретически возможного выхода. Определите массу этанола, введенного в реакцию.
Вариант 5.
1. Составьте уравнения реакций по схеме:

2.При взаимодействии 75 г раствора уксусной кислоты с магнием выделилось 2,8 л водорода. Определите % концентрацию исходного раствора кислоты.
3.При сбраживании глюкозы получили 41,4 кг этанола, что составляет 30 % от теоретически возможного выхода. Вычислите массу глюкозы, использованную для получения этанола.
Вариант 6.
1. Составьте уравнения реакций по схеме:
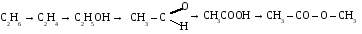
2.Из 120 м3 природного газа получили 150 кг формальдегида. Определите % содержание метана в природном газе.
3.При окислении бутана получили 168 кг уксусной кислоты, что составляет 70 %от теоретически возможного выхода. Определите объем бутана, введенного в реакцию.
| Вар.1 | Вар.2 | Вар.3 | Вар.4 | Вар.5 | Вар.6 | |
| № по журналу | 1,7,13,19,25 | 2,8,14,20 | 3,9,15,21 | 4,10,16,22 | 5,11,17,23 | 6,12,18,24 |
Дата добавления: 2020-12-12; просмотров: 90; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
