КЛАССИФИКАЦИЯ ПО НАПРАВЛЕНИЮ ПРОТЕКАНИЯ РЕАКЦИИ
ТИПЫ КЛАССИФИКАЦИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
Существует несколько подходов к классификации химических реакций:
· по числу и составу реагирующих и образующихся веществ
· по изменению степени окисления
· по агрегатному состоянию реагирующих веществ
· по тепловому эффекту
· по участию катализатора
· по направлению протекания реакции
Рассмотрим их подробнее.
КЛАССИФИКАЦИЯ ПО ЧИСЛУ И СОСТАВУ РЕАГИРУЮЩИХ И ОБРАЗУЮЩИХСЯ ВЕЩЕСТВ
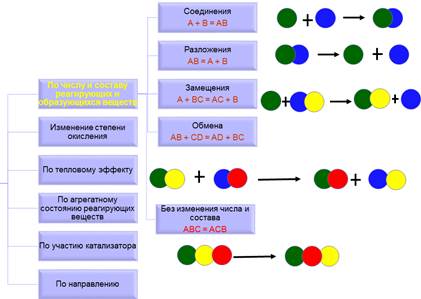
1) Соединения — из двух или нескольких веществ образуется одно сложное вещество:
Fe + S = FeS
(при нагревании порошков железа и серы образуется сульфид железа)
2) Разложения — из одного сложного вещества образуется два или несколько веществ:
2H2O = 2H2 + O2
(вода разлагается на водород и кислород при пропускании электрического тока)
3) Замещения — атомы простого вещества замещают один из элементов в сложном веществе:
Fe + CuCl2 = Cu↓ + FeCl2
(железо вытесняет медь из раствора хлорида меди (II))
4) Обмена — 2 сложных вещества обмениваются составными частями:
HCl + NaOH = NaCl + H2O
(реакция нейтрализации — соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия и воды)
КЛАССИФИКАЦИЯ ПО ИЗМЕНЕНИЮ СТЕПЕНИ ОКИСЛЕНИЯ
Окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степеней окисления элемента(ов). В любой окислительно-восстановительной реакции (ОВР) всегда должен быть как минимум один элемент, повышающий степень окисления (восстановитель), и другой — понижающий степень окисления (окислитель).
|
|
|
КЛАССИФИКАЦИЯ ПО АГРЕГАТНОМУ СОСТОЯНИЮ РЕАГЕНТОВ
Напомним, что существует четыре агрегатных состояния вещества: газ, жидкость, твердое и плазма (последнее встречается крайне редко).
Реакции, протекающие в одной фазе называются гомогенными, например реакция между двумя растворами или между двумя газами. Реакции, протекающие на границе раздела фаз, называются гетерогенными.
Граница раздела фаз присутствует в системе, образованной, например, жидкостью и твердым телом (металл и кислота), твердым телом и газом (гетерогенный катализ), двумя несмешивающимися жидкостями (масло и вода). Чаще всего химические реакции являются гетерогенными.
Агрегатное состояние вещества обычно обозначается буквами русского алфавита нижним индексом в скобках : (г) — газ, (ж) — жидкость, (т) — твердое.
КЛАССИФИКАЦИЯ ПО НАЛИЧИЮ КАТАЛИЗАТОРА
Катализатор — вещество, которое ускоряет скорость химической реакции, но само при этом не расходуется.
Ингибитор — вещество, замедляющее или предотвращающее протекание химической реакции.
Следует понимать, что катализатор участвует в реакции и претерпевает ряд изменений (каталитический цикл), превращается в промежуточные соединения, которые разрушаются к концу каталитического цикла, превращаясь в исходный катализатор. Поэтому иногда в учебниках встречается формулировка: "катализатор в реакции не расходуется".
|
|
|
Природные катализаторы - ферменты, способны в мягких условиях (например, t тела человека равна 36,6 градуса) способствовать тому, что биохимические процессы в организме протекают с эффективностью, близкой к 100%, в то время, как выход промышленных химических процессов редко составляет более 50%.
Ингибиторы используются в быту и в промышленности для подавления протекания нежелательных процессов: старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др. Например, ортофосфорная кислота замедляет процессы окисления железа (коррозию), поэтому ее используют для предотвращения ржавления. Часто ингибиторы используются в медицине, в лекарственных препаратах, например, ингибиторы образования ферментов и др
КЛАССИФИКАЦИЯ ПО НАПРАВЛЕНИЮ ПРОТЕКАНИЯ РЕАКЦИИ
Реакции, которые при заданных условиях протекают как в прямом, так и в обратном направлении, называют обратимыми.
Дата добавления: 2020-12-12; просмотров: 118; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
