Статистический характер второго закона термодинамики.
ЗАДАНИЕ К УРОКУ № 47
Дата 26.10.2020 Группа СЗ-112
Дисциплина/МДК/УП: Физика
Темы урока: Первый закон термодинамики
План занятия:
Задание:
1. Изучите материал с сайта РЭШhttps://resh.edu.ru/subject/lesson/4723/conspect/15577/ и учебника Мякишев «Физика» параграф 78,79,80
2. Достаточно только посмотреть и почитать.
3. По желанию можете сделать:
На оценку «3»
С сайта РЭШ перенести конспект в тетрадь https://resh.edu.ru/subject/lesson/4723/conspect/15577/ урок 24 класс 10 Первый закон термодинамики ( прикреплен ниже этого задания)
ИЛИ
Пройти тренировочные задания с сайта РЭШ урок 24 класс 10 https://resh.edu.ru/subject/lesson/4723/train/15584/ ( верно должно быть 8 из 14)
4. На оценку «4»
Прочитайте учебник Мякишев «Физика» углубленный уровень параграфы 78 стр 216 и 79 стр219 и 80 стр222
Ответьте на вопросы после параграфов, у Вас получится ответить на 8 вопросов. Можно копировать вставить на компьютере.
ИЛИ
Пройти тренировочные задания с сайта РЭШ урок 24 класс 10 https://resh.edu.ru/subject/lesson/4723/train/15584/ ( верно должно быть 10 из 14)
5. На оценку «5»
Пройти тренировочные задания с сайта РЭШ урок 24 класс 10 https://resh.edu.ru/subject/lesson/4723/train/15584/ ( верно должно быть 12 из 14)
6. Срок сдачи сегодня до 06.11.2020
Желаю плодотворной работы.
Конспект урока с сайта РЭШ
Физика, 10 класс
Урок 24. Первый закон термодинамики
Перечень вопросов, рассматриваемых на уроке:
1) закон сохранения энергии для термодинамических процессов;
|
|
|
2) связь изменения внутренней энергии газа с работой внешних сил и количеством теплоты, переданного термодинамической системе;
3) применение первого закона термодинамики к различным газовым процессам;
4) уравнение теплового баланса;
5) необратимость тепловых процессов.
Глоссарий по теме
Работа системы против внешних сил – это работа, которую совершает газ, преодолевая внешнее давление.
Адиабатный процесс – это процесс, протекающий в системе без теплообмена.
Необратимый процесс – Необратимым называется такой процесс, который самопроизвольно протекает только в одном направлении; в обратном направлении он протекает так, что система не проходит через те же состояния и не возвращается в исходное состояние.
Первый закон термодинамики – закон сохранения энергии для термодинамических систем.
Количество теплоты, сообщённое системе, равно сумме работы газа против внешних сил и изменения внутренней энергии системы.
Второй закон термодинамики определяет направление термодинамических процессов. Одна из формулировок второго закона: невозможен такой процесс, единственным результатом которого является переход тепла от менее нагретого тела к более нагретому телу.
|
|
|
Основная и дополнительная литература по теме урока:
Обязательная литература:
Мякишев Г. Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 216-224.
Рымкевич А.П. Сборник задач по физике. 10-11 класс. - М.: Дрофа, 2009.- С.81-89.
Основное содержание урока
Закон сохранения энергии, записанный применительно к термодинамической системе, выглядит следующим образом:
Q = A/ + ∆U,
где Q – количество теплоты, переданное системе;
A/ - работа системы (газа);
∆U - изменение внутренней энергии системы (газа).
Первый закон термодинамики: сообщенное системе количество теплоты расходуется на совершение системой работы против внешних сил и изменение внутренней энергии системы. Если работу совершают внешние по отношению к системе тела, то работа газа считается отрицательной, работа внешних тел положительной и А = - A/
Тогда первый закон термодинамики лучше написать в виде ∆U = Q + А.
Применение первого закона термодинамики к изопроцессам.
1. Изотермический процесс. Т = const.
∆T = 0; ∆U =0, Q = A/
1. Изохорный процесс.
∆V = 0; A/ = 0.
Q = ∆U.

1. Изобарный процесс.
Р = const; A/>0, ∆U>0
|
|
|
Q = ∆U + A/.
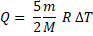
Используя уравнение Менделеева-Клапейрона, получим
υR(T2 – Т1) = P(V2-V1) = P∙∆V;
Подстановка в уравнение первого закона термодинамики количества теплоты дает

1. Адиабатный процесс.
Процесс, протекающий без теплообмена, т.е. Q = 0.
Тогда система может совершать работу либо за счет уменьшения внутренней энергии (газ расширяется) A/ = - ∆U, либо за счет работы внешних тел над системой (происходит сжатие газа) А = ∆U.
Уравнение теплового баланса.
Если в замкнутой системе тела обмениваются энергией и работа этими телами не совершается, то суммарное изменение внутренней энергии системы равно нулю; тогда соответственно равна нулю и сумма количеств теплоты, полученных или отданных телами системы,
Q1 +Q2 +Q3 +Q4 +...+Qn = 0
Первый закон термодинамики не определяет направление тепловых процессов. Необратимыми называются такие явления, которые самопроизвольно протекают только в одном направлении; в обратном направлении они протекают только при внешнем воздействии.
Формулировка второго закона термодинамики: невозможно перевести тепло от менее нагретого тела к более нагретому телу при отсутствии других одновременных изменений в обеих системах или в окружающих их телах (или невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого, к телу более нагретому).
|
|
|
Статистический характер второго закона термодинамики.
Состояние макроскопической системы (например, газ в баллоне) может быть реализовано огромным числом микросостояний (комбинацией в расположении молекул). Вероятность того, что первоначально находившийся в какой-либо части объёма газ весь снова соберется в какой-то момент времени в той же его части очень мала. А при очень большом числе частиц - ничтожно мала.
Вероятность обратимых процессов, наоборот, тем больше, чем меньше число частиц в системе. Поэтому справедливость второго закона термодинамики определяется достаточно большим объёмом и достаточно большим числом частиц системы. Так, например, ничтожно мала (реально равна 0) вероятность того, что спокойно висящий маятник начнет раскачиваться в результате одновременного, направленного в одну сторону удара всех молекул воздуха, до какого-то момента, двигавшихся хаотично по всем сторонам.
Направление термодинамических процессов определяется вторым законом термодинамики. Первый и второй законы термодинамики позволяют сделать заключение о невозможности создания вечного двигателя I и II рода.
Разбор тренировочных заданий
1. Гелий, находящийся в сосуде под подвижным поршнем, изотермически сжимают. Начальное давление газа p0, а его объём V0. Масса газа в сосуде остаётся неизменной. Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от объёма V газа. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца.
| ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ | ФОРМУЛЫ |
| А) Давление P(V) | 1. 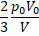
|
| Б) Внутренняя энергия U(V) | 2. 
|
3. 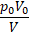
| |
4. 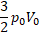
|
Решение: В изотермическом процессе p0V0 = pV; откуда 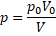 . В этом процессе сохраняется внутренняя энергия. Для одноатомного газа:
. В этом процессе сохраняется внутренняя энергия. Для одноатомного газа:
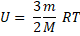
Из уравнения Менделеева-Клапейрона:
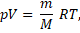
но p0V0 = pV, тогда:
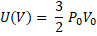
Правильный ответ: А – 3, Б – 4.
2. Чему равна внутренняя энергия 2 молей идеального одноатомного газа при температуре 1270С? R = 8,31Дж/(моль·К).
Решение: Переведём температуру в СИ:
Т = 127 + 273 = 400 К.
Формула для вычисления внутренней энергии одноатомного идеального газа:
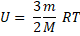
Известно, что число молей 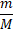 равно двум, подставим численные значения величин в формулу:
равно двум, подставим численные значения величин в формулу:
U = (3/2) · (2 моля) · 8,31 (Дж/моль·К) · 400 К = 9972 Дж.
Ответ: U = 9972 Дж.
Дата добавления: 2020-11-29; просмотров: 63; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
