Что касается элементов побочных подгрупп, то все они металлы.
Опорный конспект
Тема:Положение металлов в Периодической системе Д.И. Менделеева
Я твердый, ковкий и пластичный,
Блестящий, нужный всем, практичный.
Я вам уже подсказку дал,
Так кто же я такой…?
Цель урока:
формирование системы знаний о положение металлов в Периодической системе и их общих свойствах.
1.Положение в периодической системе:
Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали В (бор) — (кремний) — Si (мышьяк) — Те (теллур) — Аs (астат) (проследите ее в таблице Д. И. Менделеева)..
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) энергетического уровня, превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром. Атомы металлов имеют сравнительно большие размеры (радиусы), поэтому и их внешние электроны значительно удалены от ядра и слабо с ним связаны. И вторая особенность, которая присуща атомам наиболее активных металлов, — это наличие на внешнем энергетическом уровне 1—3 электронов.
Атомы металлов имеют сходство в строении внешнего электронного слоя, который образован небольшим числом электронов (в основном не больше трех).
Это утверждение можно проиллюстрировать на примерах Na, алюминия А1 и цинка Zn.
|
|
|
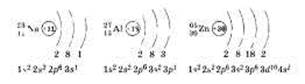
В связи с тем, что электроны внешнего слоя атомов металлов слабо связаны с ядром, они могут быть «отданы» другим частицам, что и происходит при химических реакциях:
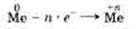
Свойство атомов металлов отдавать электроны является их характерным химическим свойством и свидетельствует о том, что металлы проявляют восстановительные свойства.
Металлы главной подгруппы I группы называются щелочными металлами. Свое название они получили от названия соответствующих им гидроксидов, хорошо растворимых в воде, — щелочей. Щелочные металлы являются типичными металлами, обладающими сильной восстановительной способностью (их атомы содержат на внешнем уровне один электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильнейшими восстановителями). Понятно, что в соответствии с ростом радиуса атома восстановительные свойства щелочных металлов усиливаются от лития к францию.
Следующие за щелочными металлами элементы, составляющие главную подгруппу II группы, также являются типичными металлами, обладающими сильной восстановительной способностью (их атомы содержат на внешнем уровне два электрона). Из этих металлов кальций, стронций, барий и радий называют щелочноземельными металлами. Такое название эти металлы получили потому, что их оксиды, которые алхимики называли «землями», при растворении в воде образуют щелочи. Понятно, что в соответствии с ростом радиуса атома восстановительные свойства металлов II группы усиливаются от магния к радию.
|
|
|
К металлам относятся и элементы главной подгруппы III группы, исключая бор. К III группе относятся металлы называемые подгруппой алюминия. Они (простые вещества ) также являются восстановителями (их атомы содержат на внешнем уровне три электрона). Понятно, что в соответствии с ростом радиуса атома восстановительные свойства металлов III группы усиливаются от алюминия вниз.
Из элементов главных подгрупп следующих групп к металлам относят: в IV группе германий, олово, свинец(32,50,82) (первые два элемента — углерод и кремний — неметаллы), в V группе сурьма и висмут(51,83) (первые три элемента — неметаллы), в VI группе только последний элемент — полоний(84) — явно выраженный металл. В главных подгруппах VII и VIII групп все элементы — типичные неметаллы.
Что касается элементов побочных подгрупп, то все они металлы.
Дата добавления: 2020-11-29; просмотров: 63; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
