Электрическая проводимость растворов электролитов
Лекция 18.11.20
Законы Фарадея
Окислительно-восстановительный процесс, протекающий в электрохимической системе под действием электрического тока, подводимого через электронный проводник от внешнего источника тока, называют электролизом, а электрохимическую систему - электролизером. Исследуя прохождение электрического тока через растворы и образование продуктов на электродах во время электролиза, М. Фарадей в 1833-1834 гг. установил количественные зависимости, которые были сформулированы в форме законов электролиза.
Электрод, на котором протекает реакция окисления, в случае электролиза положительный электрод, называют анодом, а электрод, на котором протекает реакция восстановления, в случае электролиза отрицательный электрод - катодом. Электролит у анода называют анолитом, электролит у катода – католитом.
Первый закон электролиза можно сформулировать следующим образом. Массы веществ, выделившихся на электродах при прохождении электрического тока через электрохимическую систему, прямо пропорциональны величине тока и времени его протекания, т.е. прямо пропорциональны количеству прошедшего электричества.
m теор = k э I t = k э Q, (1.1)
где m теор – масса выделившегося вещества в [г]; k э – электрохимический эквивалент вещества [г/А × с] = [г/Кл]; I – величина тока [А]; t - время [с]; Q – количество пропущенного электричества [Кл].
|
|
|
Второй закон электролиза можно сформулировать следующим образом. При прохождении через различные электролиты одного и того же количества электричества массы образовавшихся на электродах веществ – продуктов окислительно-восстановительных реакций пропорциональны химическим эквивалентам этих веществ.
Таким образом,
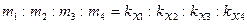 , (1.2)
, (1.2)
где m1, m2, m3, m4 – массы веществ, выделившихся на электродах; 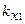 ,
, 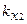 ,
, 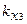 ,
, 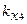 – химические эквиваленты веществ.
– химические эквиваленты веществ.
Согласно (1.1) 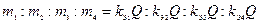 ,
,
отсюда
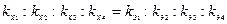 (1.3)
(1.3)
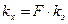 , (1.4)
, (1.4)
где F – фарадей – количество электричества, равное 96485 Кл/моль – постоянная Фарадея.
Учитывая (1.1) и (1.4), получим общее уравнение для первого и второго законов Фарадея:
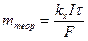 , (1.5)
, (1.5)
согласно которому для выделения на электроде одного эквивалента вещества через электрохимическую систему необходимо пропустить 96485 Кл или 26,8 А × ч электричества.
Для точного определения количества электричества, проходящего через электрохимическую систему, разработаны приборы – кулонометры, принцип действия которых основан на законах Фарадея.
Для характеристики степени использования протекающего тока на выделение на электроде нужного нам вещества используется понятие выхода по току (h). Выход вещества по току – отношение массы вещества (m), выделившего на электроде к теоретической массе, рассчитанной по закону Фарадея (1.23):
|
|
|
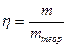 . (1.6)
. (1.6)
Часто выход по току выражают в процентах, умножая h на 100.
При электролизе наблюдаются не только разряд ионов на электродах и выделение веществ, но и непрерывное направленное движение ионов в электролите. Ионы двигаются в растворе согласно линиям тока, иначе происходили бы взаимные столкновения и накопления ионов в отдельных областях электролита. Уже Фарадей ясно представлял себе этот механизм электролиза, так как введенный им термин «ион» означает перемещающийся. Сравнивая поток положительного электричества с низвергающимся с высоты водопадом, Фарадей назвал переносимые им ионы – «катионами» (перемещающийся к низу), а противоположные – «анионами» (перемещающийся к верху).
Катионы и анионы, имея противоположные знаки заряда, двигаясь навстречу друг другу, обеспечивают прохождение тока через электролит
I = I+ + I−, (1.7)
где I+ и I− - величины тока, переносимые катионами и анионами.
|
|
|
Долю тока, переносимого данным сортом ионов, называют числом переноса данного сорта ионов
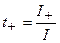 и
и 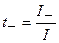 , (1.8)
, (1.8)
где t+ и t− – числа переноса катионов и анионов.
Из уравнения (1.8) следует
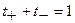 . (1.9)
. (1.9)
Более подробно процессы, протекающие при электролизе, нами будут рассмотрены ниже. Изложенное в этом разделе необходимо нам лишь для того, чтобы иметь представление об эффектах, сопровождающих прохождение тока через электролит.
Электрическая проводимость растворов электролитов
Электрическая проводимость c – скалярная физическая величина, введенная для количественного оценивания способности проводника пропускать ток и равная отношению величины тока I в проводнике к напряжению U на концах этого проводника
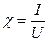 . (1.10)
. (1.10)
c – величина, обратная электрическому сопротивлению c = 1/R, её размерность [Ом-1] = [См - сименс].
Проводимость – величина экстенсивная, то есть зависящая от размеров проводника. Для того, чтобы исключить размеры проводника и количественно оценить способность проводника пропускать ток, введена скалярная физическая величина – удельная проводимость k, равная отношению произведения провод проводимости c проводника и его длины l к поперечному сечению S проводника:
|
|
|
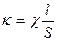 . (1.11)
. (1.11)
Из формулы (1.11) следует, что размерность удельной проводимости [См × м-1 или Ом-1×см-1].
Зависимости удельной проводимости водных растворов некоторых электролитов от концентрации приведены на рис. 1.1. Как видно из рис. 1.1, при с ® 0 величина удельной проводимости электролитов приближается к значению проводимости чистой воды, которая составляет приблизительно 10-5 См × м-1 и обусловлена присутствием ионов H3O+ и OH-, возникающих в результате диссоциации воды: 2H2O = H3O+ + OH-. С увеличением концентрации электролита удельная проводимость вначале возрастает, что связано с увеличением числа ионов в растворе, а затем уменьшается. Чем больше ионов в растворе, тем сильнее проявляется ион-ионное взаимодействие, приводящее к изменению структуры раствора, к замедлению движения ионов. Поэтому зависимости удельной проводимости водных растворов электролитов от концентрации могут характеризоваться максимумом. Иногда, вследствие ограниченной растворимости, фиксируют лишь восходящую ветвь кривой (рис. 1.1).
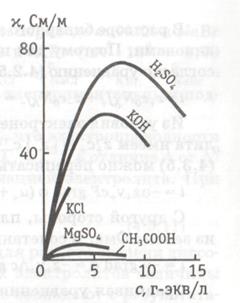
Рис. 1.1. Зависимость удельной электропроводимости
водных растворов сильных электролитов от концентрации
За небольшим исключением, удельная проводимость водных растворов электролитов увеличивается с повышением температуры и удовлетворительно описывается уравнением:
kt = k25[1 + k(t – 25)], (1.12)
где k25 – проводимость при 25 оС; t – температура, при которой рассчитывают удельную проводимость kt; k – температурный коэффициент проводимости.
Электролиз воды
Поскольку электрическая проводимость чистой воды невелика, рассмотрим электролиз подкисленной и подщелаченой воды, для этого добавим к воде небольшое количество серной кислоты или гидроксида калия. В качестве электронных проводников используем платину – металл химически инертный по отношению к электродным процессам, протекающим при электролизе.
Кислый электролит.
На катоде 2H+ +2e = H2.
На аноде H2O = 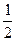 O2 + 2H+ + 2e.
O2 + 2H+ + 2e.
Суммарный процесс H2O = H2 + 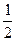 O2.
O2.
Щелочной электролит.
На катоде 2H2O +2e = 2OH- +H2.
На аноде 2OH- = H2O + 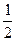 O2 + 2e.
O2 + 2e.
Суммарный процесс H2O = H2 + 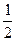 O2.
O2.
Таким образом, при электролизе воды прдуктами электролиза являются водород и кислород.
Дата добавления: 2020-11-29; просмотров: 44; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
