I . Реакции по карбоксильной группе
Гидроксикислоты.
Понятие о гидроксикислотах. Классификация и номенклатура.
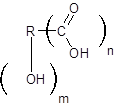 Гидроксикислоты – это производные карбоновых кислот, у которых один или несколько атомов водорода в радикале замещены соответствующим числом гидроксильных групп.
Гидроксикислоты – это производные карбоновых кислот, у которых один или несколько атомов водорода в радикале замещены соответствующим числом гидроксильных групп.
Общая формула гидроксикислот:
где n – количество карбоксильных групп, m – гидроксильных.
В зависимости от количества карбоксильных групп гидроксикислоты подразделяют наодноосновные(один карбоксил), двухосновные (два карбоксила), трёхосновные (три карбоксила) и т.д.

Молочная кислота СН3СНОН―СООН является одноосновной кислотой,

яблочная НООС―СНОН―СН2―СООН – двухосновной
винная НООС―СНОН―СНОН―СООН – двухосновной
По взаимному расположению фунцкциональных групп различают α-, β-, γ-, δ-гидроксикислоты и т.д. Буквы греческого алфавита указывают положение гидроксильной группы относительно карбоксильной, отсчет ведется от атома С-2. В заместительной номенклатуре ИЮПАК для замещенных карбоновых кислот локанты α-, β-, γ- и т.д. не употребляются.
При названии гидроксикислот по заместительной номенклатуре указывается название соответствующей карбоновой кислоты по этой же номенклатуре, а наличие гидроксильной группы показывается в виде префикса гидрокси - с наличием цифры, обозначающей местоположение этой группы. Так, гликолевая кислота по этой номенклатуре будет названа 2-гидроксиэтановая, молочная кислота – 2-гидроксипропановая, а яблочная кислота – 2-гидроксибутандиовая.
|
|
|
В фармакологической практике чаще всего употребляют тривиальные названия гидроксикислот.
| Формула | Тривиальное название кислоты | Название солей и сложных эфиров |
| | Молочная | Лактаты |
| | Яблочная | Малаты |
| | Винная | Тартраты |
| | Лимонная | Цитраты |
Гликолевая кислота (α-гидроксиуксусная, 2-гидроксиэтановая).
Н2С (OH) – СООН
Глицериновая кислота(a-,b-дигидроксипропионовая, 2,3-дигидроксипропановая).
Н2С(OH) – СН(OH) – СООН
Фосфорные эфиры этой кислоты (2-фосфоглицерат, 3-фосфоглицерат, 1,3-дифосфоглицерат) участвуют в обмене веществ в организме животных и человека.
Изомерия гидроксикислот.
Структурная изомерия гидроксикислот обусловлена, во - первых, строением (разветвлением) углеродного скелета и, во - вторых, положением гидроксильной группы относительно карбоксильной группы.
|
|
|
Кислота с четырьмя углеродными атомами может существовать в виде пяти структурных изомеров. Три из них можно рассматривать как производные нормальной масляной кислоты; они являются изомерами по положению - ОН группы:
| СН3―СН2―СНОН―СООН | α-гидроксимасляная кислота, 2-гидроксибутановая кислота |
| СН3―СНОН―СН2―СООН | β-гидроксимасляная кислота, 3-гидроксибутановая кислота |
| СН2ОН―СН2―СН2―СООН | γ-гидроксимасляная кислота, 4-гидроксибутановая кислота |
Два других изомера – производные изомасляной кислоты и, следовательно, отличаются от первых строением углеродного скелета:
| | α-гидроксиизомасляная кислота, 2-метил-2-гидроксипропановая кислота |
| | β-гидроксиизомасляная кислота, 2-метил-3-гидроксипропановая кислота |
Для гидроксикислот характерна оптическая изомерия, которая обусловлена наличием ассиметричных атомов углерода С*. Такие углеродные атомы связаны с четырьмя различными заместителями. Оптическая изомерия связана с различным расположением атомов и групп атомов вокруг ассиметрического атома углерода. Для изображения стериоизомеров на плоскости используют проекционные формулы Фишера.
|
|
|
Принадлежность соединения к D- или L-ряду устанавливается путем сравнения конфигурации ассиметричного центра у этого вещества с конфигурацией ассиметричного центра у эталона, за который принимают D- или L-глицериновый альдегид. Располагают таким образом, чтобы цепь атомов углерода оказалась в вертикальном положении, а атом углерода с наименьшим номером оказался наверху. Символ ассиметрического атома углерода опускается, под ним понимают точку пересечения горизонтальной и вертикальной линий. Если гидроксогруппа (гетероатом) находится слева в проекционной формуле, то это L-глицериновый альдегид, если гидроксогруппа - справа, то это D-глицериновый альдегид
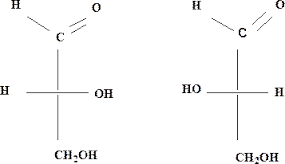
D- и L-формы соединения называются зеркальными изомерами (энантиомерами, оптическими антиподами).
Энантиомеры относятся друг к другу, как предмет и несовместимое с ним зеркальное изображение, различны по кофигурации, биологической активности, обладают одинаковыми физическими и химическими свойствами. Отличаются противоположными знаками оптической активности. Оптическая активность проявляется в способности вещества вращать плоскость поляризованного света. При прохождении плоскополяризованного света через раствор одного энантиомера происходит отклонение плоскости поляризации влево, другого – вправо на один и тот же по величине угол α. Величина угла a, приведенная к стандартным условиям, представляет собой константу оптически активного вещества и называется удельным вращением [a]. Левое вращение обозначается знаком (-), правое – (+), а энантиомеры называются соответственно лево- и правовращающимися. Вращаться могут ассиметричные атомы углерода (С*). Направление вращения плоскости поляризованного света определяется с помощью прибора поляриметра.
|
|
|
Соединение, существующее в виде двух оптически активных энантиомеров, может иметь и третью, оптически неактивную форму – рацемат. Рацемат – равномолекулярная смесь двух энантиомеров. Левое вращение одного энантиомера полностью компенсируется правым вращением другого.
Молекула винной кислоты содержит два одинаковых хиральных центра, между которыми может проходить плоскость симметрии этой молекулы. Поэтому винная кислота в природе существует в четырех формах: D-винная, L-винная, D,L-рацемат, называемый, виноградной кислотой, а также мезовинная кислота, являющаяся оптически неактивным стереоизомером вследствие внутримолекулярной компенсации из-за симметричности ее структуры. Однойиз причин различной физиологической активности стереоизомеров лекарственных препаратов являются различия в их проникновения в организм. L- изомер варфина - соединение, обладающее в 5 раз более сильными антикоагулянтным действием, чем D- изомер. Природный D-адреналин обладает в десятки раз большей фармоколлогической активностью, чем синтезированный L- изомер.
Физические свойства.
Простейшие представители одноосновных гидроксикислот либо густые жидкости, либо твердые вещества. Двух- и трехосновные гидроксикислоты – твердые кристаллические вещества. В воде они растворимы лучше, чем соответствующие карбоновые кислоты, не содержащие гидроксила. Многие из представителей гидроксикислот обладают оптической активностью.
Химические свойства.
Гидроксикислоты проявляют свойства характерные как для карбоновых кислот, так и для спиртов. Кроме того, у них проявляется ряд специфических свойств.
I . Реакции по карбоксильной группе
Диссоциация гидроксикислот. Гидроксикислоты проявляют более сильные кислотные свойства по сравнению с карбоновыми кислотами. Это обусловлено влиянием гидроксильной группы, при чём, чем ближе гидроксильная группа располагается к карбоксильной, тем сильнее гидроксикислота. Как кислоты они образуют соли, сложные эфиры, амиды и т.д.:
Дата добавления: 2020-11-29; просмотров: 766; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
