Кулонометрия при постоянной контролируемой силе тока (кулонометрическое титрование)
Кулонометрический метод анализа
Кулонометрические методы анализа основаны на измерении количества электричества, израсходованного на электропревращение определяемого вещества.
«Титруйте электронами» - таким образом рекламировала одна из японских фирм установки для кулонометрического анализа, что, как нельзя лучше, отражает сущность этого способа анализа.
· Теоретические основы метода
В основе кулонометрических методов лежат законы электролиза Фарадея.
Законы Фарадея формулируются следующим образом.
1. Количество электропревращенного (восстановленного или окисленного) в процессе электролиза вещества прямо пропорционально количеству прошедшего электричества.
2. Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
Электрохимический эквивалент – это масса вещества, выделившегося на электроде (или растворившегося с электрода) в процессе электролиза при протекании единицы количества электричества, т. е. 1 Кл.
Суть законов Фарадея заключается в том, что для выделения одного моля эквивалента любого вещества в процессе электролиза необходимо затратить одно и то же количество электричества, называемое числом Фарадея F=96500 Кл/моль.
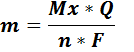
где:
m-масса выделяющегося вещества, г
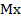 - молярная масса вещества, г/моль
- молярная масса вещества, г/моль
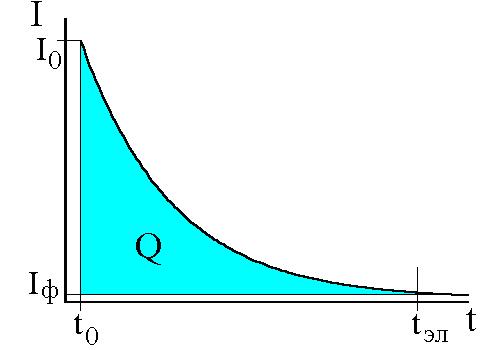
Q – количество электричества (Кл),
|
|
|
n – число электронов, участвующих в электродной реакции).
Q= I*t ,
где I – сила тока, А (ампер);
t – время электролиза, с (секунда).
Кулонометрические методы анализа обладают существенным преимуществом перед большинством других методов анализа.
Это связано с тем, что в соответствии с уравнением (1) коэффициент пропорциональности между аналитическим сигналом (Q) и массой определяемого вещества (m) содержит только физические константы (постоянные величины). Поэтому при использовании кулонометрических определений не требуется проводить градуировку аналитического сигнала по стандартным образцам (растворы сравнения), что является необходимым условием для большинства современных физических и физико-химических методов анализа.
Кроме того, кулонометрические методы анализа обеспечивают получение результатов с лучшей воспроизводимостью, чем большинство других методов анализа при определении как малых, так и сравнительно больших содержаний; они более экспрессны и легко автоматизируются.
В методе необходимо соблюдение трех обязательных условий:
–электрохимическое превращение вещества должно протекать со 100% выходом по току, т.е. побочные электродные реакции должны отсутствовать (только при этом условии можно воспользоваться законом Фарадея для вычисления количества определяемого вещества).
|
|
|
-кроме 100 % выхода по току для осуществления анализа необходимо определить окончание электродной реакции в прямой кулонометрии и химической реакции в кулонометрическом титровании, а также точно измерить количество электричества, затраченного на проведение электродной реакции.
–момент завершения электрохимической реакции должен быть достаточно точно устанавливаемым;
–количество электричества, вовлечённое в электродную реакцию, должно быть точно определяемо подходящим способом.
Различают два основных вида кулонометрических определений:
– прямую кулонометрию
– косвенную (кулонометрическое титрование).
В методах прямой кулонометрии анализируемое вещество непосредственно подвергается электрохимическому превращению в кулонометрической ячейке, т.е. определяемое вещество электороактивно.
В методах косвенной кулонометрии определяемые вещества не электроактивны и тогда в их раствор вносят такое вещество, которое способно электроокисляться или электровосстанавливаться на электродах. Продукт этих реакций способен химически количественно взаимодействовать с определяемым веществом в эквивалентных количествах и количество электричества соответственно будет также эквивалентно содержанию определяемого вещества.
|
|
|
По технике выполнения кулонометрический метод анализа делится на:
–потенциостатическую кулонометрию (или кулонометрию при контролируемом потенциале)
– амперостатическую кулонометрию (или кулонометрию при постоянной силе тока)
· Метод потенциостатической кулонометрии (при контролируемом потенциале электрода)
Метод состоит в проведении электролиза раствора, содержащего определяемое вещество при постоянном, заранее выбранном потенциале рабочего электрода.
В методах прямой кулонометрии электрохимическому превращению непосредственно в кулонометрической ячейке подвергается анализируемое вещество.
В прямой кулонометрии измерения обычно проводят при постоянном контролируемом потенциале, т.е. в потенциостатическом режиме. Принципиальная схема установки для потенциостатической кулонометрии приведена на рис. 1.
 7
7
Рис. 1. Схема установки для потенциостатической кулонометрии.
1-аккумуляторная батарея
|
|
|
2-реостат
3-электрод сравнения (каломельный или хлорсеребряный)
4-рабочий электрод
5-кулонометрическая ячейка
6-кулономер
7-вспомогательный электрод
Напряжение с аккумуляторной батареи 1 через делитель напряжения 2 подается на рабочий электрод 4 кулонометрической ячейки. Потенциал электрода определяется милливольтметром или потенциометром, сила тока – амперметром. Количество израсходованного электричества измеряется кулонометром 6.
В современных установках в качестве источника стабилизированного напряжения обычно используют специальные электронные приборы – потенциостаты, поддерживающие заданный потенциал с точностью примерно ±10 мВ в интервале от -2,5 до 2,5 В.
Потенциал рабочего электрода устанавливают с помощью поляризационной кривой (I–E - кривой) в области, где достигается предельный ток.
Рабочим электродом кулонометрической ячейки обычно служит платиновая пластинка или ртуть, хотя иногда используют также золотые, серебряные или графитовые электроды.
Вспомогательный электрод изготовляется из тех же материалов.
Электродные пространства рабочего и вспомогательного электродов разделены. Контакт между ними осуществляется через пористую перегородку. В качестве электрода сравнения 3 (рис. 1) обычно выбирают каломельный или хлорсеребряный.
Определение количества электричества, израсходованное на протекание электрохимической реакции, производится путем измерения тока в течение всего процесса электролиза с последующим определением величины, соответствующего площади, ограниченной осями координат i-t кривой.
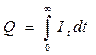
Эта операция может быть выполнена автоматически с помощью электронных интеграторов тока.
Более точный способ определения количества электричества - это включение в цепь последовательно с кулонометрической ячейкой химического
кулонометра, т.е. второй электрохимической ячейки.
Известны три основных типа кулонометров:
-весовые (гравиметрические),
-объемные (волюметрические)
-титрационные.
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Медный кулонометр наиболее распространен в практике лабораторных исследований, т.к. он является простым в изготовлении и достаточно точным. Точность определения количества электричества составляет 0,1 %. Кулонометр состоит из двух медных анодов и катода из тонкой медной фольги, расположенного между ними. Электролитом в медномкулонометре служит водный раствор состава: CuSO4 ∙ 5H2O, H2SO4 и этанол C2H5OH.Серная кислота повышает электрическую проводимость электролита и, кроме того, препятствует образованию основных соединений меди в прикатодном пространстве, которые могут адсорбироваться на катоде, увеличивая тем самым его массу. H2SO4 в электролите медного кулонометра необходима для предотвращения накопления соединений Cu1+, которые могут образовываться в результате реакции диспропорционирования:
Cu0+ Cu2+ → 2Cu+
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза.
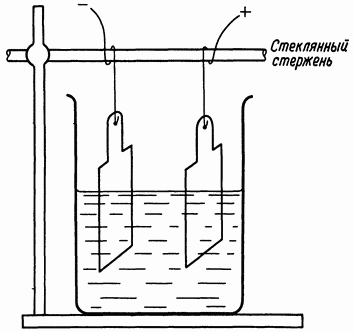

Медный кулонометр для небольших токов.
В кулонометре со 100%-ным выходом протекает хорошо известная электрохимическая реакция. Измерение количества электричества сводится к определению количества вещества, полученного в результате этого процесса, и расчета количества электричества по закону Фарадея.
В ходе электролиза из перемешиваемого раствора ток падает со временем по экспоненциальному закону, электролиз прекращают, когда ток достигает 0,1% начального значения. В некоторых случаях, например, при большом остаточном токе применяют химические или физико-химические способы индикации. Массу определяемого вещества рассчитывают по формуле
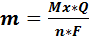
Кулонометрия при постоянной контролируемой силе тока (кулонометрическое титрование)
Метод амперостатической кулонометрии основана получении ионов, реагигующих с анализируемым веществом (титранта), в самом титруемом растворе
Титрант называют электрогенерированным, а электрод, на котором его получают - генераторным
Примерами кулонометрических титрантов могут являться электро-генерированные ионы Н+ и ОН- (кислотно-основное титрование), а также галогены - Cl2, Br2, I2, вступающие в реакции окисления и применяемые для определения широкого круга как неорганических, так и органических веществ.
Например:
при йодометрическом определении восстановителей (S2O32-, AsO33-) в раствор добавляют иодид калия KI и ведут электролиз. На аноде выделяется йод I2, который взаимодействует с восстановителем
При этом задача определения количества электричества упрощается и сводится к измерению времени, в течение которого достигается конечная точка титрования:
Q= I*t ,
Для обеспечения 100%-ного выхода по току в электролизер вводят ~ 1000-кратное избыточное количество вспомогательного реагента, из которого генерируют титрант, то есть вспомогательный реагент служит своего рода электрохимическим буфером, препятствующим сдвигу потенциала рабочего электрода до значений, при которых возможны побочные электрохимические реакции. При генерации титранта из воды или материала электрода 100%-ный выход по току обеспечивается автоматически.
В кулонометрическом титровании успешно используют:
-кислотно-основные,
-окислительно-восстановительные реакции,
-реакции комплексообразования и осаждения
- реакции осаждения
Для фиксирования момента завершения химической реакции между определяемым веществом и кулонометрическим титрантом используют как визуальные (с помощью индикаторов), так и инструментальные методы индикации конечной точки титрования (потенциометрический, амперометрический, спектрофотометрический).
В методе кулонометрического титрования используют установки с постоянной силой тока. Так как титрант генерируется в количестве, точно эквивалентном содержанию анализируемого вещества, то по количеству электричества, израсходованного на генерацию титранта, можно рассчитать содержание определяемого вещества. Блок-схема установки для кулонометрического титрования приведена на рис. 2.
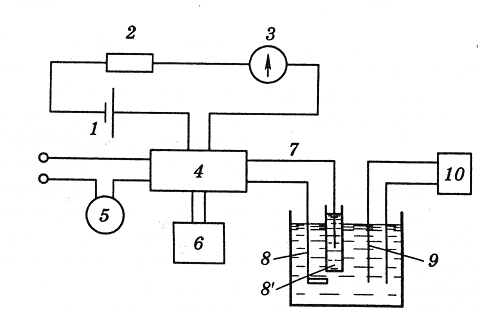
Рис. 2. Блок-схема установки для кулонометрического титрования.
Пульт-переключатель 4 питается током стабилизированного напряжения от аккумуляторной батареи 1 через сопротивление 2 и амперметр 3. Постоянство силы тока в генераторной цепи 7 контролируется потенциометром 6 по падению напряжения на стандартном сопротивлении. Пуск секундомера 5 и включение генераторной цепи 7 производится через пульт одновременно (8 и 8' - генераторные электроды). Конец реакции фиксируется с помощью индикаторных электродов 9 и измерительного потенциометра 10.
Титрант генерируется в результате электролиза на электроде 8 (рабочий генераторный электрод).
Вторым электродом схемы генерации является так называемый вспомогательный электрод 8'. Его обычно изолируют от раствора анализируемого вещества, помещая в трубку с дном из пористого стекла, так как продукт реакции на вспомогательном электроде нередко мешает кулонометрическому определению.
Индикаторными электродами могут быть два платиновых электрода, если для индикации применяются амперометрический метод, или платиновый и каломельный, если используется потенциометрическая индикация, и т.д. Может быть использован также спектрофотометрический или какой-либо другой способ определения точки эквивалентности.
Дата добавления: 2020-11-29; просмотров: 1041; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
