Явление, при котором один химический элемент образует несколько простых веществ.
Простые вещества металлы
Материалы урока
Сегодня мы с вами будем изучать тему без знаний которой не обходятся люди многих профессий: врачи, фармацевты, биологи, химики, физики, минерологи, геологи, агрономы, ветеринары, инженеры, повара, и список этот можно продолжать до бесконечности.
Задумывались ли вы когда– нибудь о том, какими материалами человек пользуется чаще всего? Давайте оглянемся вокруг. Мебель в классе деревянная держится на металлических шурупах. К каждой парте подведена вода, которая течёт по металлическим трубам. Краны в классе, детали компьютера, провода по которым течет электрический ток - металлические.
Из металла сделаны ложки, ножи ,вилки, кастрюли, сковородки, детали телевизоров и, автомобили. Кроме того, металлы входят в состав живых организмов.
Знания о металлах имеют огромное значение для каждого из нас.Дело в том, что здоровье человека напрямую зависит от наличия или отсутствия в нашем организме некоторых металлов. В крови человека найдено 76 химических элементов из них 62металла. К металлам – “элементам жизни” относят 10 химических элементов металлов - K, Na, Mg, Ca, Fe, Mn, Co, Cu, Zn,Мо Значение их огромно.
При недостатке ионов Na+появляется головная боль, потеря памяти, а при избытке – развивается гипертония.
Са -участвует в свёртываемости крови ,способствует росту зубов, образованию молока у кормящих женщин, входит в состав скелета.
|
|
|
Недостаток К- приводит к аритмии,
Zn- к повреждению кожи, нарушению волосяного покрова, замедлению полового созревания,
Mg– к повышению возбудимости, а избыток Mg вызывает депрессивное состояние.
Перед вами периодическая таблица.
Из 110 элементов представленных в ней 88 приходится на долю металлов.
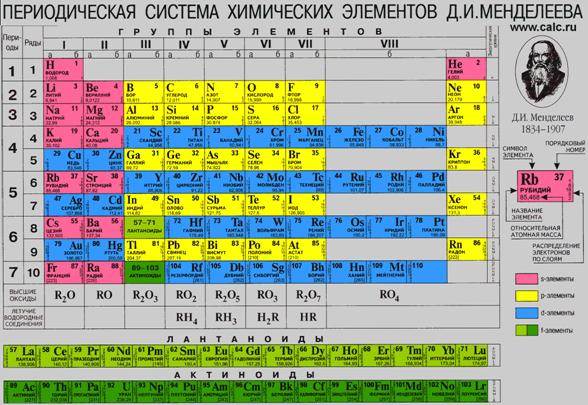
Если провести диагональ В – At, то в левом нижнем углу мы видим, располагаются только металлические элементы. За пределами этой диагонали есть еще металлы – это элементы побочных подгрупп.
Положение металлов в периодической системе химических элементов Д.И. Менделеева
Металлами называют химические элементы и простые вещества.
Как было указано выше металлы занимают левую нижнюю часть периодической системы. А, следовательно, их атомы имеют большие радиусы и, как правило, небольшое количество валентных электронов. Для их ионизации требуется относительно небольшая энергия. Возникающие положительные ионы металла удерживаются все вместе за счет притяжения ко всем свободно движущимся в металле электронам.
Рассмотрим таблицу "Химическая связь"
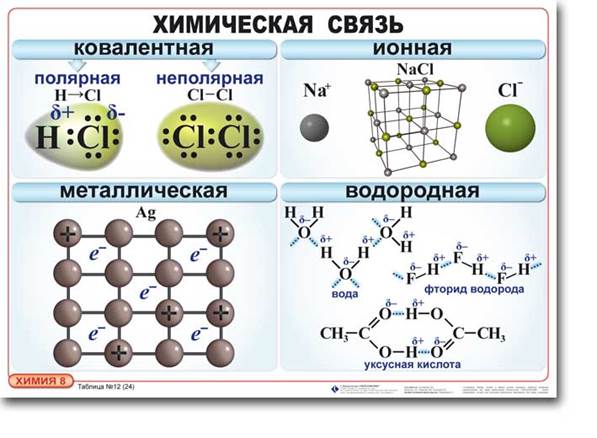
В чем сходство и различия между металлической связью и ковалентной?
Валентные электроны находятся в общем пользовании, но в случае ковалентной в общем пользовании только двух атомов, а в случае металлической связи эти электроны связывают все атомы куска металла, создают "электронный газ".
|
|
|
Между металлической и ионной?
С ионной связью металлическая сходна наличием ионов, но в металлической положительные ионы удерживаются "электронным газом", а в ионной - положительными ионами.
И так, металл - это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами.
Рассмотрите образцы металлов и назовите, какими общими физическими свойствами они обладают?
Ссылка
Общие физические свойства
· электропроводность,
· теплопроводность,
· металлический блеск,
· твердость,
· пластичность.
Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
Причина в особенностях металлической связи, структуре кристаллов металлического типа.
Электропроводность и теплопроводность
Ссылка
Электрическая проводимость металлов объясняется движением свободных электронов. Поэтому при нагревании электрическая проводимость металлов уменьшается (направленное движение электронов затруднено), а при охлаждении увеличивается.
|
|
|
Чем обусловлена теплопроводность, и как она изменяется при нагревании?
Теплопроводность - способность проводить тепло, объясняется усилением движения частиц (атомов или ионов) в узлах решетки при нагревании, задействованием соседних частиц в кристалле металла и постепенному распределению тепла по всему кристаллу.
Пластичность
Пластичность - способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов?
Металлический блеск
Металлический блеск также обусловлен особым строением металлов (благодаря свободным электронам металлы хорошо отражают световые лучи).
Да, металлы обладают общими физическими свойствами, которые обусловлены их особым строением, но у разных металлов степень проявления каждого свойства различна.
Так, лучшей электропроводностью обладает серебро, на втором месте - медь, а на третьем - золото.
Такие различия в проявлении физических свойств связаны с тем, как плотно упакованы ионы в кристаллической решетке металла, каковы их размеры и сколько валентных электронов у каждого атома обобществляется. Например, чем большее число атомов металла находиться в единице объема металла, тем большей плотностью он будет обладать. Однако плотность вещества зависит не только от вида кристаллической решетки, но и от массы составляющих его ионов и от их радиусов. Поэтому наименьшей плотностью обладают щелочные металлы. Самый тяжелый из всех металлов - осмий
|
|
|
В зависимости от плотности металлы принято делить на легкие (их плотность менее 5 г/см3) и тяжелые (их плотность более 5 г/см3). Так у алюминия плотность - 2, 7 г/см3- металл легкий.
Плотность некоторых металлов
Ссылка
Пластичность металлов также зависит от вида кристалла и от количества связывающих электронов, от размеров ионов.
Самый пластичный - золото. Кусочек золота величиной со спичечную головку можно расплющить в просвечивающий голубовато-зеленым светом лист площадью 50 квадратных метров. Образец золота весом 1г можно протянуть в проволоку длиной 2 км. Исстари на Руси выделывали "сусальное золото": сначала его прокатывали в вальцах до толщины листа писчей бумаги, затем укладывали между тонкими пленками, снятыми со слепой кишки коровы и прокатывали на наковальне деревянными молоточками. Повторяя эту операцию неоднократно, получали листочки золота толщиной всего в десятую долю микрона, т.е. 500 атомов. "Сусальное золото" шло на покрытие деревянных предметов, кожи и т.п.
Самые хрупкие металлы V, VI, VII групп. У них от 5 до 7 валентных электронов, следовательно, очень крепкая связь ионов между собой, что препятствует их скольжению друг относительно друга, снижает пластичность. Этим же объясняется их тугоплавкость и твердость.
Чем меньше количество свободных электронов, чем больше размеры ионов, чем слабее связи ионов, тем мягче металлы. Самые мягкие - щелочные металлы, самый твердый - хром.
Ссылка
Температуры плавления металлов изменяются в очень широких пределах: от минус 39°С до 3410 у вольфрама. Ртуть единственный жидкий при обычных условиях металл.
Ссылка
Так как разные металлы имеют сходные металлические связи, а в ряде случаев образуют сходные металлические кристаллы, то многие из них при переходе в расплавленное состояние могут смешиваться друг с другом и образовывать сплавы. Сплавы могут образовывать и атомы металлов с неметаллами. Сплавы обладают другими, более разнообразными свойствами, по сравнению с металлами в них входящими. Так, медь, олово и цинк - мягкие металлы, сплав же на их основе - бронза - очень твердый. Третник - сплав олова со свинцом используют при паянии, т.к. он имеет низкую температуру плавления. Наиболее распространенные сплавы металла и неметалла - чугун и сталь.
Исключительное значение имеют сплавы золота. Ведь чистое золото мягкое, его прочность невелика, оно легко истирается; например, монета из чистого золота при обращении теряет каждое столетие пятую часть своего веса. Добавка меди в золото делает его твердым и упругим. О количестве золота в ювелирном изделии расскажет его проба. Проба 583 указывает, что сплав содержит 58,3% золота, или 583 г в 1000г сплава.
Применение металлов в соответствии с их физическими свойствами
Ссылка
Ссылка
Ссылка
Ссылка
Ссылка
Контрольно-тренировочные материалы
·  взаимосвязь физических свойств металлов и их применением
взаимосвязь физических свойств металлов и их применением
Простые вещества неметаллы
Материалы урока
Неметаллы, химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов.
К неметаллам относятся 22 элемента. Только два неметалла — углерод и сера — были известны в древности. В 13 в. был получен мышьяк, в 17 в. открыты водород и фосфор, в конце 18 в. — кислород, азот, хлор, теллур. В 1789 А. Л. Лавуазье включил эти неметаллы в список простых веществ (кроме хлора, который тогда считали окисленной соляной кислотой). В 1-й половине 19 в. были получены бром, иод, селен, кремний, бор. Изолировать фтор и открыть инертные газы удалось лишь в конце 19 в. Астат получен искусственно в 1940.
Ссылка
1. Положение неметаллов в ПС.
Неметаллы находятся в верхнем правом углу периодической системы химических элементов Д.И. Менделеева над диагональю В – Аt.
Расположены в главных подгруппах 4 - 8 групп.
2. Особенности строения атомов неметаллов.
- на внешнем уровне имеют от 4 до 8 электронов
- небольшой радиус атомов
- стремятся принять электроны
- характерные связи: ионная и ковалентная
3. Физические свойства.
а) Агрегатное состояние.
· Твердые вещества: бор, углерод, кремний, фосфор, сера, мышьяк, селен, теллур, йод, астат;

красный фосфор
иод

· Жидкости: бром – красно – бурая жидкость с тяжелым неприятным запахом;

· Газы: водород, азот, кислород, фтор, хлор и инертные газы

Особыми являются инертные или благородные газы. Инертные газы не имеют цвета и запаха. И являются одноатомными. Инертные газы считаются благородными. Обладают более высокой электропроводностью (по сравнению с другими) и, при прохождении через них тока, ярко светятся.
· Неон - огненно красным светом.
· Гелий - ярко-жёлтым светом.
· Аргон – синим светом.
· Криптон – светло- желтым светом.
· Ксенон – фиолетовым светом.
Несмотря на свою инертность, эти газы находят широкое применение:
- гелием заполняют воздушные шары и дирижабли.
Ссылка
- неон применяется для световой рекламы.
Ссылка
- аргон в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметаллов
Все указанные неметаллы (водород, кислород, азот, фтор и хлор) имеют двухатомные молекулы.
Ссылка
Водород, кислород и азот бесцветны, фтор имеет светло – зеленый цвет, хлор – желто – зеленый.
б) Не имеют металлического блеска (исключение – графит, йод)

графит
иод

в) Большинство не проводят электрический ток
(кроме кремния и графита)
г) Хрупкие.
Аллотропия.
Явление, при котором один химический элемент образует несколько простых веществ.
Причины аллотропии:
- разный состав молекул (О 2 и О 3 )
Кислород образует два простых вещества: кислород О2 и озон О3.
Кислород – самый распространенный химический элемент в земной коре. Кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород. Кислород является также важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительное значение в жизни растений, животных и человека.
В 1772 г. шведский химик К.В. Шееле установил, что воздух состоит из кислорода и азота. В 1774 г. Д. Пристли получил кислород разложением оксида ртути (2).
Кислород – бесцветный газ без вкуса и запаха, относительно мало растворим в воде, немного тяжелее воздуха: 1 л кислорода при нормальных условиях весит 1,43 г, а 1 л воздуха – 1,29 г. ( Нормальные условия – сокращенно: н. у. – температура 0 оС и давление 760 мм рт. ст., или 1 атм) . При давлении 760 мм рт. ст. и температуре – 183 оС кислород сжижается, а при снижении температуры до – 218,8 оС затвердевает.
Химический элемент кислород О, кроме обычного кислорода О2 , существует в виде еще одного простого вещества – озона О3. Кислород О2 превращается в озон в приборе, называемом озонатором.
Это газ с резким характерным запахом (название “озон” в переводе с греческого – “пахнущий”). Запах озона вы, вероятно, не раз ощущали во время грозы. Озон состоит из трех атомов элемента кислорода. Чистый озон – газ синего цвета, в полтора раза тяжелее кислорода, лучше его растворяется в воде.
В воздушной атмосфере над Землей на высоте 25 км существует озоновый слой. Там озон образуется из кислорода под воздействием ультрафиолетового излучения Солнца. В свою очередь озоновый слой задерживает это опасное для всех живых существ излучение, что обеспечивает нормальную жизнь на Земле.
Озон используют для обеззараживания питьевой воды, так как озон окисляет вредные примеси в природной воде. В медицине озон используют как дезинфицирующее средство.
·
Ссылка
- разная структура кристаллической решетки
(алмаз – тетраэдрическая, графит – слоистая).
Углерод образует несколько аллотропных модификаций,
наиболее известные алмаз и графит.
Алмаз — самый твёрдый известный природный минерал. Самый крупный из найденных алмазов получил имя "Куллинан". Он был обнаружен в 1905 г. около г. Претории в Южной Африке. Масса "Куллинана" составляла 3106 карат (или 621 г), и стоил он 9 млн. фунтов стерлингов. Алмаз был подарен английскому королю Эдуарду VI. При обработке "Куллинан" был расколот на 105 частей; самая крупная из них массой 516,5 карата (или 103,3 г) получила название "Звезда Африки".

Графит представляет собой темно-серое с металлическим блеском, мягкое, жирное на ощупь вещество.
Хорошо проводит электрический ток.
 |
Дата добавления: 2020-11-23; просмотров: 242; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
