Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне - это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод - 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью - способностью атомов образовывать определенное число химических связей.
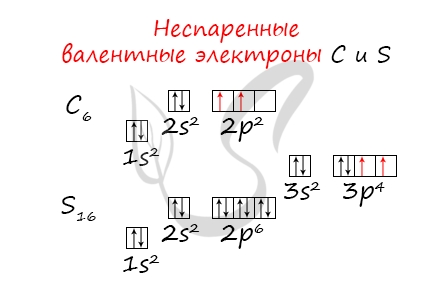
- Углерод - 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
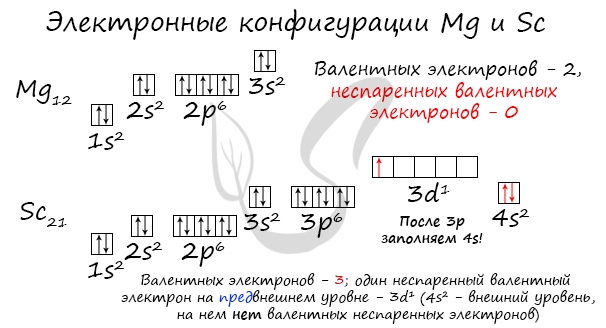
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний - 1s22s22p63s2
- Скандий - 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением - провалом электрона, которое только подтверждает общее правило: любая система стремится занять наименее энергозатратное состояние.
|
|
|
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим две электронных конфигурации: первую "неправильную" (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную с учетом провала электрона.

Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота, кислорода , фтора - возбужденное состояние невозможно, так как отсутствуют свободные орбитали ("ячейки") - электронам некуда перескакивать, к тому же d-орбиталь у них отсутствует (они во втором периоде).
|
|
|
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
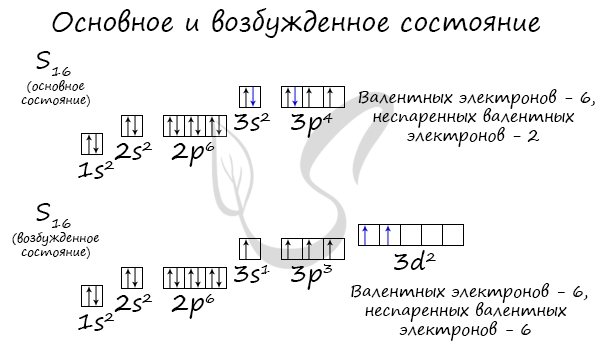
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние связано с распаривание электронных пар.
Задания для самостоятельного выполнения:
Задание №1
1. На s – орбитали помещается количество электронов:
а) один б) два в) шесть г) десять
2. На внешнем уровне серы (порядковый номер 16) находится электронов:
а) два б) четыре в) шесть г) восемь
3. Провал электрона характерен для:
а) хлора и мышьяка б) марганца и цинка
в) хрома и меди г) железа и цинка
4. Для кальция и магния одинаковым является:
а) число нейтронов б) число электронов на внешнем уровне
в) общее число электронов г) номер периода
|
|
|
Задание №2
Составьте схемы электронного строения , электронные формулы и графические электронные формулы атомов следующих химических элементов: Ca, Fe, Zn, Sn, Nb, Hf, Pa.
Задание №3
Как определяется принадлежность химического элемента к тому или иному электронному семейству.
Дата добавления: 2020-11-23; просмотров: 977; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
