Агрегатное состояние вещества
Занятие в группе 1-ОПИ-20/з,
4 пара
Тема 1: Цель и задачи курса. Агрегатное состояние вещества. Идеальный газ. Газовые законы.
Цель занятия:
· Дидактическая:
- систематизировать и расширить знания по предмету физическая химия;
- рассмотреть цель и задачи курса;
- установить взаимосвязь физической химии с другими науками;
- сформулировать понятия агрегатное состояние, идеальный и реальный газ;
- рассмотреть основные положения молекулярно – кинетической теории (МКТ) для идеальных газов, газовые законы.
· Воспитательная:
- достичь понимания важности изучения дисциплины;
- развивать аккуратность, внимательность, настойчивость при выполнении заданий;
- прививать интерес к предмету.
Вид занятия: комбинированное занятие.
Тип занятия: приобретение новых знаний.
Ход занятия
Организационный момент
- проверка присутствия студентов;
- записи в журнале;
- проверка подготовки к занятию студентов.
Сообщение темы, цели и основных задач занятия.
Мотивация к изучению материала
Химия изучает состав, строение, свойства и превращения веществ. Являясь одной из фундаментальных естественных наук, химия играет ключевую роль в решении жизненно важных проблем. Основной задачей химии остается обеспечение производства новых конструкционных и функциональных органических и неорганических материалов (пластмасс, волокон, композитов, керамики, сплавов, цементов), создание новых фармацевтических препаратов для медицины, пестицидов и удобрений для сельского хозяйства, особо чистых веществ для электроники, горюче-смазочных материалов, красителей.
|
|
|
Формирование должной химической культуры предполагает, что каждый специалист имеет четкие представления о «химических компонентах» своей деятельности.
Так, например, решение экологических вопросов, таких как создание замкнутых производственных циклов, безотходных и ресурсосберегающих технологий невозможно без химических знаний.
Современная химия сложна и многогранна. Это подтверждает перечень научных дисциплин, например, неорганическая, аналитическая, физическая, органическая химия, электрохимия и др.
Актуализация опорных знаний
1) Что изучает химия?
2) Что изучает физика?
3) Что изучает физическая химия?
4) Какое значение имеет физическая химия?
Изучение нового материала
Цель и задачи курса
Физическая химия – наука, которая изучает физическими методами строение химических соединений, количественные закономерности и механизм химических процессов.
Название науки «Физическая химия» введено М.В. Ломоносовым (1752 — 1753), который впервые сформулировал ее предмет (объект исследования) и задачи.
|
|
|
Объектами физической химии являются любые системы, в которых могут протекать химические превращения. Физическая химия изучает происходящие в этих системах изменения, сопровождающиеся переходом химической формы движения в различные физические формы движения — тепловую, лучистую, электрическую и тд.
Основная задача современной физической химии — выявление детального механизма явлений.
Физическая химия изучает и объясняет основные закономерности, определяющие направление химических процессов, скорость их протекания, влияние на них среды, примесей, излучения и т.д.
Для современной физической химии основной задачей является установления связи между строением вещества и его реакционной способностью.
Современная физическая химия разделяется на практически самостоятельные области – химическую термодинамику, химическую кинетику, электрохимию, фотохимию, учение о газах, растворах, химических и фазовых равновесиях, катализ. В качестве самостоятельных разделов физическая химия включает также квантовую, радиационную химию, фотохимию, кристаллохимию, учение о строении вещества, физико-химический анализ и др.
|
|
|
Большие заслуги в развитии физической и коллоидной химии принадлежат русским ученым Д.И. Менделееву, Д.П. Коновалову, Н.С. Курнакову, Н.А. Курнакову, Н.Н. Семенову, П.А. Ребиндеру, Н.А. Шилову, Н.П. Пескову, А.Н. Фрумкину, В.А. Каргину.
Агрегатное состояние вещества
Многие вещества могут, в зависимости от внешних условий (температура, давление), находиться в трех агрегатных состояниях – твердом, жидком и газообразном. Четвертым агрегатным состоянием вещества часто считают плазму. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Газ – агрегатное состояние вещества, в котором молекулы движутся хаотически, расположены на большом расстоянии друг от друга. В твердых телах расстояния между частицами малы, сила притяжения соответствует силе отталкивания. Жидкость – агрегатное состояние, промежуточное между твердым и газообразным. В жидкости частицы расположены близко одна к другой и могут перемещаться друг относительно друга; жидкость, как и газ, не имеет определенной формы.
Полиморфизм – способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации).
|
|
|
Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия – характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие).
Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов одинаковы. При сильном нагревании любое вещество испаряется, превращается в газ. Если увеличивать температуру и далее, резко усиливать процесс термической ионизации, молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы. В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра и ионосферы. В лабораторных условиях плазма впервые появилась в виде газового разряда. Она заполняет лампы дневного света, стеклянные трубки неоновой рекламы.
Фаза –термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Если, например, в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза - вода; газообразная фаза - водяные пары.
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества, то понятие фазы совпадает с понятием агрегатного состояния вещества, которое может быть жидким, твердым или газообразным.
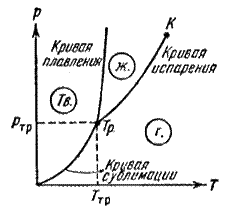 Агрегатное состояние вещества зависит от его давления
Агрегатное состояние вещества зависит от его давления  и температуры
и температуры  . Кривые фазового равновесия на диаграмме состояния показывают значения давления и температуры, при которых возможно равновесие двух фаз.
. Кривые фазового равновесия на диаграмме состояния показывают значения давления и температуры, при которых возможно равновесие двух фаз.
Точка, в которой пересекаются эти кривые, определяет температуру и давление одновременного равновесного сосуществования трех фаз вещества. Эта точка называется тройной точкой. Каждое вещество имеет только одну тройную точку.
Идеальный и реальный газ
Идеальным газом принято считать газ, если:
· между молекулами отсутствуют силы притяжения, то есть они ведут себя, как абсолютно упругие тела;
· расстояние между молекулами намного превосходит размеры самих молекул.
Реальный газ приближается к идеальному, если он сильно разрежен.
Основные положения МКТ
Основные положения, на которых базируется молекулярно-кинетическая теория:
· Все тела состоят из микрочастиц (атомов, молекул, ионов);
· Микрочастицы находятся в непрерывном хаотическом движении;
· Микрочастицы взаимодействуют между собой.
Газовые законы химии
Закон объемных отношений (Ж.Л. Гей-Люссак, 1809).
Объемы газообразных веществ, участвующих в реакции, относятся между собой как соответствующие стехиометрические коэффициенты.
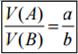
Плотность D первого газа относительно второго показывает, во сколько раз масса одного газа больше или меньше массы такого же объема другого газа.
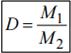
Закон Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем. При нормальных условиях, то есть при давлении 101,33 кПа и температуре 273,16 К этот объем составляет 22,414 м3/моль. Этот объем называют молярным объемом газа Vm.
Закон Бойля – Мариотта (открыт независимо Бóйлем и Мариóттом в 1662 и 1676 годах): произведение объема данной массы газа на его давление есть величина постоянная при неизменной температуре, P*V = const, если масса и температура постоянны.
Закон Гей-Люссака: V/T=const (при постоянных Р и n), т.е. при постоянном внешнем давлении отношение объема данной массы газа к его абсолютной температуре есть величина постоянная.
Закон Шарля (1787 г.): P/T=const (масса и объем газа постоянны), т.е. отношение давления данной массы газа, заключенного в сосуде постоянного объема к его абсолютной температуре есть величина постоянная.
Уравнение состояния идеального газа 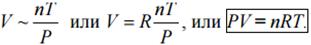
Уравнение Менделеева – Клайперона 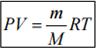
Объединенный газовый закон 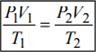
Парциальное давление газа в смеси – давление, которое создавало бы это же количество данного газа, если бы он занимал при данной температуре весь объем, занимаемый смесью.
Дата добавления: 2020-11-23; просмотров: 38; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
