Стандартные окислительно-восстановительные (ОВ) потенциалы-
Потенциометрический метод анализа (часть 1)
Потенциометрический метод анализа основан на измерении электродного потенциала, величина которого обусловлена концентрацией (точнее, активностью) потенциалопределяющего компонента раствора электролита
Теоретические основы
· Электродный потенциал
Возникновение электродного потенциала обусловлено протеканием на границе электрод – электролит электрохимических реакций с участием ионов.
Теоретической основой объяснения возникновения электродных потенциалов является сольватационная теория Л.В.Писаржевского - Н.А.Изгарышева.
Согласно этой теории при погружении металлической пластинки в раствор собственной соли имеют место два основных процесса.
Первый процесс – это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы – атомы:
 Ме Меn+ + nē.
Ме Меn+ + nē.
Ионизация происходит под действием полярных молекул растворителя (воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластинки (рис.1).
Второй процесс – это взаимодействие молекул растворителя с ионами металла, т.е. сольватация образующихся ионов:
 Меn+ + mH2O Меn+×mH2O.
Меn+ + mH2O Меn+×mH2O.
При погружении пластинки металла в раствор вначале преобладает процесс ионизации металла:
|
|
|
 Ме Меn+ + nē,
Ме Меn+ + nē,
но со временем скорость прямой реакции уменьшается, а растет скорость обратной реакции:
 Меn+ + nē Ме
Меn+ + nē Ме
пока между этими процессами не установится динамическое равновесие:
 Ме + mH2O Меn+×mH2O + nē
Ме + mH2O Меn+×mH2O + nē
 или упрощенно Ме Меn+ + nē
или упрощенно Ме Меn+ + nē


Рисунок 1- Возникновение электродного потенциала
Возникновение электродного потенциала связано с электрохимическим процессом, заключающемся в переносе заряженной частицы (электрона, иона) через границу двух соприкасающихся электропроводящих фаз: металл или полупроводник ― раствор. Перенос этот имеет место при погружении, например, металлического электрода в раствор, содержащий ионы этого же металла, а также индифферентного электрода из благородного металла (Pt, Au), в раствор, содержащий какую-либо окислительно-восстановительную систему:
| Men+ + nē = Me0 | |
| Ок + nē = Вос |
· Гальванический элемент
Для измерения электродного потенциала собирают гальванический элемент
Первый химический источник тока был изобретен итальянским ученым Алессандро Вольта в 1800 году. Это был элемент Вольта - сосуд с соленой водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем ученый собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Спустя три десятилетия электротехник Борис Семенович Якоби изобрел гальванический элемент новой конструкции. Это был сосуд, разделенный пористой перегородкой. В одном отделении медный электрод находился в растворе медного купороса, в другом цинковый - в растворе сульфата цинка. Сульфат цинка не взаимодействует с цинком, а сульфат меди - с медью. При замыкании цепи элемента электрический ток шел от цинкового электрода к медному. Через некоторое время медный электрод делался тяжелее, а цинковый - легче. Атом цинка отдавал иону меди свои заряды и переходил в раствор в виде иона, а ион меди, получив заряды, превращался в металлическую медь. Этот элемент давал постоянное напряжение - почти один вольт.
|
|
|
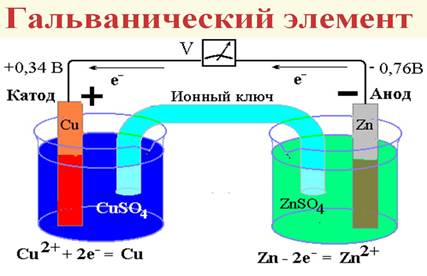
Рисунок 2-Гальванический элемент Якоби и Вольта.
Для измерения электродных потенциалов также применяют гальванический элемент,
который состоит из двух электродов: анода и катода, которые погружены в раствор электролита. Для облегчения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью. Роль анода всегда выполняет электрод, у которого меньшее значение электродного потенциала.
|
|
|
При работе гальванического элемента на аноде протекает процесс окисления, а на катоде-процесс восстановленияя.
ЭДС гальванического элемента определяется по разности электродных потенциалов анода и катода:
Е=ф0катода+ф0анода.
Стандартные окислительно-восстановительные (ОВ) потенциалы-
ОВ потенциалы (φ0ок/вос или Е0ок/вос), измеренные при стандартных условиях (температура 25 С, давление 1 атм.)
Гальванический элемент для измерения состоит из исследуемого электрода, потенциал которого нужно измерить и стандартного водородного электрода (электрод сравнения)
Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал водородного электрода(φ02Н+/Н2) принимают равным 0 В. 


|
|
|

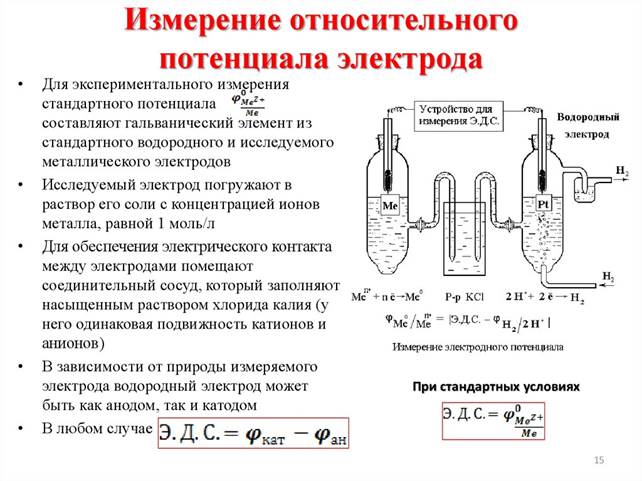
Рисунок 3-измерение стандартного потенциала
По значениям φ0ок/вос металлов составлен электрохимический ряд напряжений (активности) металлов
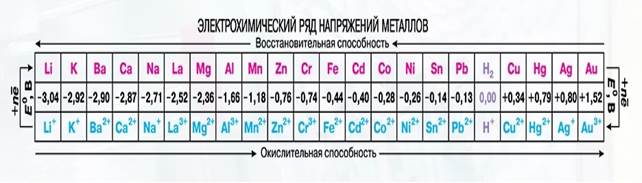
Рисунок 4- ряд напряжений (активности) металлов
Для окислительно-восстановительных систем- таблицы ОВ потенциалов
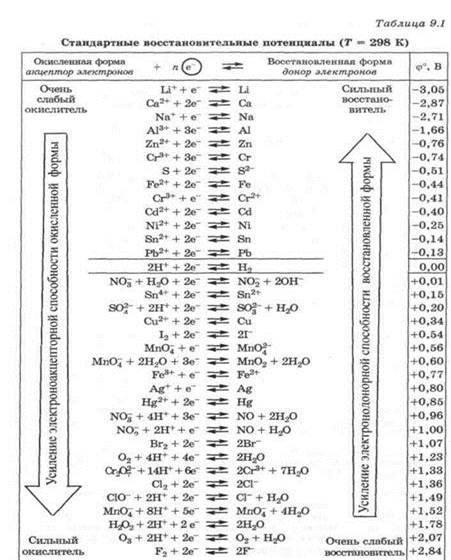
Рисунок 5- таблица ОВ потенциалов
· Реальный потенциал. Формула Нернста
Потенциал электрода зависит:
-от природы материала электрода—от температуры,0К
-от концентрации потенциал определяющих ионом, моль/л
Величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
φок/вос= φ0ок/вос + 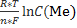
φок/вос= φ0ок/вос +  ,
,
где:
φок/вос- окислительно-восстановительный потенциал данной пары,В
φ0ок/вос- стандартный потенциал,В
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
C(Ме) – концентрация ионов металла, моль/л
Cок – концентрация (активность) окисленной формы, моль/л
Cвос– концентрация (активность) восстановленной формы, моль/л
Для стандартных условий
φок/вос= φ0ок/вос + 
φок/вос= φ0ок/вос +  C
C
Пример 1
Вычислите электродный потенциал свинцовой пластины, опущенной в раствор нитрата свинца, если концентрация ионов свинца 0,01 моль/л.
Решение. Данная система представляет собой металлический электрод; его схема (с указанием концентрации ионов)
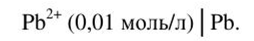
На границе металл-раствор устанавливается равновесие 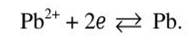 Используем уравнение Нернста:
Используем уравнение Нернста:
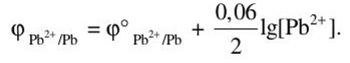
Произведем вычисления:

Пример 2
Вычислите электродный потенциал окислительно-восстановительной системы
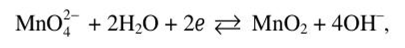
если pH 12, а [МпО4-] = 0,001 моль/л.
Решение. Стандартный электродный потенциал этой системы в щелочной среде 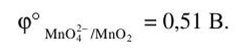
Электродный потенциал при нестандартных условиях вычислим по уравнению Нернста, не включающее концентрации Н20 и нерастворимого вещества МпО2:

Поскольку pH 12, то[Н+] =10-12:. Концентрация гидроксид- ионов 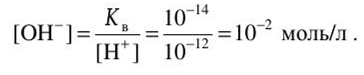
Вычислим потенциал: 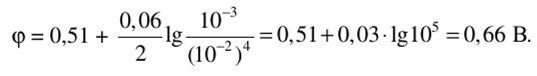
Дата добавления: 2020-11-23; просмотров: 209; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
