Обобщение изученного материала
Основные сведения о строении атома. Ядро. Электроны. Электронная оболочка. Энергетический уровень.
Изучение нового материала
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства.
В 1911 г англ. учёный Э. Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро.
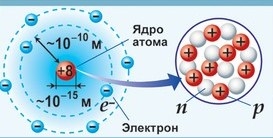
Из курса физики вам известно, что вокруг положительного ядра находятся отрицательно заряженные частицы электроны - е- . Электрон — мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10-19 К, принятым за элементарный электрический заряд. В электронейтральном атоме число электронов должно быть равно заряду ядра и, следовательно, порядковому номеру элемента. Размер атома определяется размером его электронной оболочки. Атом может терять электроны и становиться положительным ионом или присоединять электроны и становиться отрицательным ионом. Заряд иона определяет число потерянных или присоединенных электронов. Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
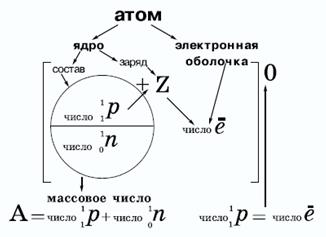
Атомное ядро (центральная часть атома) состоит из элементарных ядерных частиц — протонов и нейтронов. Радиус ядра примерно в сто тысяч раз меньше радиуса атома. Плотность атомного ядра чрезвычайно велика. Протоны (p+) — стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона. Протон представляет собой ядро атома самого легкого элемента — водорода. Число протонов в ядре равно Z. Нейтрон (n0) — нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А — Z, где А — массовое число данного изотопа. Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
|
|
|
Химические свойства атомов зависят от строения их электронных оболочек. Строение электронной оболочки изображается электронной формулой, которая показывает распределение электронов по энергетическим уровням и подуровням. В этих формулах энергетические уровни обозначаются цифрами 1, 2, 3, ..., подуровни – буквами s, p,d, f. Число электронов на подуровне обозначается цифрой, которая записывается справа вверху от буквы, показывающей подуровень. Например: 1s22s2.
Электронная конфигурация атома может быть изображена также в виде схем размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с противоположно направленными спинами ↑↓ . Порядок размещения электронов в пределах одного подуровня определяется правилом Хунда: в пределах подуровня электроны размещаются так, чтобы их суммарный спин был максимальным. Иными словами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
|
|
|
Характеристика 4 квантовых чисел
· Главное квантовое число (n) — характеризует энергию и размер орбитали. Оно принимает значения от 1 до : n = 1, 2, 3, 4, 5, 6, 7.
· Побочное (орбитальное) квантовое число ( l ) - характеризует форму орбиталей и принимает значения от 0 до (n - 1): 1 = 0, 1, 2, 3, 4. Например, если n = 2, то 1 имеет 2 значения: 0, 1. Значит, на 2 энергетическом уровне есть сферическая орбиталь (l = 0) и в виде объемной восьмерки (гантелеобразная) (l = 1).
· Магнитное квантовое число (m) - характеризует количество орбиталей одинаковой формы и ориентацию их в электромагнитном поле ядра атома. Оно принимает значения в интервале от —1 до +1. Для каждого значения разрешено (2*l + 1) значений числа m. Например, если l = 1, то m имеет (2*1 + 1) 3 значения: — 1,0, +1.
· Спиновое квантовое число (s) - характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 () и -1/2 (). (Спин электрона — свойство электрона вести себя как крошечный магнит).
|
|
|
Для записи электронной конфигурации атома можно применить несколько способов.
Первый способ:
Для выбранного элемента по его местоположению в периодической таблице химических элементов Д.И.Менделеева можно записать матрицу строения электронной оболочки атома, соответствующую данному периоду.
Например, элемент иод: 12753I 1s2s2p3s3p3d4s4p4d4f5s5p5d5f
По таблице, последовательно переходя от элемента к элементу, можно заполнить матрицу в соответствии с порядковым номером элемента и порядком заполнения подуровней:
12753I 1s22s22p63s23p63d104s24p64d104f05s25p55d05f0
Но, подуровни заполняются в последовательности s-f-d-p, и при использовании данного способа мы не наблюдаем поочерёдности в заполнении электронных оболочек.
Второй способ:
Можно рассмотреть порядок заполнения уровней и подуровней электронами, используя понятия основного принципа - принципа наименьшего запаса энергии: наиболее устойчиво состояние атома, при котором его электроны имеют наименьшую энергию.
Т.е. основываясь на Запрете Паули, Правилах Хунда и Клечковского
|
|
|
Запрет Паули: в атоме не может быть двух электронов, четыре квантовых числа которых одинаковы (т.е. каждая атомная орбиталь не может быть заполнена более чем двумя электронами, причем с антипараллельными спинами.)
Правило Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарное спиновое число их было максимальным, т.е. наиболее устойчивому состоянию атома соответствует максимально возможное число неспаренных электронов с одинаковыми спинами.
Правила Клечковского: А) Заполнение электронных слоев электронами начинается с уровней и подуровней, обладающими самыми низкими значениями n и l, и идет в порядке возрастания n+l;
Б) Если для двух орбиталей сумма n+l окажется одинаковой, то в первую очередь электронами заполняется орбиталь с меньшим значением n.
Первый случай не показывает последовательность заполнения подуровней, а второй - требует время для построения таблицы.
Обобщение изученного материала
- Определите состав атомных ядер у элементов с порядковым номером 16, 35, 40, 18.
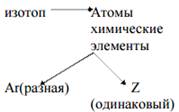
- Какой состав имеют атомные ядра? 11 H, 21 H, 31 H
- Составьте схему, что такое изотоп. Обсуждение полученных схем.
Дата добавления: 2020-11-23; просмотров: 91; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
